1. 서 론
2. 리튬이차전지의 구조와 성분
3. 건식제련 공정
3.1. 전처리 공정(Pretreatment process)
3.2. 배소 공정(roasting process)
3.3. 제련 공정(smelting process)
4. 리튬 회수를 위한 추가 공정
4.1. 염화 배소(chlorination roasting)
4.2. 탄산수 침출(carbonated water leaching)
4.3. In-situ 환원 배소
5. 결 론
1. 서 론
희소 원소로 간주되는 리튬은 가장 가벼운 금속으로써 높은 비용량(specific capacity, 3.86 Ahg−1)과 극도로 낮은 전극 전위(electrode potential, 표준 수소 전극 대비 -3.04 V)를 가지고 있어 고전압/고에너지 배터리에 이상적인 양극 소재(cathode material)이다1).
리튬이차전지(Li-ion battery)는 1991년 최초 상용화되어 휴대용 전자 기기에 널리 사용되기 시작하였으며, 현재에는 친환경 차세대 전기 자동차에 전원을 공급하기 위해 사용된다2). 플러그인 하이브리드 전기자동차(plug-in hybrid electric vehicle, PHEV), 하이브리드 전기자동차(hybrid vehicle, HEV) 및 전기자동차(electric vehicle, EV) 시장의 급격한 확장으로 인해 리튬이차전지의 수요량은 급격히 증가할 것으로 예상되며, 이는 리튬 금속 자원(Li metal resources)의 자연 공급에 대한 위험으로 이어질 수 있다. 이미 전 세계적으로 리튬이차전지에 대한 수요는 폭발적으로 증가하였고, 미국과 유럽의 수입량은 매년 80억 개에 달하는 것으로 추정된다3). 탄산리튬(Li2CO3)의 수요는 2015년 265,000 톤에서 2025년 498,000 톤으로 증가할 것으로 예상된다. 이로 인해 리튬(Li)은 2023년 이후 공급 부족에 시달릴 것으로 예측된다4). 리튬의 수요와 공급 사이의 큰 격차는 리튬의 지속적인 가격 상승으로 이어지기 때문에, 수급 불안정을 피하고 생산 비용을 낮추기 위해 가능한 모든 자원에서 리튬 금속을 회수하는 것이 매우 중요하다.
사용된 리튬이차전지의 리튬 농도(5-7 wt%)는 천연자원보다 훨씬 높다5). 결과적으로 사용된 리튬이차전지는 거대한 리튬 저장소로 간주될 수 있다. 또한, 지속적으로 증가하는 리튬이차전지의 수요와 함께 수명이 다한 리튬이차전지는 계속 축적될 것이기 때문에 사용한 전지의 재활용은 현재 주요 기술 과제이다6). 높은 비율의 중금속과 독성 전해질을 포함하고 있는 리튬이차전지의 부적합한 방법을 통한 폐기는 환경오염의 원인이 될 수 있다7). 따라서 천연 리튬 자원의 지속 가능한 관리 및 친환경적인 생산 방법 개발을 위해서는 리튬 회수를 위한 획기적인 재활용 프로세스를 개발하는 것이 중요하다.
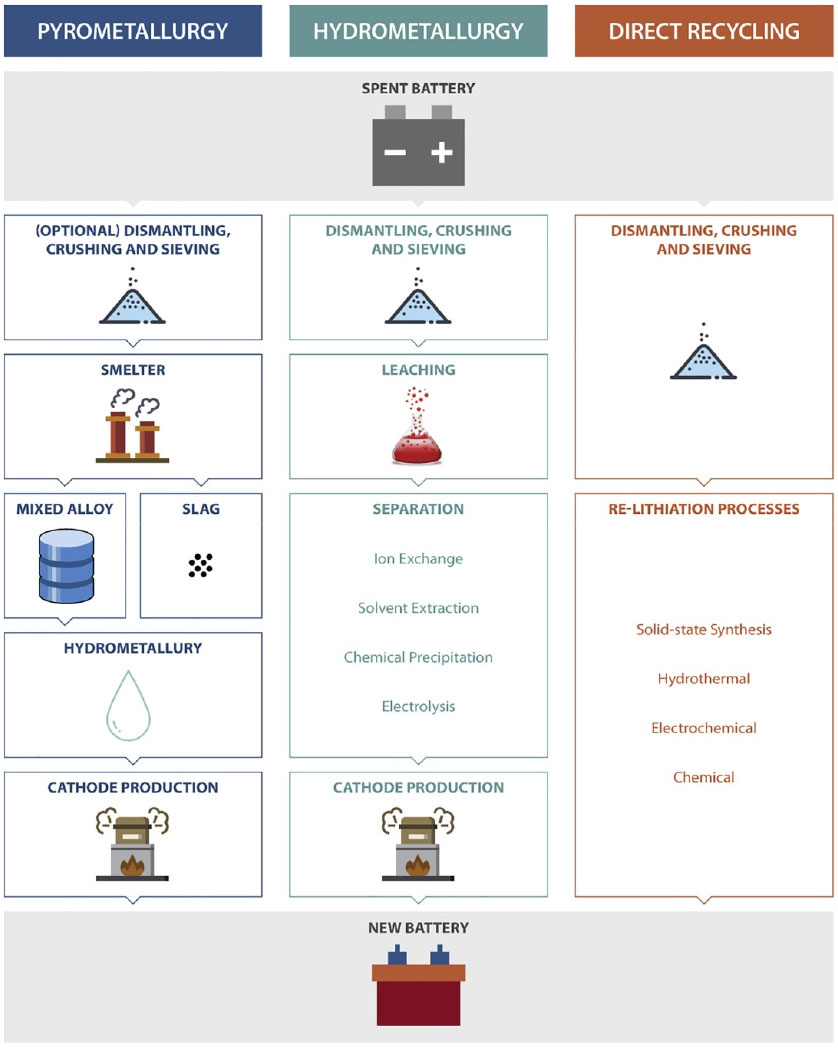
현재 건식 제련(pyrometallurgy), 습식 제련(hydrometallurgy) 및 직접 재활용(direct recycling) 방법을 포함한 세 가지 주요 폐전지 재활용 방법이 주목 받고 있으며, 세 가지의 다른 재활용 기술을 Fig. 1에 나타내었다8). 건식과 습식 제련법은 이미 많은 연구가 이루어졌으며, 실제 산업 현장에서 도입이 되어 사용되기 시작하였다. 직접 재활용 방법은 현재 실험실 및 파일럿 규모로 연구가 활발히 이루어지고 있다. 세 가지 재활용 방법의 특징 및 장단점을 Table 1에 나타내었다.
Table 1.
Comparison between the different LIB recycling processes9)
습식 제련은 양극재(cathode materials)를 회수하기 위해 전처리(pretreatment) 후 침출(leaching) 및 선택적 침전(selective precipitation), 이온 교환(ion exchange) 및 유가 금속을 추출하기 위해 용매 추출(solvent extraction)과 같은 추가 정제 및 회수 기술을 포함한다10). 일부 습식 제련 공정은 양극 활물질의 높은 원자가 상태(high valance state)와 유기물 바인더(organic binders)의 강한 결합력으로 인해 상대적으로 긴 침출 시간과 낮은 침출 효율의 단점이 있다11). 또한, 고농도의 산성 용액 및 환원제의 방대한 사용과 복합적인 공정단계는 상당한 폐수를 발생하며, 이는 침출 공정 동안 폐수 및 유해 가스 배출로 인한 2차 오염을 일으킬 수 있다12). 리튬 또한 이러한 분리 및 정제 단계 공정 중 분산될 수 있으며, 이는 낮은 리튬 회수율로 이어질 수 있다.
이러한 단점들을 극복하고, 금속을 추출하고 정제하기 위하여 건식 제련 방법이 사용될 수 있다. 건식 제련 재활용 공정은 빠른 화학반응에 의해 처리 용량이 크다. 또한, 공급 재료가 상대적으로 유연하고 공정이 간단하며, 광재(dross)가 환경에 미치는 영향 또한 미미한 수준이다13). 아울러, 건식 제련 공정은 상대적으로 충분한 연구가 이루어지고 발달하여 산업적으로 주도적인 재활용 방법이지만14,15), 폐 리튬이차전지에서 유가 금속을 보다 효율적으로 추출하고 분리하려면 지속적인 연구 개발이 요구된다.
따라서, 본 논문에서는 건식 재활용 공정을 이용한 사용 후 리튬이차전지의 유가금속 회수에 대한 연구동향을 살펴보았다.
2. 리튬이차전지의 구조와 성분
Fig. 2는 리튬이차전지 셀과 그 동작 원리를 개략적으로 나타낸 그림으로서, 리튬이차전지 셀은 양극(cathode), 음극(anode), 전해질(electrolyte), 분리막(separator) 및 집전체(copper and aluminum current collectors)의 주요 구성 요소들로 이루어져 있다14,16). 대부분의 리튬전지는 전해질(electrolyte), 분리막(separators), 케이스(casing) 등의 표준 부품은 공유하며, 양극 활물질로 사용되는 리튬화 금속 산화물의 종류에 따라 차별화된다.
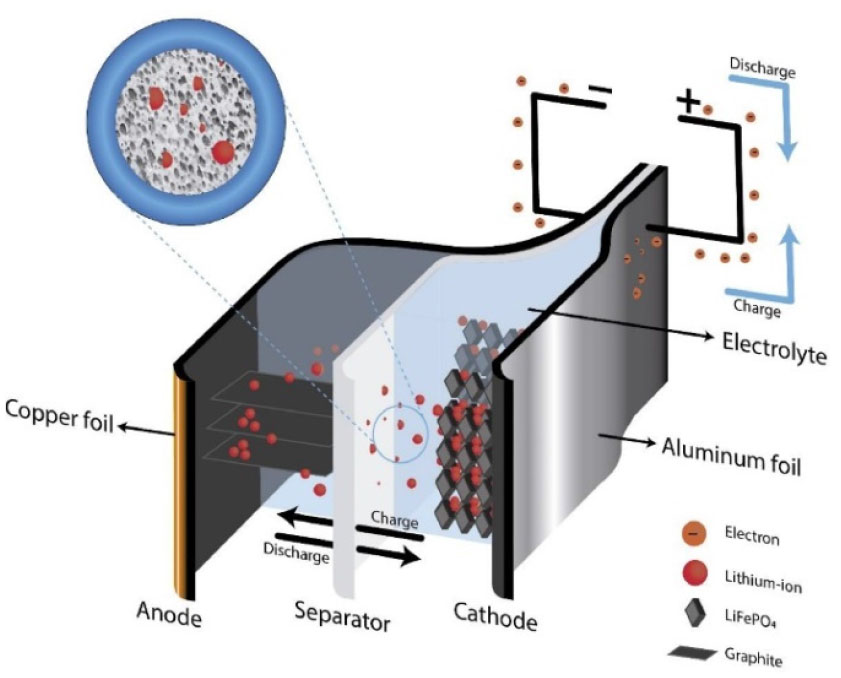
Fig. 2.
Lithium ion battery (LIB) components, charge and discharge process and lithium-ion movement in LIBs9).
양극은 전기화학적으로 삽입된 활물질로 덮인 전도성을 가진 알루미늄 금속 막으로 구성되어 있으며 음극은 흑연으로 코팅된 구리 막(copper foil)으로 이루어져 있다. 음극 재료로 탄소를 선택하는 이유는 풍부한 가용성, 저렴한 비용, 높은 쿨롱 효율(coulombic efficiency) 및 긴 수명 때문이다. 전해질은 충전 시 양극에서 음극으로 이온의 이동을 촉진하고, 방전 시 역으로 이온의 이동을 촉진하여 전지를 전도성으로 만드는 역할을 한다. 리튬이차전지 용 전해질은 고분자 전해질17), 콜로이드(colloidal) 전해질, 액체 전해질 또는 세라믹 전해질의 형태로 존재한다18). 전해질의 종류에 따라, 사이클 효율, 작동 온도 범위, 특정 용량 및 안전 문제와 밀접한 관련이 있기 때문에 적절한 전해질의 선택은 중요하다. 분리막은 양극과 음극을 분리하고, 전자가 전지 내에서 자유롭게 이동하는 것을 차단한다. 또한, 분리막은 전지 내에서 퓨즈(fuse) 역할을 하여 양극과 음극 사이의 단락을 방지한다. 분리막은 대체로 Polypropylene(PP) 또는 Polyethylene(PE)로 구성된다. 양극과 음극은 각각 다른 재료로 구성된 집전체(current collector)를 가진다. 음극 집전체에 구리를 선택하는 이유는 낮은 전압에서 리튬의 층간 삽입(intercalation) 현상이 없는 몇 안 되는 금속 중 하나이기 때문이다. 집전체는 고분자 바인더로 전극과 연결되어 있으며, 바인더는 셀들을 효과적으로 결합하기 위해 우수한 기계적 및 화학적 강도를 가져야 하며, 주로 Polyvinylidene fluoride(PVDF) 또는 polytetrafluoroethylene(PTFE)가 대체로 사용된다19,20).
마지막으로, 리튬이차전지의 양극재는 일반적으로 LiCoO2, LiNiO2, LiMn2O4 또는 LiNiMnCoO2와 같은 리튬 금속 산화물로 만들어진다. 리튬이차전지는 양극재의 종류에 따라 분류된다. 리튬이차전지 시장에서 가장 자주 사용되는 양극 활물질은 LiCoO2이며, 다루기 쉽고, 고용량이며 안정성이 우수하여 휴대폰, 카메라 및 노트북 등에 사용된다. LiMn2O4 양극재는 제조가 간단하며, 친환경적이고 저렴하다. LiCoO2 양극재와 비교하여 용량이 적으나 수명이 길다. LiNiO2 양극재는 저렴하고 에너지 밀도가 높으나, LiCoO2 양극재 보다 낮은 안정성을 가진다. LiFePO4 양극재는 저렴하고, 안정적이며 친환경적이나, 용량과 이온 투과율(ion transmission)이 적다. LiNiMnCoO2 양극재는 저렴하고, 안정적으로 고출력(high power)을 얻을 수 있다21). 앞서 언급하였듯이, 음극은 대부분 흑연이기 때문에, 리튬이차전지 내에 있는 대부분의 귀금속은 양극에서 찾을 수 있다. Table 2는 리튬이차전지 재활용 작업에서 회수 가능한 다양한 금속의 함량을 보여주며, 코발트(Co), 리튬(Li), 니켈(Ni) 및 망간(Mn)은 양극재에서 회수가 가능하다22).
Table 2.
Valuable metals in the most common commercial LIBs9)
| Battery types | Metal types (elemental weight %) | ||||||
| Co | Li | Mn | Ni | Cu | Al | Fe | |
| LiNixCoyMnzO223) | 14.88 | 5.75 | 16.96 | 21.87 | 0.05 | 10.82 | |
| LiCoO224) | 16 | 2 | - | - | 10 | 3 | 19 |
| LiCoO225) | 5-20 | 5-7 | - | 5-10 | - | - | - |
| LiCoO226) | 16.5 | 2 | - | - | 7.1 | 4.1 | - |
| LiCoO27) | 29.49 | 3.14 | - | 0.02 | 16.48 | 8.02 | - |
| LiCoO227) | 27.5 | 14.5 | - | - | 24.5 | 14 | - |
| LiNiMnCoO212) | 8.45 | 1.28 | 5.86 | 14.84 | 16.6 | 22.72 | 8.79 |
3. 건식제련 공정
건식제련은 고온에서의 용융 공정을 통해 금속과 산화물을 분리하여, 전지 내의 유가 금속들을 합금의 형태로 회수하는 공정으로 건식 제련의 장점은 아래와 같으며8,14), 이를 위해 사용 후 전지의 방전(discharging), 파·분쇄(dismantling/disassembling), 전처리(pretreatment) 및 추출 야금(extractive metallurgy)의 4단계 공정으로 구분될 수 있다.
(1) 공정이 비교적 간단하며, 화학반응 속도가 빨라 대량 공정이 가능하다.
(2) 재료의 분류 또는 다운사이징 공정이 필수적이지 않다. 따라서 다른 종류의 전지들도 분류 과정을 거치지 않고 바로 공정이 가능하다.
(3) 전지 셀과 모듈의 부동태화(passiavation)를 위한 작업 없이 바로 공정이 가능하다.
(4) 습식 공정에 비해 폐 오수의 발생이 적어 친환경적이다13).
3.1. 전처리 공정(Pretreatment process)
리튬이차전지는 높은 반응성과 고에너지 금속 및 가연성 전해질의 포함으로 인해 취급이 가장 위험한 전지 유형으로 열적 전처리를 통해 리튬 전지의 가연성 유기 성분을 안전하게 비활성화하고 분해할 수 있다. 또한, 전지의 잔류 에너지를 제거하여 방전 효과도 얻을 수 있다. 전지의 잔류 에너지는 불필요한 화학반응을 일으킬 수 있으므로 분해하기 전에 방전을 하는 것이 안정성과 안전을 보장하는 데 중요하다. 그렇지 않으면, 리튬전지의 양극과 음극의 접촉 시 단락(short-circuit)되어 자체 발화 또는 유독 가스 방출로 이어질 수 있다.
그 밖에도 고온에서의 열처리를 통해 유기물로 구성된 바인더 재료와 탄소를 효과적으로 제거할 수 있다. 전처리 과정에서 완전히 제거되지 않은 탄소는 리튬 침출 과정에서 리튬 이온을 흡수하여 리튬 침출 효율을 낮추기 때문에 탄소를 완전히 제거하여야 한다28). 또한 유기 바인더는 양극 활물질과 접착력이 강해 양극 분말이 알루미늄 기재에 붙은 채로 남아있어 회수율에 악영향을 준다. 유기물 성분은 침출 및 고상과 액상의 분리를 방해하는 작용을 한다. 양극이 전해질로 코팅된 상태로 남아 있으면 이로 인해 양극과 음극 간의 소수성 차이(hydrophobicity differences)가 미미해지기 때문에 포말 부유 선광(froth flotation)과 같은 이차 공정에 영향을 미친다.
소각(Incineration) 공정은 공기 중 또는 산소 분위기에서 탄소와 바인더를 연소시키는 고온 공정(600~1000 °C)을 의미한다28). 이를 통해 모든 유기 화합물과 플라스틱 커버도 함께 소각된다. 앞서 언급하였듯이, 잔여 탄소 성분은 리튬 침출 공정에서 리튬 염의 흡수제로 작용하여 리튬 회수율을 낮출 수 있기 때문에 탄소의 완전한 제거와 리튬 회수율의 향상을 위해 소각 온도의 최적화는 중요한 변수로 작용한다29).
3.2. 배소 공정(roasting process)
배소는 고온에서 기체-고체 반응을 일으켜 후속 과정에서 유리한 화학적 특성을 부여하기 위한 과정이다. 배소 반응은 공정 중 사용된 가스의 종류와 분위기에 따라 환원 배소, 산화 배소, 염화 배소 그리고 황산화 배소 등이 있다. 그중에서도 환원 배소와 산화 배소는 폐 리튬이차전지의 재활용에 많이 활용되고 있다.
환원 배소는 산화광/산화물과 환원제를 함께 가열하여 저급 산화물이나 금속상태로까지 환원시키는 공정이다. 예를 들어, 제철 과정을 위한 산화철의 환원 반응은 다음과 같다30).
리튬이차전지의 환원 배소 공정에서는 양극 활물질을 환원제인 탄소, 차콜 또는 코크스 등과 함께 가열하여 탄소 잔여물과 추가 정제를 위한 합금 또는 금속 간 화합물 등의 혼합물을 생성한다. 예를 들어, 리튬 금속 산화물은 낮은 원자가 상태로 환원되어 리튬 회수를 위한 추가 침출 공정에 유리하다. 또한, 탄소열 환원 공정 시 첨가된 탄소 원자는 리튬 금속 산화물(LiCoO2)의 산소 팔면체의 파괴를 일으켜 리튬과 코발트가 쉽게 분리될 수 있도록 촉진한다31).
산화 배소는 원료와 산소를 함께 가열함으로서 산화물 생성을 통해 불순물을 제거하기 위한 목적으로 가장 널리 사용되는 배소 방법 중 하나이다. 주로 황화물의 황을 제거하여 산화물로 변환하기 위하여 많이 사용되는 공정으로 반응은 다음과 같다32).
Y. Jie 등은33) LiFePO4 전지 재활용을 위해 산화 배소 공정을 행하였으며, 산화 배소 공정 후 탄소 및 불소와 같은 불순물의 함량은 크게 감소하였고, LiFePO4 양극재는 다음과 같이 산화되었음을 보고하였다.
산화 배소 후 소성된 양극재의 응집도는 본래의 양극재의 응집도 보다 훨씬 낮은 것으로 나타났다. 또한, 산화 배소 공정 조건(온도, 산소 농도 및 유량)이 회수율과 침출율에 미치는 영향을 연구하였으며, 공정 조건의 최적화(온도: 500 °C, 산소 농도: 21 %, 공기 유량: 300 mL/min)를 통해 높은 회수율과 침출율 그리고 낮은 불순물 함량을 얻었다33).
3.3. 제련 공정(smelting process)
제련은 폐 리튬전지에서 고가의 금속을 추출하기 위해 사용되는 가장 효과적이고 널리 쓰이는 건식 공정 방법이다. 제련공정 또한 고온에서 이루어지지만 배소와의 가장 큰 차이점은 공정 온도이다. 배소는 기체-고체 반응에 의한 공정이기 때문에 원료의 용융점 아래에서 이루어지는 반면, 제련은 액상 상태에서의 반응에 의한 공정이므로 원료의 용융점 이상의 높은 온도가 요구된다. 제련 공정에서 전지 재료는 용융온도 이상으로 가열된 후 환원에 의해 액체 상태의 금속이 분리되고 혼합되지 않는 용융층을 형성한다. 제련 공정의 장점은 다양한 화학적 조성을 가진 폐전지의 재활용이 가능하며, 앞서 소개한 분류 및 전처리 단계 없이 전지의 셀과 모듈을 고온로에 바로 장입할 수 있다는 것이다. 그러나 전처리되지 않은 전지가 갑자기 고온에 노출되면, 전해질의 급격한 증발로 인한 과압이 형성될 수 있다. 그로 인해 전지가 폭발할 위험이 있으므로, 폐전지를 낮은 온도에서 먼저 가열하여 전해질을 증발시킨 후, 용융점 이상의 고온에서 가열하여 원료를 용해한다34). 제련 공정 시 모든 유기 물질은 연소되며, 리튬전지에 존재하는 탄소와 알루미늄은 환원제로 작용하게 된다35).
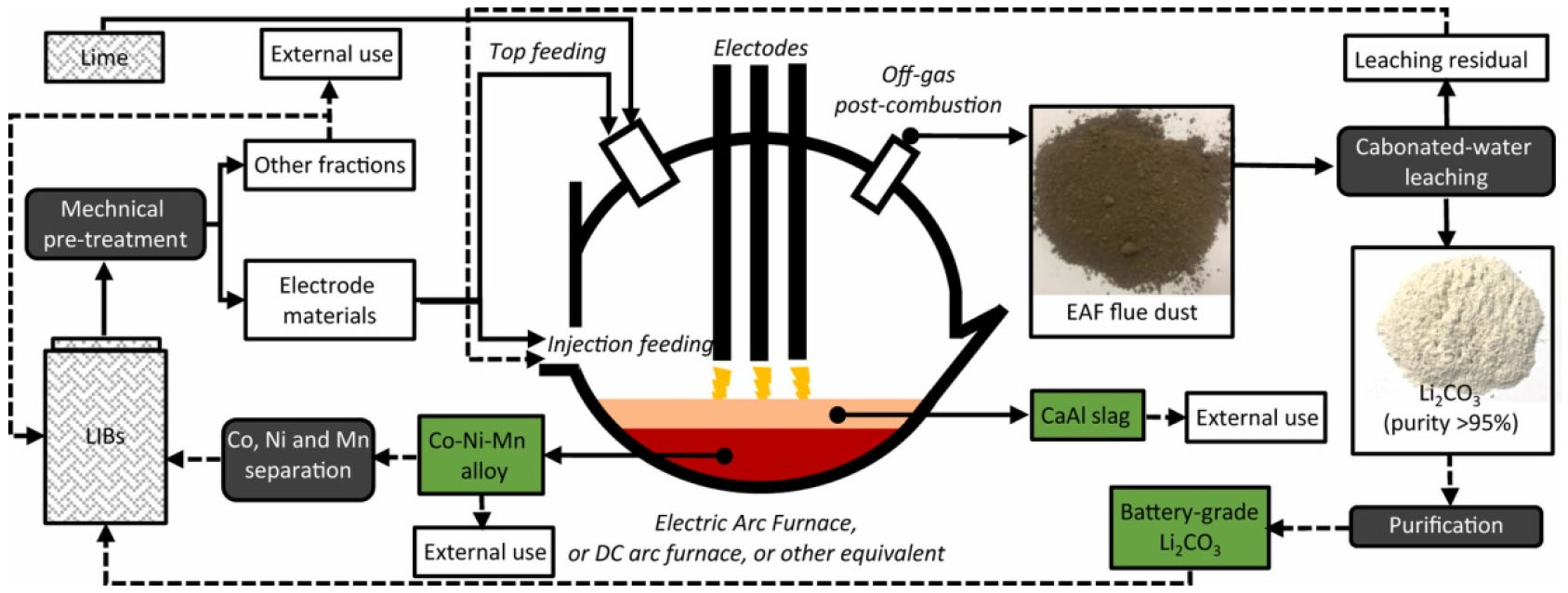
환원 제련 공정이 완료된 후, 환원된 전이금속은 용융 합금 상(molten alloy phase)으로 농축되어 용해로(melting furnace) 바닥으로 이동하여 용융 금속 풀(molten metal pool)을 형성함으로써, 금속 합금 층과 슬래그 층으로 나뉜다. 그 후 유가 금속은 습식 제련 공정을 통해 합금에서 회수된다34,36). 반면, 리튬은 산화물로 존재할 때가 더 안정적이기 때문에 리튬 산화물은 환원되지 않고, 슬래그 상에 분포한다37). 리튬과 망간은 환원되지 못하고 슬래그 상으로 손실되기 때문에, 최근 스피넬 망간 산화물 또는 LiFePO4를 포함하는 양극재가 아닌 회수율이 높은 코발트 또는 니켈의 함량이 높은 전지가 더 경제적으로 여겨진다. 환원 제련은 공정이 간단하고 생산성이 높아 실제 재활용 산업에서 널리 사용된다14). 예를 들어, 벨기에의 재활용회사인 Umicore에서는 초고온 제련 기술을 사용하여 전처리 단계 없이 연간 7,000톤의 폐전지를 재활용하며, 작업 공정도를 Fig. 3에 나타내었다38). Umicore에서 제련 공정은 1200~1450 °C의 고온에서 이루어지며, 공정 후 결과물은 크게 세가지로 나뉜다. 첫 번째로, Ni, Co, Cu 그리고 Fe를 포함하고 있는 합금이 형성되며, 이는 추가 습식 공정을 통해 각 원소를 추출하여 최종적으로 Cu, Fe, CoCl2 그리고 Ni(OH)2의 형태로 회수한다. 합금에 포함되지 못하고 산화 된 Al, Si, Li, Ca 그리고 Mn은 슬래그에 포함 된다. 마지막으로, 공정 중 생성 된 가스는 필터를 통한 정화 단계를 거쳐 깨끗한 가스로 배출된다. 현 공정의 단점은, 다량의 리튬이 더스트 또는 슬래그로 유실되어 회수 되지 못한다는 것이다. 이러한 단점을 극복하기 위해, 리튬 회수를 위한 제련 후 추가 공정 개발을 위한 노력이 이루어지고 있다.
3.3.1. 환원 제련 공정의 슬래그 시스템
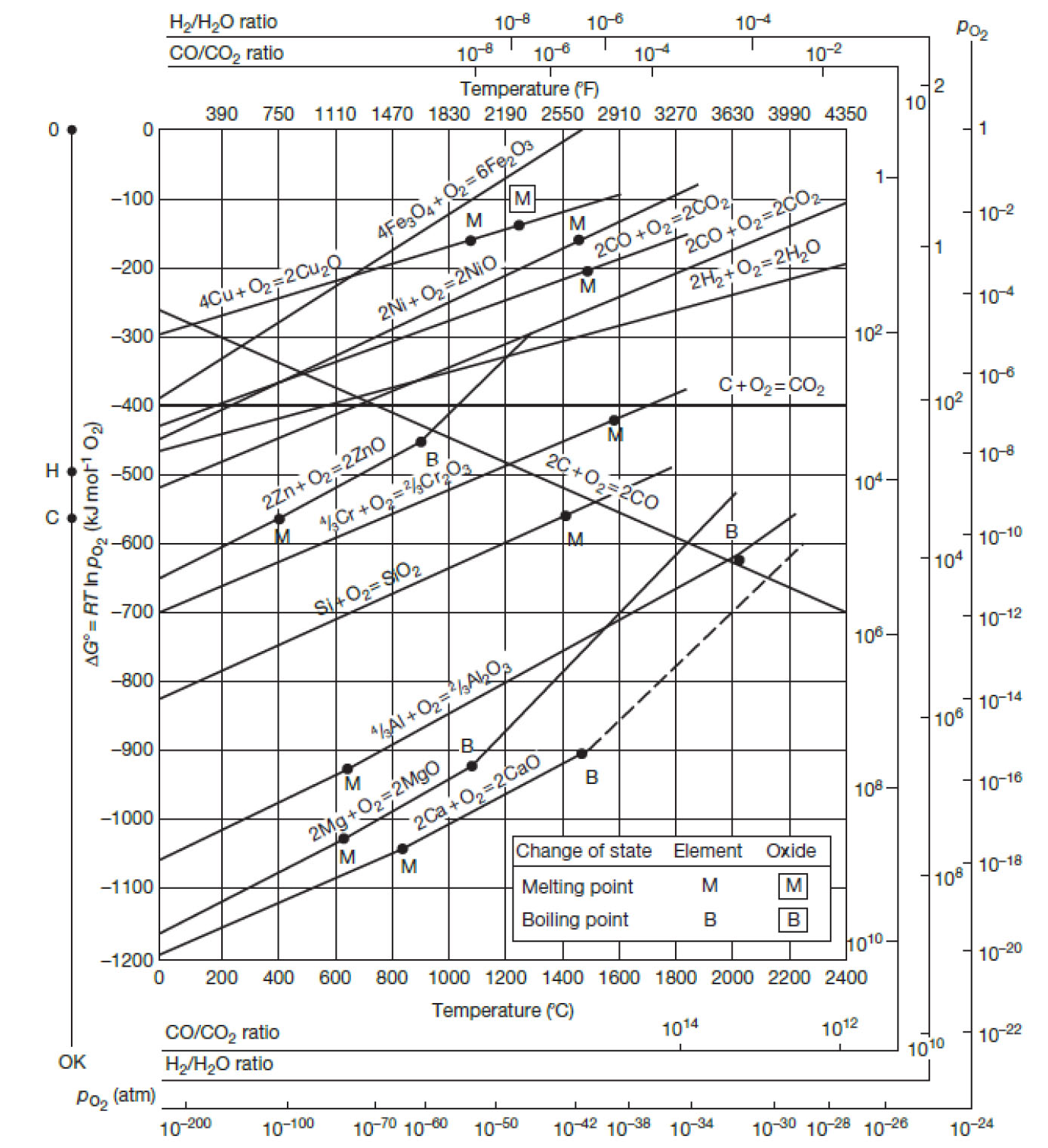
슬래그 시스템의 설계는 효율적인 제련 공정을 위해 매우 중요한 역할을 한다. 환원 제련 공정에 사용되는 슬래그는 금속 액상에 쉽게 유화되어야 한다. 그러기 위해, 슬래그는 응집력과 점도가 낮고 용융온도 또한 낮을수록 유리하다. 그러나 유화된 슬래그 입자는 금속과의 접착력(adhesion)이 낮아 금속에서 쉽게 분리되는 반면 황 및 비금속 개재물에 대한 접착력이 높아 제련성을 향상시킬 수 있어야 한다39). 따라서 슬래그 시스템 설계의 목적은 폐전지 내 경제적 가치가 낮은 금속을 최대한 산화시켜 슬래그에 포함되게 하고, 유가 금속의 산화는 억제하여 합금층에 포함되도록 유도하는 것이다. 철과 코발트의 산소 친화도는 유사하여, 산화 반응이 거의 동시에 일어난다. 철의 일부는 합금 층으로 포함되고, 대부분은 슬래그 층으로 분류되도록 산화도를 제어한다. 산화도를 효과적이고 정확하게 제어하기 위해 각종 산화물의 표준 생성 자유에너지(Gibbs free energy)와 온도의 관계를 보여주는 표준 생성 자유에너지-온도도(Ellingham diagram)를 사용할 수 있다40). Fig. 4은 표준 생성 자유에너지-온도도를 나타낸 그래프로서 직선의 아래쪽에 위치하는 금속일수록 산화되기 쉬우며, 그 산화물은 안정하다.
뿐만 아니라, 제련 공정 시 플럭스 성분을 첨가하여 저 점도 및 저 융점 슬래그의 설계 및 조제하여 금속성분의 회수율을 향상하기 위한 연구들이 많이 보고되고 있다41,42,43,44).
가장 일반적으로 널리 사용되는 슬래그 시스템은 CaO-SiO2-Al2O3이다. 이 슬래그 시스템에서 SiO2와 CaO는 슬래그 형성을 위한 플럭스로 첨가되고, 다량의 Al2O3는 폐전지의 환원 반응에서 생성된다. SiO2와 CaO는 슬래그의 온도 제어(낮은 용융점)와 유동성에 효과적인 영향을 미치기 때문에 선택되었다. 슬래그 상에 Al2O3 함량이 너무 높으면 점도와 용융점이 높은 슬래그가 형성 되고, 이는 슬래그 층과 합금 층이 분리될 때 합금 방울이 슬래그 상에 끌려들어 가는 현상이 일어날 수 있다. 이는 곧 금속의 손실을 유발하여 회수율에 악영향을 준다. 또한, SiO2 역시 제련 슬래그 시스템에서 중요한 원소이지만 함량이 너무 높으면 슬래그 내의 산화물의 흡수를 방해함으로써 제련 공정에 악영향을 미칠 수 있다39). 또한, 슬래그의 염기도와 CaO/SiO2 또는 CaO/Al2O3 사이의 반응으로 인해 생성되는 복합체도 슬래그의 점도에 밀접한 영향을 미치는 것으로 보고되었다41). 따라서 높은 금속 회수율을 구현해낼 최적의 특성을 갖춘 슬래그를 얻기 위해 슬래그의 구성 요소 및 설계는 매우 중요하다.
기존의 CaO-SiO2-Al2O3 슬래그 시스템에서는 리튬과 망간은 합금 층이 아닌 슬래그 층으로 유실되기 때문에, 리튬 회수를 위해 추가로 습식 공정을 거쳐야 한다는 어려움이 있다37,45). 이런 단점을 극복하고 최적의 리튬 및 유가 금속 회수율을 얻기 위해 슬래그 시스템 설계를 통한 다양한 시도가 이루어지고 있다. Ren 등은 공정을 간소화시키며, 망간과 리튬 회수율을 높이기 위해 MnO-SiO2-Al2O3 슬래그 시스템을 제안하였다46). 고온에서의 제련 공정 후 Co-Ni-Cu-Fe 합금과 리튬을 포함한 망간 함유량이 높은 슬래그(tephroite와 galaxite)가 생성되었다. 생성된 슬래그는 추가 공정인 황산(H2SO4)에서의 침출을 통해, 망간은 79.86 % 그리고 리튬은 94.85 %의 높은 회수율을 얻을 수 있었다46). 또한, T. Georgi-Maschler 등은 FactSage 열역학 계산 프로그램을 사용하여 다양한 슬래그 시스템의 열역학적 특성을 평가하기 위해 금속과 슬래그 사이의 코발트 및 망간의 이론적인 분포 계수를 계산하였고, 54.5 wt% CaO – 45.5 wt% SiO2와 50.0 wt% Al2O3 – 45.0 wt% CaO – 5.0 wt% MgO슬래그 시스템이 폐 리튬전지에서 코발트와 망간을 재활용하는데 적합하다는 것을 보고하였다34). Ren 등은 환원 제련 공정에서 FeO-SiO2-Al2O3 슬래그 시스템을 적용하여 알루미늄 덮개와 함께 폐 리튬전지를 재활용하였다. 환원 제련 공정 후 Fe-Co-Cu-Ni 합금을 회수하였고 슬래그는 fayalite(Fe2SiO4)와 hercynite(FeAl2O4)로 구성되었다. 그러나 해당 슬래그 시스템에서의 리튬의 회수율은 언급되지 않았다43).
4. 리튬 회수를 위한 추가 공정
앞서 언급한 바와 같이 건식 제련을 이용한 재활용 공정의 가장 큰 단점은 리튬은 일반적으로 다른 귀금속들과 달리 저가의 금속들과 함께 슬래그 화가 되어 리튬을 효과적으로 회수하기가 어렵다는 것이다. 따라서 리튬 회수를 위해 다음과 같은 추가 공정이 필요하다.
4.1. 염화 배소(chlorination roasting)
증발(evaporation)은 비등점(boiling point)이 낮고 용융점은 높은 휘발성을 가진 물질의 추출을 위해 적합한 야금 분리 방법이며, 리튬과 같은 금속은 염화되기 쉬우므로 염화 배소를 통해 가능하다. 염소 가스(Cl2) 반응물을 이용한 염화 배소를 통해 β-spodumene(β-LiAlSi2O6)으로부터 염화리튬(LiCl) 형태로의 리튬을 추출하는 방법이 연구되었지만 이러한 공정을 위해서는 1100 °C의 높은 온도가 요구되며 염소 가스 누출의 위험성이 따른다47). 염화칼슘(Cacl2)은 금속을 추출하기 위한 염소 공여체(chlorinating agent)로 흔히 쓰이며, SiO2가 함께 존재할 때 가장 효과적인 것으로 알려져 있다48). Fig. 5는 CaCl2 과포화 상태에서 Si-Al-Li-O-Cl계의 온도에 따른 평형 조성을 HSC thermomechanical database software를 이용하여 계산한 결과를 보여준다49). Fig. 5에서 β-LiAlSi2O6의 염소화 반응이 연구에서 고려 된 전체 온도 범위(100~1000 °C)에서 강한 경향성을 가지고 있으며, 반응의 결과물로 LiCl, anorthite(CaAl2Si2O8) 그리고 SiO2가 생성됨을 보여준다. 온도가 증가함에 따라 wollastonite(CaSiO3) 와 andalusite(Al2SiO5)의 몰수가 증가하는 반면, anorthite가 감소하는 것으로 보아 anorthite의 열분해가 일어남을 알 수 있다.
Spodumene의 화학적 조성은 건식 공정의 제련과정을 통해 얻어진 슬래그와 매우 비슷하므로, 염화 배소 방법을 적용한 슬래그 내의 리튬 회수 방법 또한 활발히 연구되고 있다45,50,51).
H. Dang 등은 염화 배소 중 LiCl의 증발을 이용하여 슬래그로부터 리튬을 회수하는 방법을 제안하며, 염소 공여체의 종류(CaCl2), 공여체의 투입량(Cl/Li 몰 비율: 1.8), 배소 온도(1000 °C) 및 시간(90 분)의 최적화를 통해 리튬의 증발률을 97.45 % 까지 향상했다. 슬래그 내의 리튬이 LiCl의 생성을 통해 증발 된 것으로 사료된다50). 이렇게 염화 배소를 통해 생성된 LiCl은 물에 높은 용해도(25 °C에서 84.25 g / 100 mL)를 가진 수용성 물질이기 때문에 물에 용해하여 회수가 가능하다. H. Dang등은 염화 배소와 수 침출(water leaching) 공정을 적용하여 90.58 %의 리튬을 회수하였다45).
4.2. 탄산수 침출(carbonated water leaching)
J. Hu 등은23) 환원 배소 후 생성된 Li2CO3를 회수하기 위해 탄산수 침출 방법을 제안하였다. Li2CO3는 물에서의 용해도가 낮아 침출 효과가 매우 떨어진다. 이 단점을 극복하기 위해 탄산수 침출 방법이 적용되었다. LiNixCoyMnzO2 양극재는 배소 공정 후 Li2CO3, Ni, Co 그리고 MnO로 분해되며, 이렇게 생성된 Li2CO3는 다음과 같은 반응을 통해 침출된다.
CO2 가스를 물에 주입하면 배소 결과물의 Li2CO3가 더 잘 용해되는 LiHCO3로 변환되어 침출 효율이 향상된다. 침출 후 생성된 LiHCO3은 증발 과정을 통해 고순도의 Li2CO3로 변환되었다. X. Hu 등은37) Fig. 6와 같이 환원 제련 동안 발생하는 연진(flue dust)을 포집하여 연진과 슬래그에 포함된 리튬의 함량을 분석하였고, 폐 리튬전지의 약 60~70 %의 리튬은 연진에 포함되어 회수되었으며, 30~40 %의 리튬은 슬래그로 포함되었다. 슬래그에 존재하는 리튬은 산화물과 복합체를 이루어 상대적으로 안정된 상태인 LiAlO2와 LiCaSiO4의 형태로 존재한다. 슬래그에 포함된 리튬은 앞서 4.1.장에서 언급한 염화 배소등의 추가적인 공정을 통해서 회수가 가능하다. 하지만, 연진으로부터의 리튬을 회수하는 공정은 슬래그에서의 리튬 회수 공정보다 간단하다. 포집된 연진은 탄산수 침출을 통해 연진에 포함된 리튬을 Li2CO3의 형태로 회수하였으며, 이렇게 회수된 Li2CO3의 순도는 95.8%에 이른다37).
4.3. In-situ 환원 배소
‘in-situ’ 환원 배소 방법은 친환경 관점에서 큰 관심을 받으며 연구되고 있는 리튬 회수 방법 중 하나이다. In-situ 공정은 다른 첨가제 없이 사용한 전지의 열분해를 통해 바로 사용 가능한 형태로 변환하는 것이다. LiCoO2와 LiMn2O4 양극재를 가진 폐전지의 in-situ 회수 방법이 연구되었으며, Fig. 7과 같이 첨가제 없이 행해진 oxygen-free 배소 과정에서 혼합 전극 물질은 Li2CO3와 금속 및 금속 산화물로 변환되었다35,52). 리튬은 전극 결정 구조의 산소 구조(oxygen framework)에서 분리되어 Li2CO3로 변형된다. 그 후에, Xiao와 Mao는 in-situ 회수에 대한 이론적 분석을 제시하였으며, 리튬 및 코발트보다 산소에 대한 친화력이 강한 흑연에 의한 산소 팔면체의 붕괴와 리튬을 Li2CO3로의 변환을 일으키는 Collapsing 모델을 개발하였다31,53). 흑연이 연소될 때 이들 사이의 coupling 반응으로 인해 리튬 코발트 산화물의 열분해를 촉진함을 발견하였고 결과적으로 리튬 코발트 산화물의 분해 온도는 1,436 K에서 1,173 K로 감소하였다. 이런 coupling 반응 및 collapsing 모델은 in-situ 회수의 기본 원리를 설명하고 학계 및 산업계의 관련 기술 개발에 기여하고 있다31).
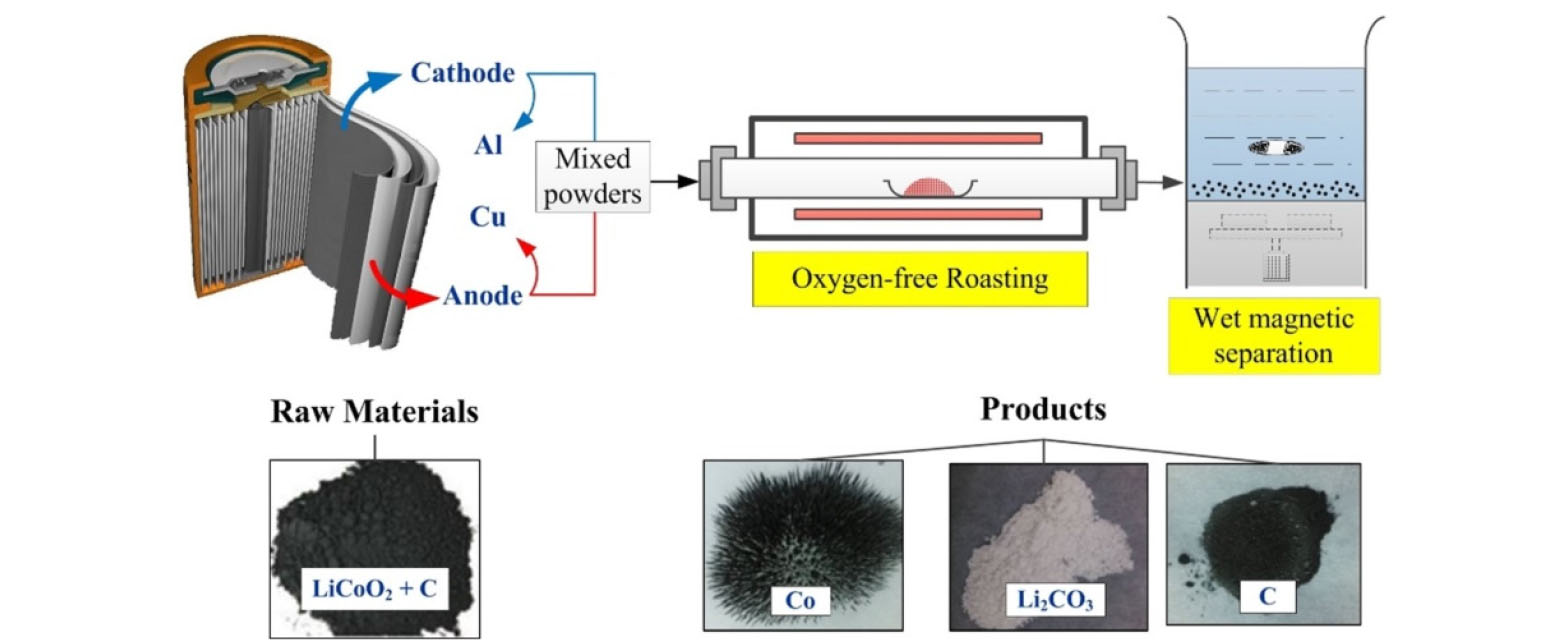
Fig. 7.
Overview of oxygen free roast/wet magnetic separation process for in-situ recycling of LiCoO2 batteries35).
Table 3은 폐 리튬이차전지의 건식 제련 방법을 통한 재활용의 최근 현황으로서 다양한 연구들이 진행되고 있음을 알 수 있다22).
Table 3.
Brief data review on pyrometallurgical recycling of LIBs22)
| Spent material | Reducing/fluxing agent |
Thermal-treatment condition |
Posttreatment leaching | Efficiency wt.% | |
| Co | Li | ||||
| Polymer LIB54) | Al can, pyrolusite, SiO2 | 800 °C, 2 h | H2SO4, H2O | 99.84 | 50.28 |
| LiCo0.7Ni0.15Mn0.15O255) | Activated carbon | 700 °C, 1 h | C6H8O7, Na2SO4, 1 M, H2O | >99 | 38.30 |
| LiCoO256) | Graphite, NaOH 10 % | 520 °C, 3 h | H2O | - | 93.00 |
| LiCoO2, LiMn2O4, LiNiO229) | Graphite | 400-700 °C, 0.5-1.5 h | - | - | - |
| LiCoO257) | Al foil | 600 °C, 1 h | NaOH 2.5 M | - | 93.67 |
| LiCoO258) | NaHSO4 · H2O | 600 °C, 0.5 h | H2O | 72.56 | 0.53 |
| LiCoO259) | HNO3, (70 °C, 5 h) | 250 °C, 1 h | H2O | <0.1 | >93 |
| LiCoO260) | NH4Cl | 350 °C, 20 min | H2O | 99 | 99 |
5. 결 론
전 세계적으로 전기 자동차 시장이 급격히 확장되며, 전기 자동차의 전원 공급원으로 사용되는 리튬이차전지의 수요량 역시 지속적으로 증가하고 있다. 이는 리튬 금속 자원의 공급에 대한 위험으로 이어져 가까운 미래에 공급 부족에 시달릴 것으로 예측된다. 따라서 리튬 금속의 공급 불안정 및 생산 비용의 안정화를 위해서 그리고 환경적인 측면에서 지속적으로 축적되는 수명이 다한 리튬전지의 폐기 문제를 해결하기 위해 리튬이차전지의 재활용은 불가피하다. 뿐만 아니라, 폐전지의 재활용을 통해 전지 내의 유가 금속인 코발트, 니켈 및 구리 또한 양극재로부터 회수가 가능하다. 건식 제련 재활용은 반응 시간이 짧고 생산성이 높으며 규모 확장이 용이하기 때문에 많은 연구가 이루어졌으며, 이미 산업 현장에 많이 도입되어 유가 금속 회수를 위해 사용되고 있다. 하지만, 리튬은 높은 산소 친화력으로 인해 공정 단계에서 슬래그로 손실되어 리튬의 회수율은 아직 다른 유가 금속의 회수율에 미치지 못한다. 따라서 리튬 회수율을 높이기 위한 후 공정에 대한 연구가 활발히 이루어지고 있다.
이와 같이, 건식 제련 재활용에 대한 지속적인 연구 및 개발을 통해 리튬 및 유가 금속의 회수율을 높이고 경제적으로 더 실현 가능한 순환 경제 기반을 마련할 수 있을 것으로 기대된다.