1. 서 론
2. 시료 및 실험 방법
2.1. 시료
2.2. 미생물 배양
2.3. 금속 용출실험 및 분석방법
3. 실험 결과 및 토론
3.1. 생물학적 용출의 이론적 배경
3.2. 금속 용출실험
4. 결 론
1. 서 론
우리나라의 광산은 크게 석탄 광산과 금속광산, 비금속 광산으로 이루어져 있으며, 한국광물자원공사 자료에 의하면 2018년 기준으로 국내 금속광산의 수는 약 230여 곳에 이른다1,2). 이 중 현재 가행 중인 금속광산은 2019년 기준으로 전북을 제외한 각 도에서 금․은․동, 연․아연, 철광, 티탄 철, 몰리브덴 외 기타 금속 광산으로 총 16 곳이 존재한다3). 자원의 희소성과 편재성으로 인해 산업원료인 광물을 안정적으로 공급하기 위해서 우리나라는 현재 국내 부존자원의 활용도를 높이고자 한국광물자원공사와 민간 기업이 공동 투자하여 소재원료의 안정적 공급과 금속광산의 재개발 활성화를 도모하고 있다. 지금까지 재개발 또는 조사가 추진 중인 광산으로 포천 티탄 철 광산, 정선 신예미 철 광산, 삼척 가곡 광산(연․아연 광산), 영월 상동 광산, 울진․제천․장수 몰리브덴 광산, 금산 우라늄 광산과 충북 음성과 전남 해남의 금 광산이 선정되었으며, 이 중 울진의 몰리브덴 광산이 개발 중에 있다4).
상기 금속 광산들의 광종은 주로 황화광으로, 함유된 금속의 특성을 이용하여 전기도금․반도체 소자, 기계․자동차․선박 제조 산업 외에도 초전도체 첨단 산업, 항공우주 등의 산업원료로 유용하게 이용되고 있다. 실제 유용 금속을 회수하기 위하여 자원분야에서는 선광/제련 등의 물리화학적 방법으로 금속광의 자원처리과정을 거치게 된다. 이 과정에서 전통적인 자원처리 방법을 통해 발생할 수 있는 환경적․경제적 문제를 보완하고자 자원처리 분야에서 미생물을 이용한 연구 및 적용 사례가 증가하고 있다5,6,7). 그 예로, 상당한 독성을 가진 부유선별 시약을 대체하고자 소수성 미생물을 이용한 바이오플로테이션(Bio-flotation) 연구가 있으며, 금속 제련 시 발생하는 유해가스 절감과 저품위 광석이나 광미에서 경제적인 금속 회수를 위한 생물학적 침출법(Bioleaching)관련 연구가 있다8,9,10,11,12).
일반 금속광에 함유된 다양한 금속은 중금속으로 분류되는 경우가 많기 때문에 자원처리과정 시 주변 환경에 노출될 경우를 고려해야한다. 특히 황화광에 함유된 대표적인 중금속으로는 비소, 연․아연, 철, 카드뮴, 수은, 동 등이 있으며, 해당 중금속의 독성 및 위험성관련 연구는 상당히 이루어져 있어 노출된 금속이 주변 환경과 사람에게 축적되어 생태계 교란 및 신체에 장애를 일으키는 것으로 알려져 있다13,14,15,16). 사람에게 약하게는 현기증․식욕부진․구토․근육통 등을 유발하기도 하며, 심할 경우 심혈관계 질환이나 암을 발생시켜 생명과 직결되어 사망에 이르게 한다. 따라서 국내 금․은․동 광산이나 연․아연 광산 등을 운영 시에 주변 환경에 비소나 납, 아연, 철과 같은 중금속이 노출될 가능성을 인지하고 광산개발과 광산 적재에 주의해야 할 필요가 있다.
일반적으로 중금속을 함유한 큰 벌크상태의 광석(바위)은 주변 환경이나 인체에 미칠 위해성이 낮으나 광산 개발 혹은 광석 적재 중 발생하는 미세입자나 분진의 경우 비산 등을 통해 주변 환경으로 노출이 가능하여 위해성이 높아진다. 하지만 비교적 위해성이 낮은 벌크상태의 광석일지라도 자연 상태의 광산에는 현장의 극한 상황에 적응하고 생존하는 토착 미생물이 존재하고 있어, 미생물에 의한 광석 내 중금속 용출 가능성을 무시할 수 없다. 일례로 토착 미생물 중 하나인 호산성 미생물에 의한 황화광의 산화와 산성광산폐수 생성으로 인한 환경문제 발생에 관련된 수많은 연구가 존재하며, 극한의 산성조건에서 생존하는 호산성 미생물의 특성상 산성비 등의 환경 영향을 받아 현장의 광석으로부터 금속 용출을 용이하게 하여 중금속이 주변 환경에 노출될 수 있다17,18,19,20,21,22,23,24). 따라서 본 연구에서는 금속 광산에 적재된 자연 상태인 광석에서의 중금속 용출 거동을 예측하고자, 금속 광산의 대표적인 토착 미생물로 알려진 호산성 미생물을 이용하여 국내 금속 광산의 원광으로부터 비소와 기타 중금속의 용출 거동을 알아보고자 하였다.
2. 시료 및 실험 방법
2.1. 시료
본 연구에서는 미생물에 의한 중금속 용출 실험을 위해 국내 광산에서 채취한 고농도 비소 함유 시료를 사용하였다. 원석의 상태로 확보한 시료는 조 크러셔와 로드밀을 통해 325 mesh 이하(d90=42 µm)로 분쇄하였다. 분쇄된 시료는 산화를 억제하기위해 -4 °C 냉장고에 보관하여 동일한 상태를 유지하고자 하였다.
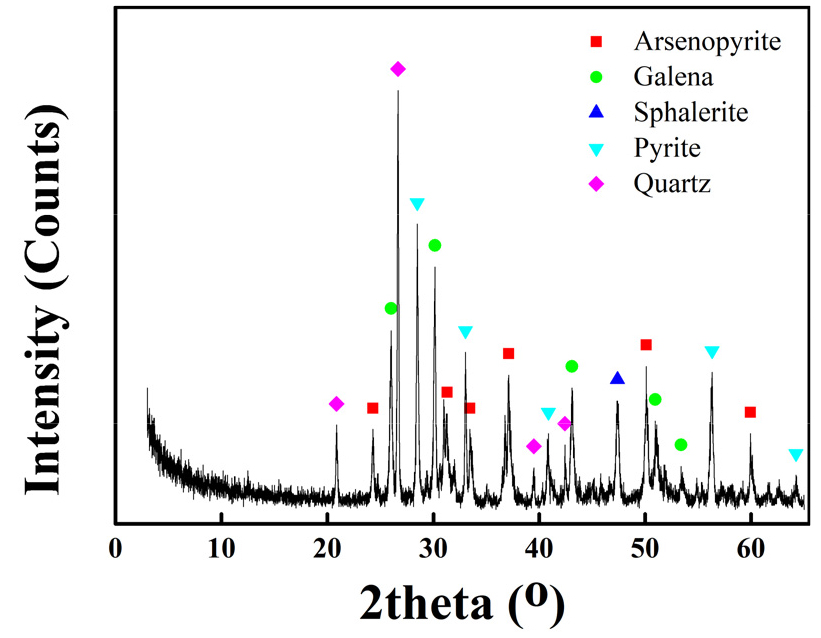
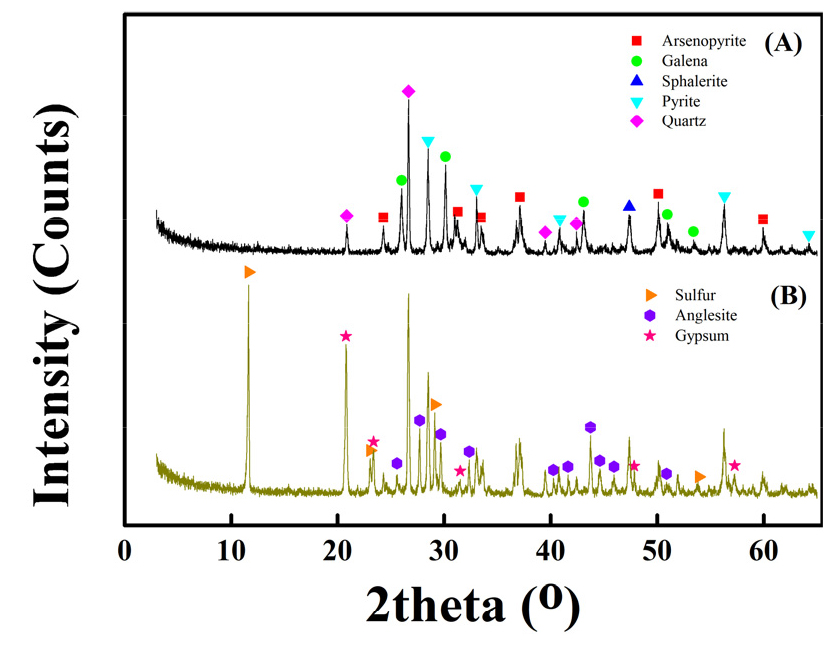
중금속 용출실험에 앞서 시료의 광물학적 특성 분석을 실시하였다. 분쇄된 시료의 XRD 결과는 Fig. 1과 같으며, 시료의 주요 광물로는 황비철석(arsenopyrite, FeAsS), 방연석(galena, PbS), 섬아연석(sphalerite, ZnS), 황철석(pyrite, FeS2) 및 석영(quartz, SiO2)등이 함유되어 있음을 확인하였다. 또한, 해당 시료의 주요 중금속인 Pb, Zn As, Fe의 농도를 ICP 분석을 통해 측정하였으며, 그 결과는 Table 1에 나타내었다.
Fig. 1과 Table 1을 통해 본 연구에 사용된 시료는 비소와 철의 함량이 매우 높은 연․아연 광석임을 확인하였다. 추가적으로 시료의 광물학적 조성을 XRD 정량 분석을 통해 알아보았고, 그 결과 Fig. 1에서 확인한 주요 광물 5가지 외에도 기타 광물로 백운석(dolomite, CaMg(CO3)2), 방해석(calcite, CaCO3), 녹니석(chlorite, Mg2Al3(Si3Al) O10(O)8), 백연석(cerussite, PbCO3), 조장석(albite, (Na,Ca) (Si,Al)4O8) 등이 다수 포함되어 Table 2와 같은 함량을 나타내었다.
Table 2.
Mineralogical composition of ore
2.2. 미생물 배양
본 실험에 사용된 대표적인 호산성 미생물인 Acidithiobacillus ferrooxidans (A. ferrooxidans) 와 Acidithiobacillus thiooxidans (A. thiooxidans)는 Korea Collection for Type Cultures (KCTC)에서 분양 받았고, 분양 받은 두 종류의 미생물은 삼각 플라스크 및 배양 튜브를 이용하여 4일 동안 30 °C, 200 RPM의 진탕 배양기에서 배양하였다. 미생물의 성장 활성도(activity)를 높이기 위해 수 차례 계대배양이 진행되었고, 미생물의 성장 상태는 counting chamber (Bruker-Turk, MARIENDFELD, Germany)를 이용하여 위상차 현미경으로 관찰하였다.
A. ferrooxidans의 배양 배지로는 DSMZ882를 사용하였으며, 해당 배지는 solution A, solution B와 trace element solution으로 구성된다. Solution A는 950 mL 증류수에 (NH4)2SO4 132 mg, MgCl2․6H2O 53 mg, KH2PO4 27 mg, CaCl2․2H2O 147 mg을 투입한 후 pH를 1.8로 조절하여 준비하였으며, solution B는 0.25 N 황산 50 mL에 FeSO4․7H2O 20 g을 용해시켜 준비하였다. Trace element solution은 1 L 증류수에 MnCl2․2H2O 62 mg, ZnCl2 68 mg, CoCl2․6H2O 64 mg, H3BO3 31 mg, Na2MoO4 10 mg, CuCl2․2H2O 67 mg를 투입하여 pH를 1.8로 조절하였다. 준비된 solution A, B와 trace element solution을 112 °C에서 30분간 각각 따로 멸균하여 충분히 식힌 후, 1 mL의 trace element solution과 solution A, B를 혼합하였고, 혼합된 배지의 최종 pH는 1.8이 되도록 하였다. DSM71은 A. thiooxidans의 배양 배지로 KH2PO4 3.0 g, (NH4)2SO4 0.2 g, MgSO4․7H2O 0.5 g, FeSO4․7H2O 10 mg 및 CaCl2․2H2O 250 mg으로 이루어져있다. 또한 A. thiooxidans의 성장 에너지원으로는 황(Sulfur powder)이 사용되었다. 배양 배지 및 황은 서로 다른 조건에서 각각 따로 멸균을 진행하였다. 배양 배지는 1 L 증류수에 최종 pH가 3이 되도록 조절하여 121 °C에서 15분간 멸균하였고, 황은 105 °C에서 20 분간 두 차례 멸균하여 사용하였다.
2.3. 금속 용출실험 및 분석방법
미생물에 의한 금속 용출 실험은 2 L 교반 탱크 반응기에서 광액농도 10 % (w/v)로 광석 시료 100 g을 투입하고, 충분히 성장된 A. ferrooxidans 또는 A. thiooxidans를 100 mL 주입하여 35 °C 항온 수조에서 315 RPM으로 교반하여 실험을 수행하였다. 해당 반응기의 초기 pH는 1.5로 조절되었으며 공기는 100 mL/min으로 주입되었다. 또한 실험 중인 광액의 pH, ORP를 측정하고 용출된 금속 농도를 모니터링하기 위해 중간 용액을 주기적으로 수집하였다. 용액의 pH 및 ORP는 pH-ORP 미터(ORION VERSA STAR, Thermo Scientific)를 사용하여 측정하였고, 용출된 금속 농도는 유도 결합 플라즈마 분광기(ICP-OES, OPTIMA8000, PerkinElmer)로 분석하였다. 또한 최종 잔사는 멤브레인 필터(0.45 μm, ADVANTEC)로 여과 후, 산화를 예방하기 위하여 질소 오븐에서 24 시간 건조하여 XRD분석을 수행하였다.
3. 실험 결과 및 토론
3.1. 생물학적 용출의 이론적 배경
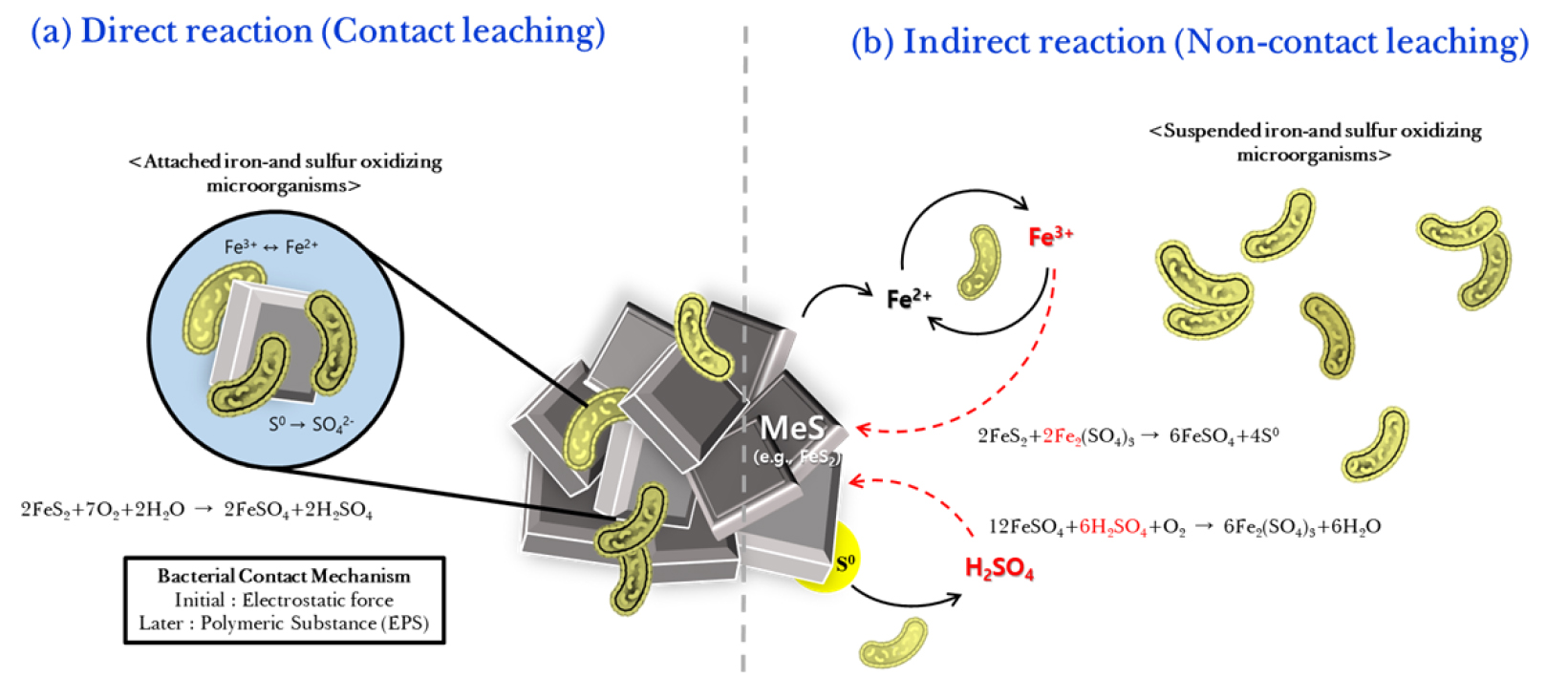
미생물을 이용한 금속 용출이란, 일명 “생물학적 침출” 혹은 “바이오 리칭(bioleaching)”이라 일컫는데, 이는 미생물에 의해 금속 광석이 산화되는 과정에서 광석 내 금속 이온이 용출되는 것을 말한다. 생물학적 침출에 일반적으로 이용되는 미생물로는 A. ferrooxidans와 A. thiooxidans 등이 존재하며, A. ferrooxidans는 Fe2+를 Fe3+로 산화시킴으로써 결과적으로 광석의 표면을 산화시켜 금속을 용출시키는 미생물이다. 또한, A. thiooxidans의 경우, 초기 영양분으로 주입해주는 sulfur powder 혹은 미생물에 의한 산화 과정 중 광석 표면에 생성된 sulfur를 미생물이 산화시킴으로서 금속 황화광을 황산염으로 산화시키게 된다. 생물학적 침출법의 기작은 크게 미생물에 의한 직접/간접 반응 기작으로 나눌 수 있으며, Fig. 2의 모식도와 같이 나타낼 수 있다.
미생물의 직접 반응 기작은 미생물이 광석 표면에 물리적으로 흡착하여 광석 표면을 산화시키는 반응으로, 크게 금속 황화광의 철 함유 여부에 따라 반응식이 달라진다. 철을 함유하지 않은 황화광 즉, 동람(covellite, CuS), 휘동석(chalcocite, Cu2S), 섬아연석(sphalerite, ZnS), 방연석(galena, PbS), 휘수연석(molybdenite, MoS2) 등은 금속 황화물(MeS, Me: metal ion)을 직접적으로 금속 황산염(MeSO4)으로 산화시킨다25,26). 철을 함유한 대표적인 금속 황화광, 황철석(pyrite, FeS2)과 황비철석(arsenopyrite, FeAsS)의 경우는 다음과 같이 반응하여 산화되는 것으로 알려져 있다27).
<미생물의 직접 반응>
황철석의 경우 식 (1)과 같으며
간접 반응 기작이란, 산성 조건에서 미생물을 이용한 산화과정 중 생성되는 Fe3+ 이온(ferric ion)과 황산(H+)에 의해서 화학적으로 금속 황화광이 산화되는 것을 의미한다. 해당 반응은 아래와 같이 설명할 수 있다25,28).
<미생물의 간접 반응>
3가 철에 의한 산화 반응은 식 (5), (6)과 같다.
황산에 의한 침출 반응은 식 (7)과 같다.
3.2. 금속 용출실험
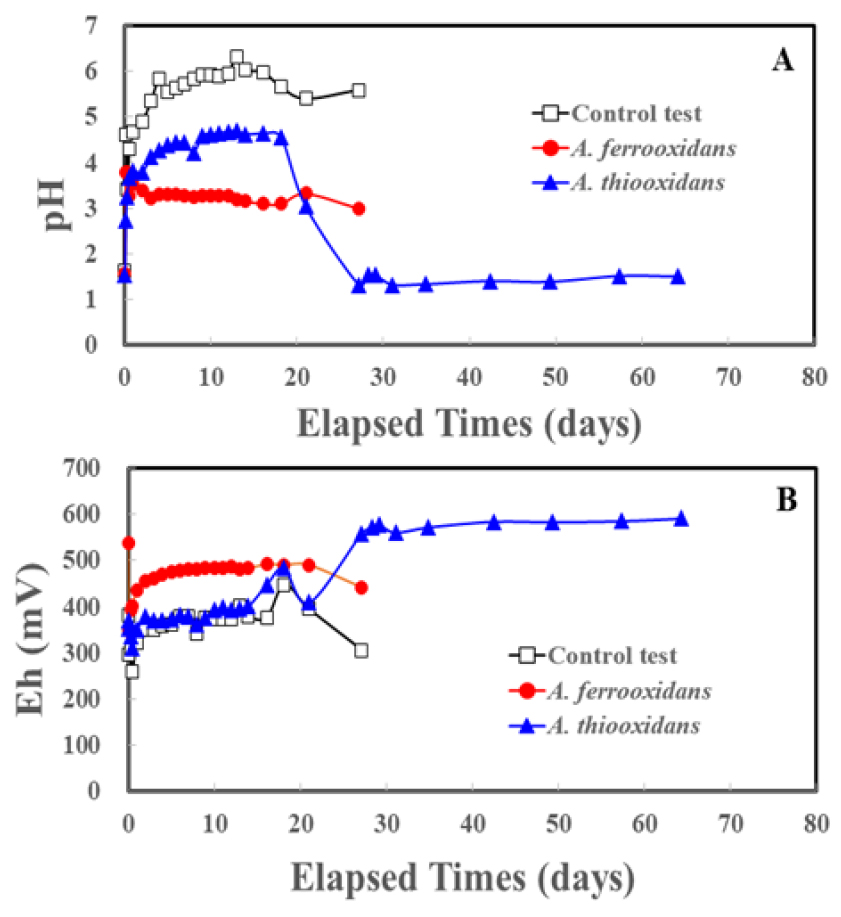
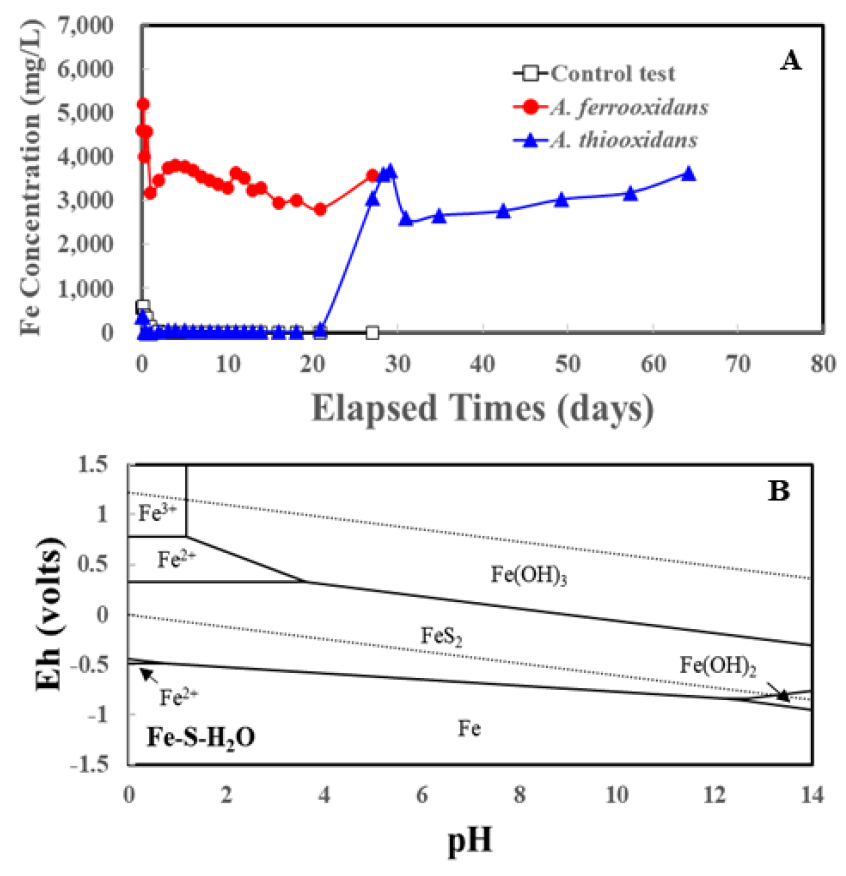
본 연구에서는 위에서 언급한 미생물의 반응 기작으로 인한 금속 광산 현장에 적재된 광석으로부터 비소 및 기타 중금속의 용출 가능성을 알아보기 위하여 반응기의 초기 pH를 1.5로 고정하여 금속 광산의 대표적인 토착 미생물인 호산성 미생물을 이용한 금속 용출 실험을 진행하였고, 이와 동시에 미생물을 주입하지 않은 대조실험(control test)을 진행하였다. Fig. 3(A)와 (B)는 각각 실험 시간에 따른 pH와 ORP 변화를 나타낸다. 모든 반응기에서 pH가 급격히 상승하는 것을 확인할 수 있는데, 이는 초기 pH를 1.5로 조절하기 위해 주입한 황산을 소모하며 광석이 산화하는 과정 중에 발생한 결과로 볼 수 있다.
A. ferrooxidans를 이용한 용출 반응의 경우, 초기에 pH가 급격히 4까지 상승하였고, 이 후 pH의 큰 변화 없이 pH 3정도로 유지가 되는 것을 확인 할 수 있었다. 이 때 ORP 또한 초기 약간의 변화 이후, 큰 변화 없이 약 450 mV로 유지되는 것으로 나타났다. 반면 A. thiooxidans를 이용한 용출 반응에서는 초기에 pH가 4까지 급격히 상승 후 20일까지 점진적으로 상승하는 경향을 보인 후, 20일이 지난 시점부터 pH가 1.3까지 급격히 감소하는 것으로 나타났다. 해당 반응의 ORP 또한 같은 시기 급격히 상승하여 약 600 mV에 도달하였다. 위의 결과를 통해 미생물에 의한 광석의 산화과정 중 생성되는 sulfur (식 (2), (5), (6) 참고)를 A. thiooxidans가 산화시키는 과정에서 ORP가 증가하고, 나아가 황산이 생성되어 pH가 급격히 감소하는 것으로 설명할 수 있다25). 이는 다음 식 (8)과 같이 나타낼 수 있으며, sulfur의 생성은 미생물에 의한 직/간접 반응을 통해 광석의 산화과정이 활발히 진행되고 있음을 뒷받침 할 수 있다.
미생물에 의한 용출의 대조 실험으로 미생물을 주입하지 않은 반응기의 결과는 초기 1.5로 조절된 pH가 급격히 상승하여 최대 6에 이르고, ORP는 350 mV로 큰 변화가 없이 유지가 되는 모습을 보였다. 따라서 Fig. 3의 pH (A)와 ORP (B) 결과를 종합적으로 고려하였을 때, 고농도 비소와 철을 함유한 본 광석 시스템에서 주로 A. thiooxidans에 의해 광석의 산화과정이 활발히 진행될 것으로 예상할 수 있다.
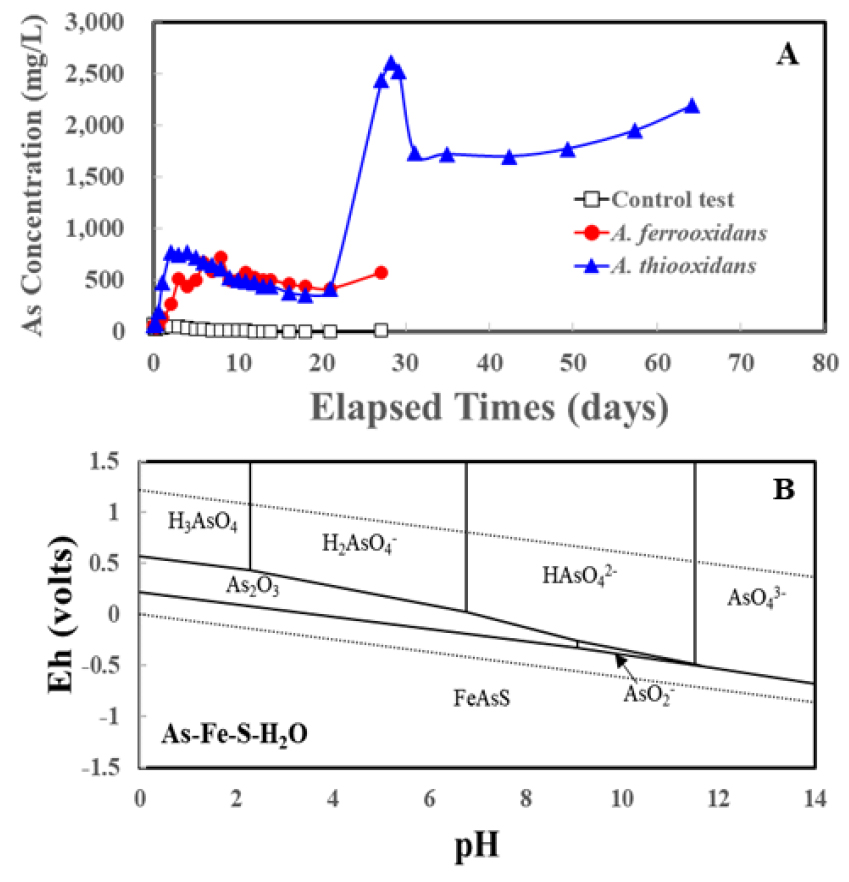
Fig. 4(A)와 5(B)는 미생물을 이용한 금속 용출 실험을 통해 침출된 비소 용출 농도와 비소의 Eh-pH diagram을 나타낸다. 전반적으로 비소의 용출 정도는 pH의 영향을 받는 것으로 나타났다. Fig. 4(A)의 A. ferrooxidans에 의한 비소의 용출 거동은 초기 pH 1.5로 조절하기 위해 주입된 황산에 의해 8일 동안 약간 용출되지만, 8일 이후로 pH와 ORP에 큰 변화가 발생하지 않았고 황산의 소모로 인해(pH 상승) 용출됐던 비소의 농도가 다시 감소하는 경향을 보인다. 이는 pH 3과 ORP 450 mV로 큰 변화 없이 유지되는 중에는 Fig. 4(B)의 비소 Eh-pH diagram으로부터 As2O3와 H2AsO4- 종의 경계를 이동함으로 인해 비소 농도가 다소 감소하는 경향이 나타나는 것으로 설명할 수 있다.
A. thiooxidans에 의한 용출 반응에서 또한 초기에 주입된 황산에 의해 비소가 약간 용출되는 양상을 나타내었고, 이후로 pH 4-4.5, ORP 350 mV로 유지될 때에는 (~20일) pH 상승의 영향으로 용출된 비소 농도가 다소 감소하였다. 이때의 비소 종 변화를 Fig. 4(B)에서 확인해보면, As2O3와 H2AsO4-의 경계에 존재하여 비소 농도가 감소하는 것으로 설명할 수 있다. A. thiooxidans에 의한 반응에서는 20일 이후 pH가 급격히 감소하고 ORP 또한 570 mV로 증가하는 큰 변화를 보이며, 이로 인해 비소가 폭발적으로 용출되어 28일 경 비소 농도가 ~2600 mg/L에 도달하였다. Fig. 4(B)를 통해 해당 용액 조건에서 비소가 H3AsO4(aq) 형태로 존재하여 비소 농도가 상승하는 것으로 설명할 수 있다.
미생물을 주입하지 않은 대조실험의 경우, pH와 ORP에 유의미한 변화가 없음을 앞서 확인하였다. 대조 실험에서는 초기에 pH가 6까지 급격히 증가함으로 인해 황산에 의한 초기 비소의 용출도 전혀 발생하지 않는 것으로 확인하였다.
Fig. 5(A)와 5(B)는 미생물에 의한 철의 용출 농도와 철의 Eh-pH diagram을 나타낸다. 비소의 용출 결과와 마찬가지로 철의 용출 거동 또한 pH에 크게 영향을 받는 것을 확인할 수 있다. A. ferrooxidans를 이용한 반응의 철 용출 농도는 Fig. 3(A), (B)에서 확인할 수 있듯, pH와 ORP의 변화가 거의 없어 A. ferrooxidans의 배지(DSMZ882)에 에너지원으로 첨가되는 철 농도(~4000 mg/L) 이외의 용출 경향은 전혀 보이지 않았다(Fig. 5(A)). pH와 ORP가 안정화된 시점에서는(pH 3, ORP 450 mV) 철이 Fig. 5(B) Eh-pH diagram에서 Fe2+/Fe(OH)3 경계에 존재하는 조건으로, 철의 침전이 발생할 수 있는 조건이기 때문에 철의 용출 농도가 상승하지 않은 것으로 분석된다. 다만, 초기에 일시적으로 ~5000 mg/L에 도달하는 철 용출 농도는 pH 1.5로 조절을 위해 주입된 황산의 영향으로 황철석 일부가 용출된 것으로 확인된다.
A. thiooxidans 반응에서도 초기 황산에 의해(pH 1.5) 일부 황철석이 용출되어 철의 농도가 ~500 mg/L까지 상승하는 것으로 확인되었다. 그러나 초기에 용출된 철은 pH 상승으로 인해(~ pH 4) 다시 침전되어 그 농도가 감소하는 것으로 나타났다(Fig. 5(A)). 이후 pH가 급격히 변화하는 20일경 철의 용출 농도는 약 4000 mg/L까지 증가하는 것으로 측정되었으며, 이 때 용액 조건에서(pH 1.3, ORP 600 mV) 철은 Fe2+로 존재함을 Eh-pH diagram으로부터 파악할 수 있다(Fig. 5(B)).
미생물을 주입하지 않은 대조 실험은 pH와 ORP의 변화가 없고, 철이 전혀 용출되지 않는 것으로 분석되었다(Fig. 5(A)). 이는 Fig. 5(B)로부터 해당 용액 조건(pH 6, 350 mV)에서는 철이 황철석으로 안정적으로 존재하기 때문인 것으로 파악된다.
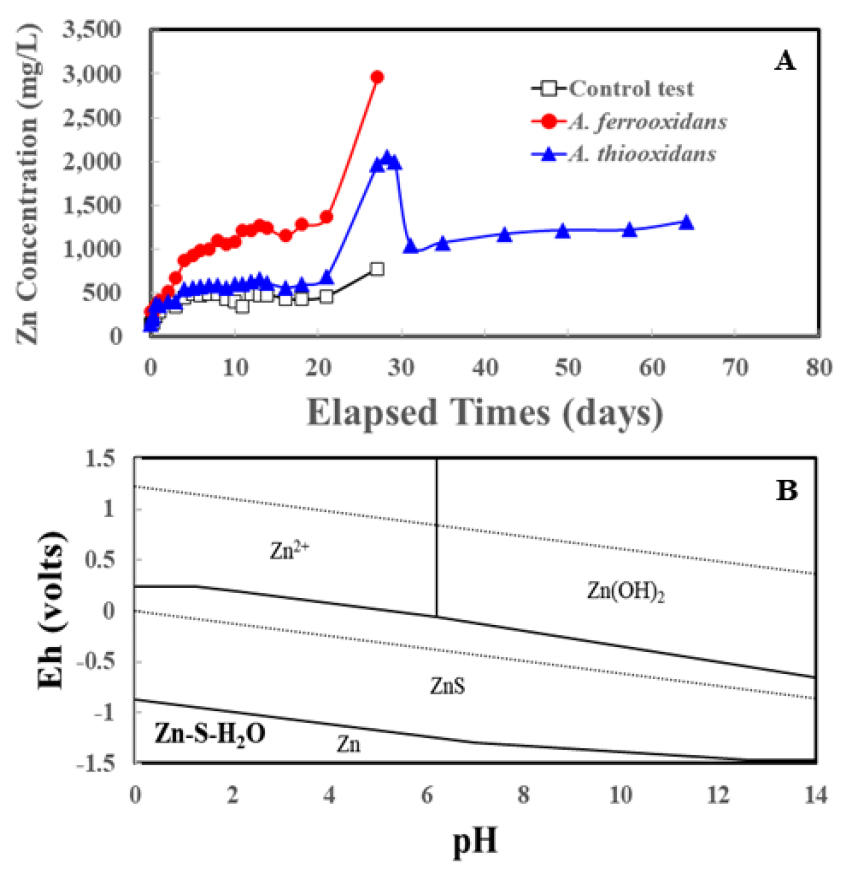
Fig. 6(A)와 6(B)는 각각 용출된 아연 농도와 아연의 Eh-pH diagram을 나타낸다. Fig. 6(A)의 아연 용출 결과를 통해 A. thiooxidans에 의한 용출 반응에서는 비소와 철의 용출 거동과 동일하게 pH가 급격히 감소하는 지점부터 아연이 폭발적으로 용출되기 시작함을 알 수 있다. 그러나 앞선 비소와 철의 용출 거동에서는 큰 변화가 없었던 A. ferrooxidans 용출 반응과 미생물을 주입하지 않은 대조실험에서 모두 pH와 ORP가 크게 변하지 않음에도 아연이 쉽게 용출되는 것을 확인하였다. 이는 Fig. 6(B) Eh-pH diagram에서 확인할 수 있듯이, 섬아연석(ZnS)은 pH 6이하, 그리고 비교적 낮은 ORP 조건에서도 아연이 이온 상태로 존재하기가 매우 용이하여 각 조건에서 모두 높은 용출량을 보이고 있는 것으로 파악된다.
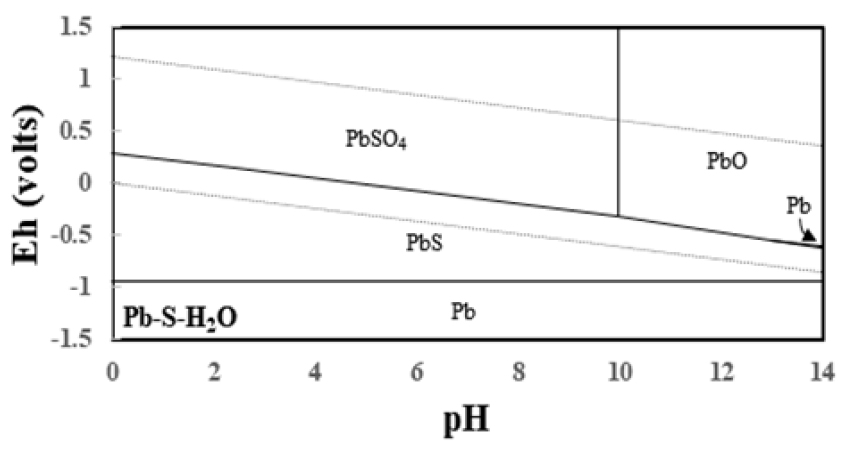
납의 용출 결과는 두 종류의 미생물을 주입한 실험과 대조 실험에서 모두 납 이온이 검출되지 않았다. 실제 Fig. 7의 방연석(PbS)의 Eh-pH diagram을 확인해 보면, 미생물에 의한 용출실험과 대조실험의 용액 조건하에서 모두 고체 상태인 PbSO4가 우세하게 존재하는 구간임을 확인할 수 있다. 이는 방연석 표면에 산화되어 침출된 Pb2+이온과 산화과정 중 발생하는 황산염 이온(SO42-)이 결합하여 불용성 산화물이 생성되었기 때문이라고 판단하였고, 실제 광석 표면에 Pb-SO4의 결정성 물질이 생성됐는지 알아보기 위하여 XRD 분석을 진행하였다(Fig. 8(A)와 8(B)). 그 결과 Fig. 8(B)에 나타낸 바와 같이 약 70일에 걸친 미생물 용출 실험 후의 잔사에서 앙글레사이트(anglesite, PbSO4)가 생성되었음을 확인하였다. 또한, 대체로 황화 광물로 이루어진 실험 전 원광의 광물 구성과 달리(Fig. 8(A)), 최종 잔사에서는 황(sulfur, S), 석고(gypsum, CaSO4․2H2O) 등이 발견되었는데, 이는 산화반응 과정 중 생성되는 대표적인 산물로써 미생물에 의한 산화 반응을 통해 황화광이 산화되었음을 나타낸다.
4. 결 론
금속 광산에 존재하는 대표적인 호산성 미생물로 A. ferrooxidans와 A. thiooxidans를 이용하여 실제 광산 현장에서 야기될 수 있는 중금속 용출 거동을 예측하고자 본 연구를 수행하였으며, 그 결과는 다음과 같다.
1. A. thiooxidans를 이용한 금속 용출실험에서 광액의 pH가 1.3으로 급격히 감소하는 현상이 나타나는데, A. thiooxidans를 통한 pH의 감소는 광석 표면에 생성된 sulfur를 A. thiooxidans가 산화시킴으로써 생성되는 황산에 의해 발생한다. 이러한 미생물에 의한 pH 감소는 금속 용출에 큰 영향을 끼치는 것으로 알려져 있고, 본 연구에서는 A. thiooxidans에 의한 비소, 철 및 아연의 용출 농도가 각각 최대 ~2600, ~3700, ~2050 mg/L에 도달하는 것으로 확인되었다.
2. A. ferrooxidans를 이용한 금속 용출실험과 미생물을 주입하지 않은 대조실험의 경우, pH와 ORP의 뚜렷한 변화가 없었으며, 아연을 제외한 금속 이온의 용출이 눈에 띄게 나타나지 않았다.
3. 즉, 비소와 철의 함량이 높은 금속 광산 내 광석 시스템의 경우, 자연 상태에 존재하는 토착 미생물에 의한 금속광의 산화가 진행될 가능성이 있으며 광석의 산화과정에 A. ferrooxidans 보다는 A. thiooxidans이 우세한 역할을 할 것으로 파악된다.