1. 서 론
2. 실험 방법
2.1. V2O5 분말 제조
2.2. 바나듐 전해액 제조
3. 결과 및 고찰
3.1. 상등액 및 여과액 분석
3.2. V2O5 순도 분석
3.3. AMV 및 V2O5 구조 분석
3.4. 바나듐 전해액 특성 분석
4. 결 론
1. 서 론
2050년 탄소중립을 달성하기 위해서는 청정에너지 중심의 에너지 시스템 혁신이 필요하다. 이를 위한 대용량∙장주기형 에너지 저장 시스템 개발이 핵심 연구 개발 분야로 주목 받고 있다1). 대용량 에너지 저장 장치는 신재생 에너지 및 심야 전력을 충전 과정을 거쳐 저장하고 필요시 전기에너지로 방전시키는 장치로서 그리드 시스템, UPS 및 거주/산업용으로 활용되고 있다. 에너지 변환 효율, 수명 및 설치 용이성을 고려할 때 이차전지가 대용량 에너지 저장 장치의 가장 적합한 기술로 여겨지고 있다2). 그런데 태양광 발전 전력을 저장하는 리튬이온배터리 ESS 시설에서 최근 화재가 빈발하고 있는 상황이므로 안전성이 우수한 대용량 에너지 저장장치 기술 개발이 필요하다.
바나듐 레독스 흐름 전지(Vanadium Redox Flow Battery, VRFB)는 현재까지 가장 상용화에 근접한 흐름 전지 기술이며 친환경적이고 고효율 에너지 저장 시스템이다3). 또한 충∙방전에 따른 우수한 응답 특성, 높은 에너지 효율 및 긴 수명과 같은 많은 장점으로 대규모 전기화학적 에너지 저장 시스템(Energy Storage System, ESS)으로 주목 받고 있다3,4). VRFB는 크게 스택과 전해액(vanadium electrolyte, VE), 그리고 전해액을 순환시키기 위한 펌프로 구성되는데 이중 전해액은 에너지 저장과 출력을 담당하는 활성 물질이다. 하지만 현재 VRFB 비용 $555/kWh은 리튬이온전지(Lithium Ion Battery, LIB, $271/kWh) 대비 두 배 이상이다5). VRFB 10 kW/120 kWh 시스템 기준으로 바나듐 및 전해액 제조 공정 비용이 40% 및 41%를 차지하며 에너지 용량이 커질수록 전체 VRFB 비용에서 전해액의 비중이 커진다6,7). 따라서 VRFB 시장 확대를 위해서는 경제적으로 고성능 바나듐 전해액을 확보하기 위한 전략이 우선적으로 필요하다.
대표적인 바나듐 전해액의 특성은 1.6 M V(3.5+)/4.2 M H2SO4으로 구성되며 순도는 99.98%이상으로 알려져 있다. 바나듐 전해액 제조 공정은 오산화바나듐(V2O5) 분말을 황산에 첨가한 후 화학적 환원제(oxalic acid)와 반응을 통하여 V(4+)의 용액을 제조한 후 대칭 전해 공정을 이용하거나 또는 V2O5 분말을 직접 비대칭 전해 공정을 통하여 V(3.5+)의 바나듐 전해액을 제조한다8). 바나듐 전해액에 포함된 불순물 이온은 VRFB의 전기화학적 성능에 큰 영향을 미치기 때문에 전해액 제조용으로 고순도(>99.8%) V2O5가 원료 물질로 보통 사용된다3). 하지만 현재 고순도 V2O5 제조 비용이 높아 VRFB 제조 단가가 높은 상황이다. 2019년 VRFB용 V2O5 국내 수요는 120톤으로 연평균 16.6% 증가하였으며 새로운 에너지 기술의 지속적인 발전으로 V2O5는 중요한 산업 원료가 되고 있다. 더욱이 바나듐레독스 흐름 전지 및 리튬 이온 전지 분야에서는 99.95% 이상의 고순도 V2O5가 요구되고 있다. 따라서 저비용 고효율 V2O5 고순도화 공정 개발은 새로운 에너지 기술 분야에서 시급한 당면 과제가 되고 있다9,10).
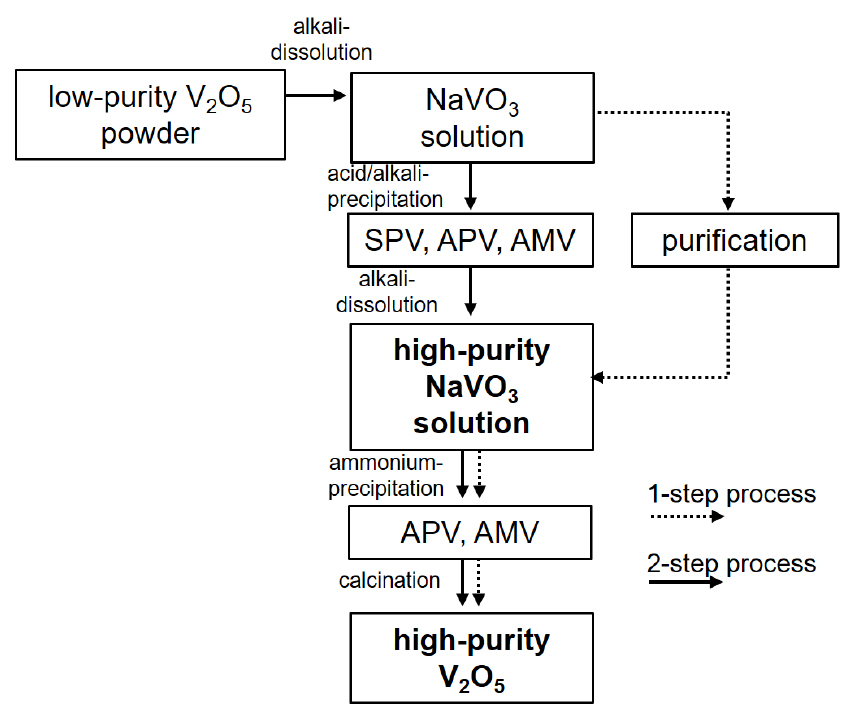
일반적으로 V2O5 고순도화 습식 공정(hydrometallurgical method)에서는 화학적 침전11,12), 이온 교환13,14), 용매추출15,16) 등이 이용되고 있다. 하지만 기존의 습식 공정으로는 최고 순도 99.5% V2O5 분말이 제조 가능하다. 순도 99.9% 이상의 V2O5 분말을 제조하기 위한 목적으로 150 °C이상에서 V2O5를 chlorination agent(AlCl3)와 반응하여 VOCl3 가스를 생성/응축하여 VOCl3 용액을 제조하는 염화 공정(chlorination process)이 개발되었다17,18). 지금까지 고순도 V2O5를 제조하기 위한 상업화된 공정으로는 화학적 침전 공정이 활용되고 있다. 구체적으로, Fig. 1에 나타낸바와 같이 바나듐 화학적 침전 방법으로 2회의 바나듐 화합물 침전 공정을 갖는 2-step 공정에서는 먼저 저순도 V2O5 분말을 알칼리 조건에서 용해하여 바나듐 용액(NaVO3 solution)을 제조한 후 산분위기에서 (NH4)2V12O31(ammonium polyvanadate, APV), Na2V12O31(sodium polyvanadate, SPV) 또는 알칼리 분위기에서 NH4VO3(ammonium metavanadate, AMV) 형태로 침전 분리한다. 이를 다시 알칼리 조건에서 용해하여 고순도의 NaVO3을 제조한 후 암모늄 공급원을 첨가하여 APV 또는 AMV 분말을 얻고 이를 소성하여 V2O5 분말을 제조한다19,20). 하지만 2-step 공정은 복잡하고 바나듐 손실이 크며 99.8% 이상의 고순도 V2O5 분말을 제조하는데 한계가 있다. 이를 개선한 새로운 1-step 공정에서는 저순도 NaVO3에 chemical impurity removal agent(CIRA)를 첨가하여 선택적으로 불순물을 침전 분리한 다음에 APV 또는 AMV 형태로 침전 회수하게 되는데, 이 경우에는 CIRA 성분이 2차적으로 유입되어 순도 상승 효과가 미흡하였다21). 아직 효과적인 고순도화 1-step 공정은 개발되지 못한 상황이다.
고순도 바나듐 화합물을 제조하는 방법은 저순도 바나듐 용액내의 바나듐을 선택적으로 회수하는 공정과 이와 반대로 불순물을 분리 정제하는 공정으로 분류될 수 있다. 저순도 바나듐 용액으로부터 바나듐을 선택적으로 회수하기 위해서는 불순물 대비 바나듐에 대한 선택성이 높아야한다. 바나듐의 선택성을 간접적으로 올리는 방법으로 불순물 금속 이온을 킬레이트제(chelating agent, CA)와 결합하여 수용액 내에서 안정한 복합체를 형성하는 방식이 효과적인 것으로 알려져 있다. 예들 들면, 고순도 TiO2 분말 제조 공정에서 Ti을 함유한 ilmenite 침출 용액 등에 EDTA(ethylenediammine tetra-acetate)를 첨가하여 가수분해 공정 동안 불순물 Fe3+ 이온이 EDTA와 킬레이트를 형성하여 Fe(OH)3 생성 반응이 억제되어 순도 99.9% TiO2 분말이 제조되었다22,23). 또한 V(IV) 용액내에 존재하는 Fe3+ 이온은 용매추출 공정으로 분리가 어려운데 D2EHPA를 이용한 용매추출 공정에 EDTA를 도입하여 효과적으로 Fe3+를 분리(이온 분리 계수 = 729)하여 고순도 VOSO4 용액이 제조되었다24). 본 연구에서는 각각 99.7%와 98.3%의 순도를 갖는 V2O5 분말의 고순도화 공정에서 킬레이트제로 EDTA 적용성 여부를 고찰하였으며 제조된 고순도 V2O5 분말을 바나듐 전해액 제조 신공정에 적용하여 바나듐 전해액을 제조하였다. 더불어 V2O5 분말 및 바나듐 전해액 특성 평가를 통하여 추가적인 불순물 제거 필요성과 바나듐 전해액 제조 공정 개선점에 대하여 고찰하였다.
2. 실험 방법
2.1. V2O5 분말 제조
본 연구에서 고순도 V2O5 분말을 제조하기 위해 Fig. 2와 같이 순도 99.69%(V2O5-ES, CHANGSHA EASCHEM Co.) 및 98.25%(V2O5-F, flake)를 갖는 저순도 V2O5 분말을 활용하였다. 저순도 바나듐 용액을 제조하기 위해 1.5 M NaOH 용액 0.8L에 V2O5 분말을 각각 73.6 g(V2O5-ES), 74.24 g(V2O5-F)을 첨가한 후 24시간 이상 동안 교반하고 여과하여 1 M 바나듐 농도를 갖는 바나듐 용액을 제조하였다. 저순도 바나듐 용액 0.1 L에 황산암모늄((NH4)2SO4)을 NH4/V = 2.0 조건으로 상온에서 첨가하고 24시간 동안 교반한 후 침전물을 여과 분리 및 수세척(0.65 L)한 후 60 °C에서 건조하여 NH4VO3(AMV) 분말을 제조하였다. 이후 550 °C에서 3시간 동안 열처리하여 V2O5 분말(V2O5-ES-blank, V2O5-F-blank)을 제조하였다. CA를 활용한 고순도 V2O5 분말 제조는 저순도 바나듐 용액에 황산암모늄 첨가 이전에 EDTA(C10H16N2O8), EDTA-2Na(C10H14N2O8Na2)를 첨가하여 진행하였다. 불순물 Fe 함량을 고려하여 V2O5-ES 분말로부터 제조된 바나듐 용액에 EDTA-2Na 0.1 g (V2O5-ES-EDTA-2Na), EDTA 0.08 g(V2O5-ES-EDTA) 및 V2O5-F 분말로부터 제조된 바나듐 용액에 EDTA-2Na 0.7 g(V2O5-F-EDTA-2Na)을 첨가하였다. AMV 침전 반응 이후 상등액(supernatant) 및 여과액(filtrate)내의 V, Fe, Si, Na, K 농도 분석을 ICP-OES(Optima-5300DV, Perkin Elmer)를 이용하여 진행하였다. 상등액 및 여과액의 성분 분석을 통한 침전률은 다음 식 (1), (2)를 이용하여 계산되었다. AMV 및 V2O5 분말 구조 분석은 XRD 분석을 통해 수행하였고 ICP-OES 분석을 통해 V2O5 분말내 불순물 함량을 조사하였으며 순도는 식 (3)을 이용하여 계산하였다.
2.2. 바나듐 전해액 제조
본 연구에서 1.5M V/3M H2SO4/V(III)/V(IV) = 1.0의 특성을 갖는 바나듐 전해액(VE-F-EDTA-2Na)을 제조하기 위해 새롭게 개발된 V2O5-Electrolytic Dissolution 신공정을 활용하였다25). 4.5 M H2SO4 용액 50 mL에 V2O5-F-EDTA-2Na 분말을 분산시키고 이를 carbon felt 전극 및 Nafion 117 멤브레인으로 구성된 VRFB 단위전지(전극 크기 5 x 5 cm2)의 음극(cathode)에 연동펌프(peristaltic pump)를 이용하여 주입하고 양극(anode)에는 H2O2/H2SO4 용액을 주입하였다. 바나듐 전기 분해 공정은 1.5V에서 84 min 동안 진행하였으며 상용 바나듐 전해액(VE-C, 1.6 M V3.5+/4.2 M H2SO4)을 활용한 reference cell을 이용하여 전압 변화를 모니터링하였다. 전기분해 셀의 전류 측정은 Biologic potentiostat VMP3B-20 & SP-150(EC-Lab software)를 이용하였고 reference cell의 전압 측정은 Metrohm Autolab potentiostat PGSTAT302N(Nova 1.10 software)를 이용하였다. 바나듐 산화수(vanadium oxidation number, VON)를 분석하기 위해 UV-VIS spectroscopy(UV-1800, Shimatu) 측정을 300 ~ 1100 nm(scan range), 150 nm/min(scan rate) 조건에서 수행하였다. 바나듐 전해액의 바나듐 농도 및 순도 분석은 ICP-OES 분석을 통하여 진행하였으며 순도는 식 (4)를 이용하여 계산되었다.
3. 결과 및 고찰
3.1. 상등액 및 여과액 분석
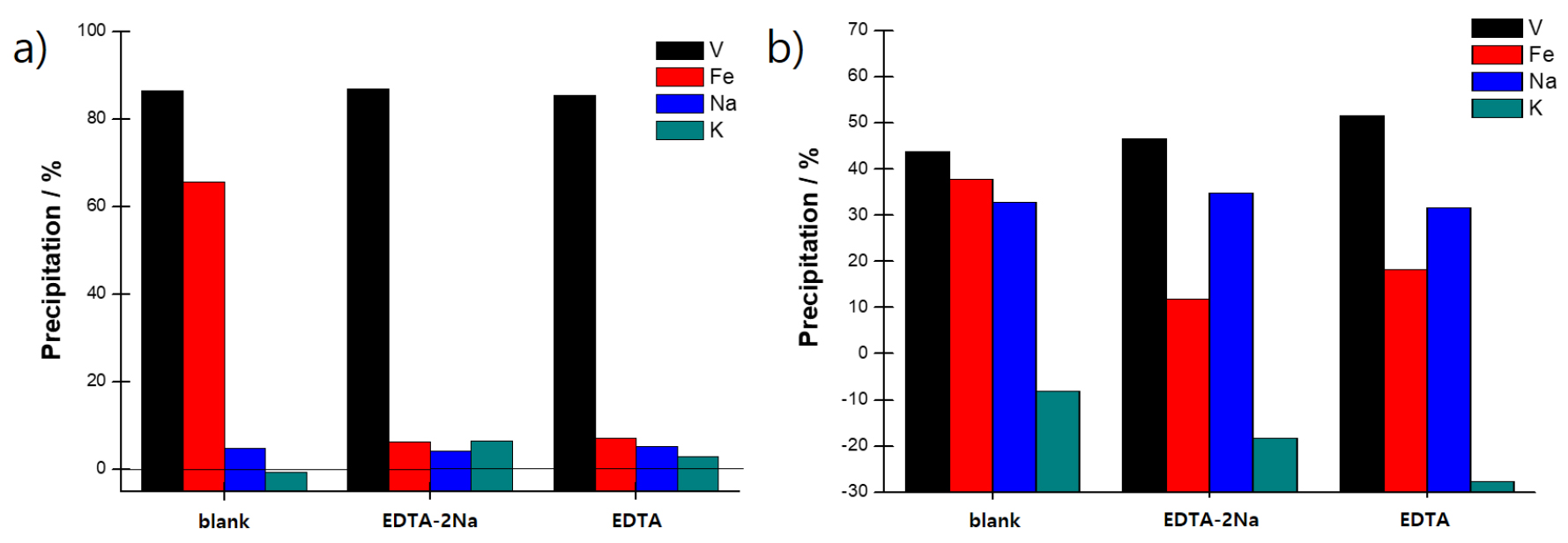
Fig. 2는 저순도 V2O5 분말(V2O5-ES, V2O5-F), 알칼리 침출액, NH4VO3 분말 및 최종 고순도 V2O5 분말 사진을 보여준다. 알칼리 침출 공정에서 불용성 잔류물은 여과 공정을 통하여 분리되었다. V2O5-ES 분말로부터 제조된 알칼리 침출액내의 V, Fe, Si, Na, K 농도 분석을 진행하였으며 결과를 Table 1에 나타내었다. 알칼리 침출액내 V 및 Fe의 농도는 각각 46,285.89 및 14.22 mg/L로 바나듐 침출율은 90.9%이었으며 V2O5-ES 분말내 Fe3O4 함유량 358.57 mg/kg을 이용하여 계산된 Fe 침출율은 59.5%로 계산되었다26). V2O5-ES 분말내 SiO2 함유량은 435.73 mg/kg으로 분석되었는데 알칼리 침출액내에 Si는 존재하지 않았다. 이러한 결과는 저순도 V2O5 분말내에 SiO2 형태로 함유된 Si 성분은 알칼리 침출 및 여과 공정을 통해서 불용성 잔류물에 포함되어 제어가 가능함을 의미한다. AMV 침전 회수 공정에서 상등액과 여과액의 조성 및 침전률을 Table 1 및 Fig. 3에 나타내었다. 상등액 분석 결과 blank 공정에서는 AMV 회수 공정에서 초기 바나듐 농도 46,285.89 mg/L에서 AMV 침전 공정 이후 6,211.63 mg/L로 감소하여 바나듐은 86.6% 회수되었다. 불순물 Fe은 65.6%가 침전되었고 Na 및 K은 각각 4.8%, -0.6% 공침된 것으로 확인되었다. AMV 침전 공정에서 Fe의 침전율은 높게 나타나며 바나듐 침전에 대한 Na 및 K은 영향을 크게 미치지 않는 것으로 분석된다. AMV 침전 공정을 통한 바나듐 회수율에 대한 영향은 용액의 pH, 첨가되는 NH4 공급원의 양 및 온도 조건에 영향을 받는다27,28). 수용액의 pH 및 온도가 증가할수록 암모늄 이온의 분해속도가 증가하기 때문이다. 암모늄 공급원 첨가량이 증가할수록 AMV 용해도가 감소하여 침전률이 증가하는 반면 반응 온도가 증가할수록 AMV 용해도 증가로 인하여 침전률은 감소한다. 또한, 여과액 분석 결과 blank 공정에서는 바나듐은 43.7% 회수되었으며 불순물 철(Fe)은 37.8%가 침전되었고 나트륨(Na) 및 칼륨(K)은 각 32.9%, -8.1% 침전된 것으로 확인되었다. 상등액 분석 결과와 비교할 경우 여과액 분석에서 바나듐 및 철의 침전률 감소는 여과 공정에서 AMV 입자의 용해에 의한 것으로 분석된다. 또한 알칼리 분위기에서 철의 공침은 철 이온이 AMV에 흡착에 의해서 발생하며 여과과정에서 바나듐과 함께 용해되는 것으로 판단된다. 따라서 바나듐 손실을 최소화하기 위해서는 여과공정에서 AMV 용해도가 낮은 여과액(NH4+ solution) 활용이 필요하다26). 흥미로운 사실은 여과액 분석 결과 Na 침전률이 크게 증가하는데 이는 여과 공정에서 Na이 AMV에 잔류하기 때문으로 분석된다. 따라서 AMV 분말내 Na 함유량을 감소시키기 위해서는 추가적인 최적화 연구가 필요하다.
Table 1.
The concentration of components in V solution, supernatant, filtrate and precipitation rates
AMV 침전 회수 공정에서 상등액 분석 결과 EDTA-2Na를 첨가한 경우 V 침전률이 86.9%를 나타내었고 Fe의 침전률은 6.4%를 나타내었다. 그리고, EDTA를 첨가한 경우에는 V 침전률 85.4%를 나타내었고 Fe의 침전율은 4.1%를 나타내었다. 상등액 분석 결과 CA 종류와 무관하게 EDTA-2Na 및 EDTA를 첨가한 경우 blank 샘플과 유사한 V 침전률을 나타내었지만 Fe은 침전률이 감소되는 결과를 나타내었다. 이러한 결과는 첨가된 CA는 바나듐 이온과 complex를 형성하지 않으며 선택적으로 불순물 이온이 EDTA와 complex를 형성하여 바나듐 침전 공정에서 안정화되기 때문으로 판단된다. 여과액 분석 결과 상등액 분석 결과 대비 Fe의 침전률은 증가하였는데 이러한 결과는 blank 공정과 반대되는 현상으로 세척 과정에서 pH 변화에 따라서 Fe 이온과 EDTA의 complex가 해리되기 때문으로 판단된다.
3.2. V2O5 순도 분석
순도 98.25% V2O5-F 분말을 활용하여 V2O5-F-blank 및 V2O5-F-EDTA-Na 분말을 제조한 후 불순물 함량 및 순도 분석을 수행하여 결과를 Table 2에 나타내었다. V2O5-F 시료를 활용한 알칼리 침출액 제조 공정에서 성분 침출률 분석 결과 V(90.6%), K(>100%), Cr(29.6%), Mn(33.2%), Fe(22.5%), Al(68.3%), Ca(46.0%), Ti(23.4%), Si(57.2%), Ga(>100%)로 분석되었다. 즉, V2O5-F 시료 내 주요 불순물이 부분적으로 알칼리 침출 공정에서 불용성으로 분리되지만 한편으론 제조된 바나듐 용액에는 많은 불순물이 포함됨을 알 수 있다. V2O5-F-blank 분말내 불순물 함유량 분석 결과 V2O5-F 분말 대비 MgO(-79.1%), K2O(-97.3%), TiO2(-94.7%), MnO2(-87.3%), Fe3O4(-79.9%), Na2O(-95.1%), Ga2O3(-75.1%), SiO2(-93.1%), Al2O3(-50.8%) 만큼 감소하였다. 그리고 CaO, Cr2O3, NiO, CdO, BaO, Ag2O 성분의 경우에는 100% 분리되었다. 따라서 불순물 총량은 3,011.08 mg/kg으로 순도 99.70%를 나타내었다. 즉, 알칼리 침출-AMV 침전 공정으로 구성되는 blank 공정을 통하면 순도 99.70% V2O5 분말 제조가 가능함을 확인하였다. 하지만 VRFB용 99.8% 이상의 V2O5 분말을 제조하기 위해서는 추가적인 불순물 분리 공정이 필요하다.
Table 2.
Results of V2O5 purity analysis
V2O5-F-EDTA-2Na 분말내 불순물의 함유량은 V2O5-F 분말 대비 MgO (-86.2%), K2O(-97.2%), TiO2(-95.1%), MnO2(-91.8%), Fe3O4(-92.4%), Na2O(-96.9%), Ga2O3(-80.3%), SiO2(-100%), Al2O3(-95.5%)로 감소하여 불순물 총량 655.51 mg/kg로 순도 99.93%를 나타내었다. 알칼리 침출액에 EDTA-2Na 첨가로 V2O5 분말내 불순물 Mg, Ti, Mn, Fe, Ga, Si, Al의 추가적인 함량 감소가 확인되었다. 특히, Si 성분은 100% 분리되는 결과를 나타내었으며 불순물 Co는 V2O5-F 분말에서는 확인되지 않았지만 V2O5-F-blank 및 V2O5-F-EDTA-2Na 분말에 포함되는 결과는 V2O5 제조 공정에서 2차적으로 유입된 것으로 판단된다. 지난 연구결과에서 99.98% 바나듐 전해액을 제조하기 위한 V2O5 분말내 불순물 함유량을 MgO (< 22 mg/kg), K2O(< 25 mg/kg), TiO2(< 9 mg/kg), MnO2(< 4 mg/kg), Fe3O4(< 177 mg/kg), Na2O(< 54 mg/kg), Ga2O3(< 1,532 mg/kg), SiO2(< 54 mg/kg), Al2O3(< 15 mg/kg)으로 제시하였다26). 즉, V2O5-F-EDTA-2Na 분말의 불순물 함량 분석 결과 순도는 99.8%이상이지만 K2O(151.56 mg/kg), MnO2(12.78 mg/kg), Na2O(101.15 mg/kg), Al2O3(204.39 mg/kg) 성분들은 제시된 함량보다 높아 추가적인 불순물 제어 연구가 필요한 것으로 판단된다.
CA 첨가를 통한 불순물 분리 정제 효과는 V2O5-F-EDTA-2Na 분말 분석에서도 확인되었다. 이러한 결과는 알칼리 조건에서 Fe과 같은 불순물 이온이 EDTA와 complex를 형성하여 바나듐 침전 공정에서 안정화되기 때문으로 판단된다. EDTA가 알칼리 용액에 용해되면 식 (5)와 같이 이온화되고 EDTA의 4개의 산소원자와 2개의 질소 원자는 금속 이온과 결합하여 식 (6)과 같은 킬레이트를 형성하는 것으로 예상된다29,30).
3.3. AMV 및 V2O5 구조 분석
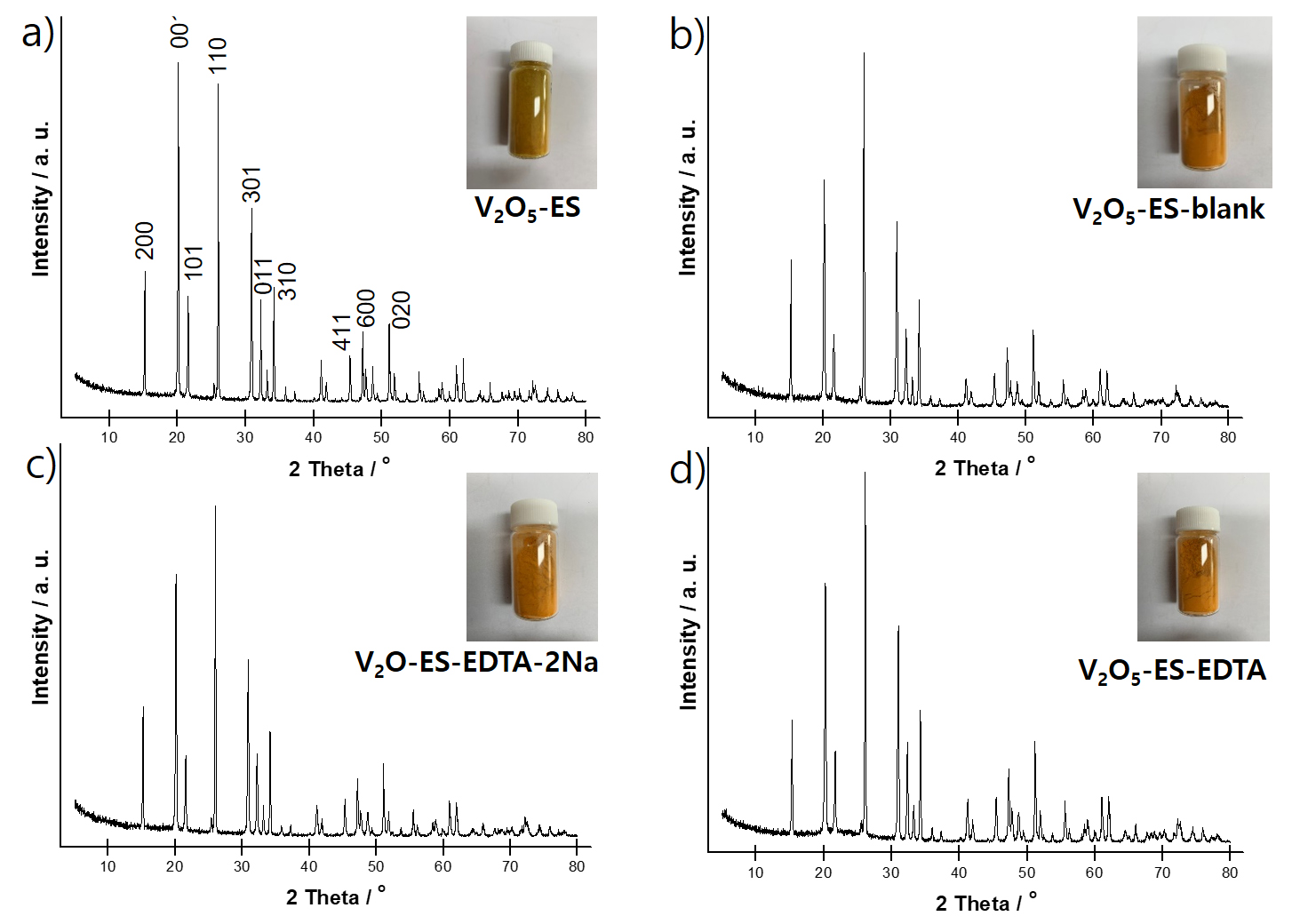
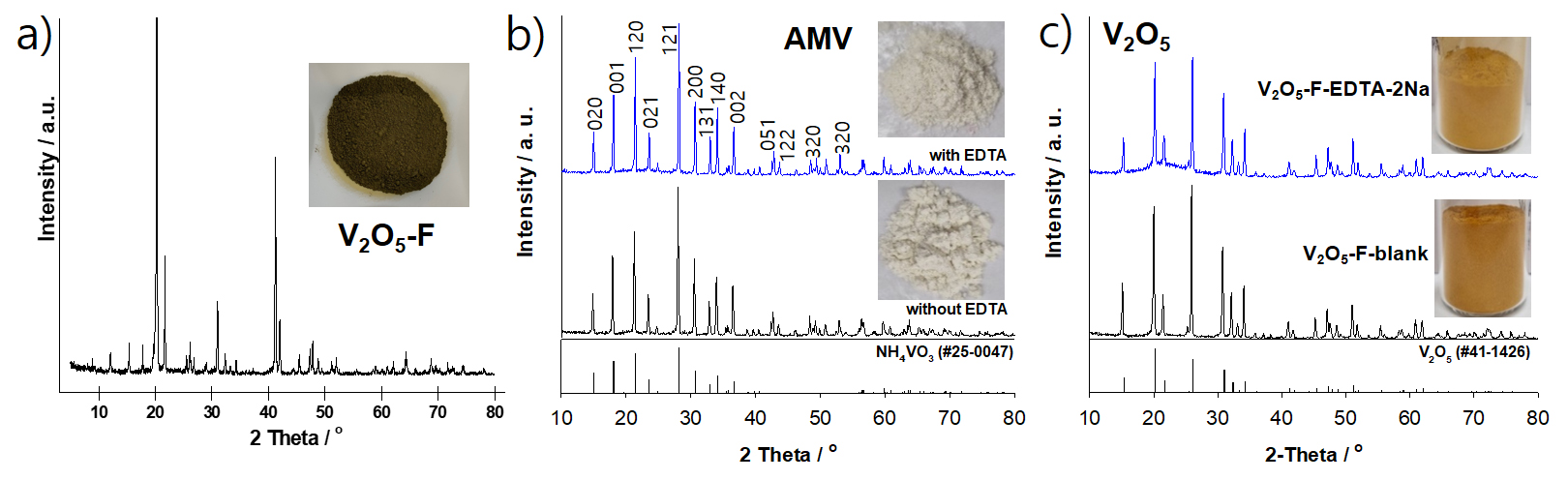
Fig. 4에 V2O5-ES 분말 및 이를 이용하여 제조된 고순도 V2O5 분말의 XRD 결과 및 사진을 나타내었다. 순도 99.69%를 갖는 V2O5-ES 분말 샘플은 XRD 분석 결과 전형적인 V2O5 결정 구조(JCPDS, No. 41-1426)를 나타내었다31). 이는 V2O5-ES 분말내 함유된 불순물 함량이 낮아 XRD 분석에서 불순물에 해당하는 상은 확인되지 않으며 이를 이용하여 제조된 V2O5 분말의 XRD 분말의 결과 또한 V2O5-ES 분말 결과와 유사하였다. Fig. 5에 V2O5-F 분말 및 이를 이용하여 제조된 AMV 및 V2O5 분말의 XRD 결과 및 사진을 나타내었다. 본 연구에서 활용된 순도 98.25%를 갖는 flake 분말은 페로바나듐의 원료로 사용되는데 회수 공정을 통하여 확보된 저순도 red cake 또는 AMV 분말을 800 ~ 1,000 °C에서 용융하여 제조된다. Fig. 5(a)에 나타낸 바와 같이 전형적인 V2O5 결정 피크 이외 불순물에 해당하는 결정성 피크를 보여준다. V2O5-F 분말을 이용하여 제조된 AMV 분말은 EDTA-2Na 첨가 여부와 상관없이 XRD 분석 결과 전형적인 NH4VO3 결정 피크(JCPDS, No. 25-0047)를 나타내었다32,33). 본 연구에서 제조된 AMV 분말을 550 °C에서 3시간 동안 열처리하여 제조된 V2O5 분말 또한 전형적인 고순도 V2O5 분말의 XRD 패턴을 나타내었다. CA 첨가 유무와 무관하게 고순도화 공정을 통하여 제조된 바나듐 화합물 분말내의 불순물들은 함유량이 낮아 XRD 분석 결과 확인되지 않았다.
3.4. 바나듐 전해액 특성 분석
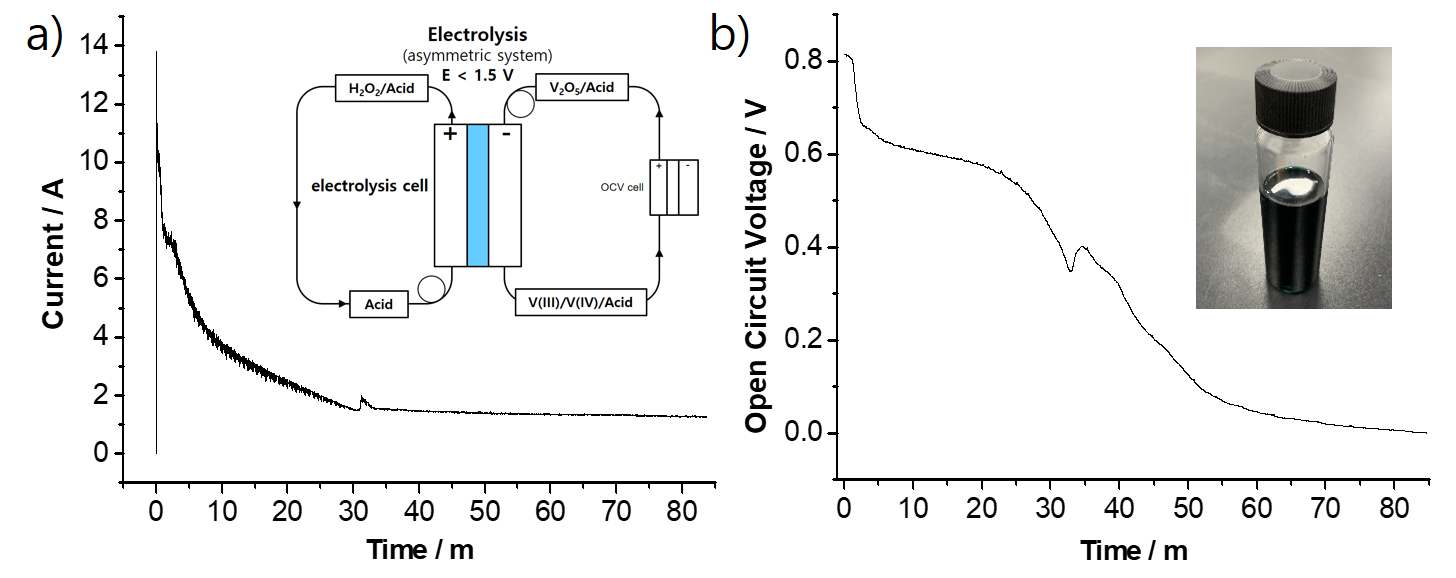
고순도 V2O5 분말(V2O5-F-EDTA-2Na)을 직접 전해 공정에 적용하여 바나듐 전해액을 제조하였으며 electrolytic cell에서 측정된 전류값을 Fig. 6(a), reference cell에서 측정된 전압 변화(OCV)를 Fig. 6(b)에 나타내었다. 직접 전해 공정은 일반적으로 금속 양극(anode) 전극에서 식 (7)과 같이 물분해 반응을 이용하는데 높은 전위값(+ 1.23 V)으로 실제 전압이 2.0 V이상인 반면 Fig. 6(a)에 나타낸 바와 같이 개발된 신공정에서는 카본 양극(anode)에서 식 (8)과 같이 낮은 전위에서 H2O2 산화반응이 일어나기 때문에 1.5 V 이하의 전압 조건에서 V(+5)→V(+3.5) 전환이 가능하다. electrolytic cell에서 측정된 전류값은 반응 시간이 증가하면서 초기 10.5 A에서 감소하다가 30분 이후에 안정화되면서 80분에 1.2 A값에 근접하였다. reference cell은 V(3.5+)의 상용 바나듐 전해액과 V(5+)에서 시작하는 바나듐 전해액의 전압 차이를 통해서 실시간으로 제조되는 바나듐 전해액의 산화수 변화 관찰이 가능하다. reference cell에서 측정된 전압은 초기 0.81 V에서 감소하다가 전압이 0 V에 근접하는 84분에 전해 공정을 종료하였다. 즉, reference cell에서의 0 V는 제조되는 바나듐 전해액의 산화수가 상용 전해액의 V(3.5+)와 동일함을 의미한다.
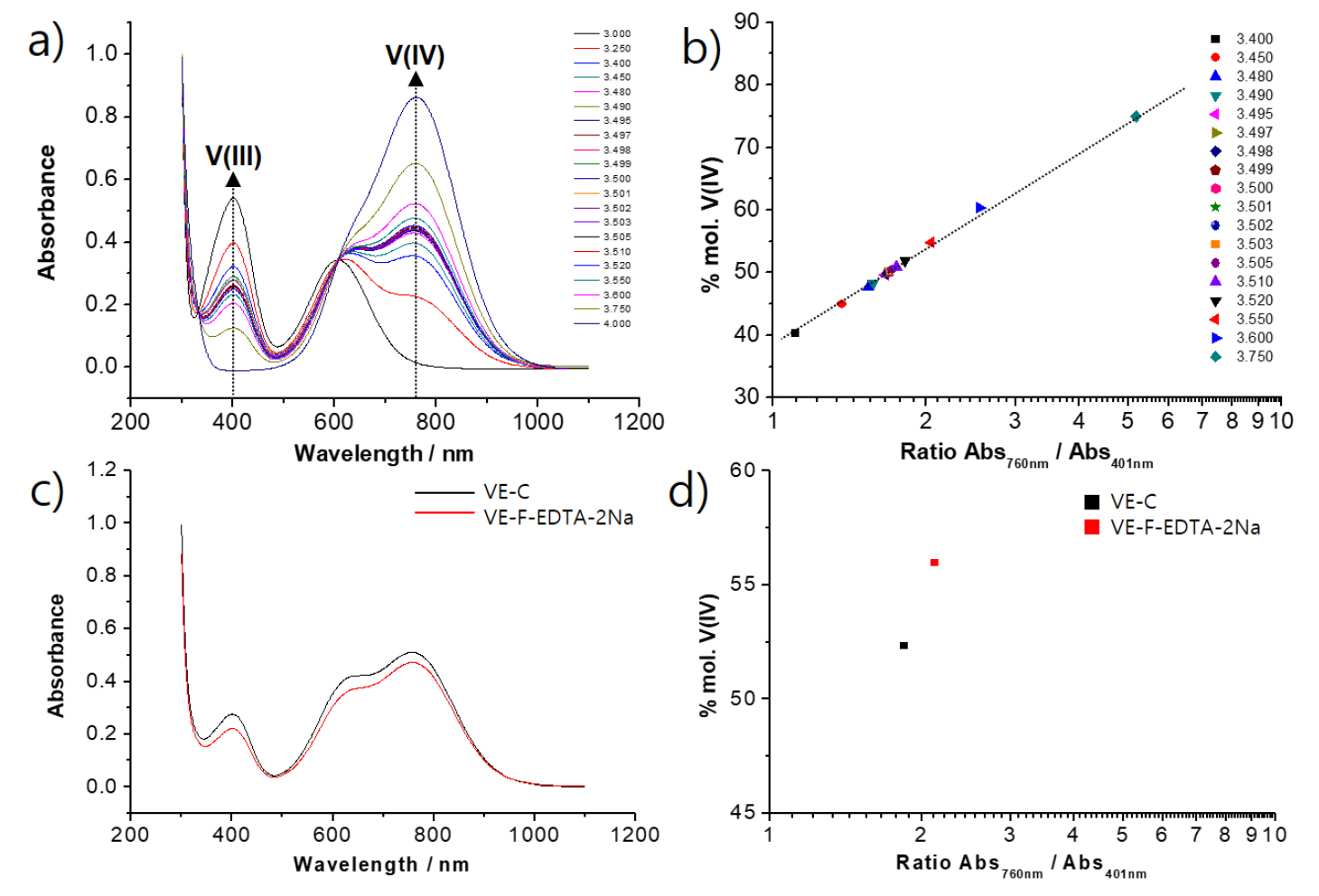
상용 바나듐 전해액과 고순도 V2O5를 활용하여 제조된 전해액의 특성 분석 결과를 Table 3에 나타내었다. 제조된 전해액내 바나듐 농도는 실험조건 1.5 mol/L에서 1.21 mol/L로 낮게 분석되었는데 이는 음극에서 발생된 바나듐 이온이 전해공정 중 고분자 멤브레인(Nafion 117) 통하여 양극으로 이동하거나 V2O5 분말 분산 용액이 전해시스템의 정체되는 부분에서 미반응 분말이 존재하기 때문으로 판단된다. 따라서 전해공정에 적합한 고분자 멤브레인 탐색(음이온 교환막) 및 최적화 연구(유로 설계)가 추가적으로 필요한 상황이다. 바나듐 전해액의 바나듐 산화수는 titration 분석과 UV 분석을 통해서 얻어진다. V(4+) 및 V(3+) 용액으로 제조된 모사 전해액 UV 스펙트럼 데이터 구축을 통하여 V(4+) 특성 피크 강도값과 V(3+) 특성 피크 강도값의 관계식을 통하여 실험적으로 분석이 가능하다34). V(4+), V(3+) 용액의 혼합 비율을 다르게 하여 바나듐의 산화수가 3+에서 4+ 범위를 갖는 용액을 제조하여 Fig. 7(a)와 같이 UV를 측정한 다음 Fig. 7(b)와 같이 스펙트럼의 V(4+) 특성 피크(760 nm) 강도값과 V(3+) 특성 피크(401 nm) 강도값의 비율과 % mol. V(IV)와의 선형적인 상관관계를 식 (9)와 같이 구하였다. Fig. 7(c), (d)와 같이 상용 바나듐 전해액과 제조된 전해액 UV 분석 이후 얻어진 % mol. V(IV) 값은 각각 52.3, 56.0을 나타내었고 이를 이용한 바나듐 산화수값(vanadium oxidation number, VON)은 식 (10)을 이용하여 계산하였다. 상용 바나듐 전해액과 제조된 전해액에 대한 계산된 VON는 각각 3.52, 3.56을 나타내었다.
바나듐 전해액의 순도 분석은 ICP-OES 분석을 통하여 진행하였으며 순도는 전해액과 불순물 총 함량을 이용한 식 (4)를 통해 계산되었다. 상용 전해액 및 제조된 전해액의 불순물 총합은 각각 209.89, 427.02 mg/L로 순도는 각각 99.98, 99.97%를 나타내었다. 본 연구에서 제조된 전해액의 밀도는 1.375 kg/L로 상용 전해액의 1.364 kg/L 대비 높은 값을 나타내었는데 이는 제조된 전해액 내의 높은 불순물 함량의 영향으로 분석된다. 상용 전해액 대비 제조된 전해액에는 불순물 Fe 함량은 확인되지 않았으며 K, Ca, Na, Al, Mg, Si 성분 농도는 높게 나타났다. 특히, Ca 및 Si 성분 농도는 선행 연구에서 제시한 바나듐 전해액내 불순물 함량 규격(Ca < 30 mg/L, Si < 20 mg/L) 보다 높았다25). 따라서 전해액의 순도 향상을 위해서는 V2O5의 추가적인 순도 향상이 필요하다고 판단된다. 특이하게, 킬레이트를 활용하여 제조된 V2O5 분말 내에 불순물 Si 성분이 존재하지 않는데도 불구하고 전해액에 높은 농도로 존재하는 이유는 불순물 Si 성분은 바나듐 전해액 제조 공정에서 화학적 반응기 및 전해 공정 중에 2차적으로 유입되기 때문으로 판단된다. 따라서 VRFB용 고순도 바나듐 전해액을 제조하기 위해서는 바나듐 원료 제조 및 전해액 제조 공정에서 불순물 2차 유입에 대한 주의가 필요하다.
Table 3.
Characteristics of the commercial and prepared vanadium electrolyte
4. 결 론
본 연구에서는 VRFB용 고순도 오산화바나듐을 제조하기 위한 저순도 바나듐 원료의 불순물 분리 정제 공정에서 킬레이트제(EDTA, EDTA-2Na)를 활용하였다. 먼저, 저순도 바나듐 원료를 이용하여 제조된 바나듐 용액으로부터 NH4VO3 분말 침전 회수 공정에서 상등액 및 여과액 분석을 통하여 킬레이트제 첨가 영향을 분석하였다. 킬레이트제가 첨가되면 상등액내 불순물 Fe 성분은 초기 바나듐 용액내의 농도와 유사하고 blank 공정 대비 높은 농도를 나타내었다. 이러한 결과는 바나듐 침전 공정에서 불순물 Fe 이온은 공침되지 않고 용액내 잔류하여 침전물내 불순물 Fe 성분이 감소될 수 있음을 의미한다. 최종적으로 제조된 V2O5 분말의 XRD 분석 결과 순도가 낮은 경우에는 불순물 상이 확인되지만 99% 이상의 분말에서는 확인되지 않았다. 저순도 바나듐 용액으로부터 회수된 NH4VO3 분말의 소성 공정을 통하여 제조된 최종 V2O5 분말의 순도는 99.7%로 분석되었지만 NH4VO3 분말 침전 회수 공정에서 킬레이트제를 활용할 경우 최종 V2O5 분말 순도가 99.9% 이상으로 향상되었다. 이러한 결과는 첨가된 킬레이트제는 불순물 이온과 반응하여 complex를 형성하고 불순물 이온이 안정화되기 때문에 회수 공정에서 바나듐에 대한 선택성이 향상된 것으로 판단된다. 하지만 제조된 V2O5 분말 내에는 불순물 규격 대비 K, Mn, Na 및 Al 함유량이 높아 추가적인 불순물 정제 연구가 필요하였다. 고순도 V2O5 분말을 새롭게 개발된 직접 전해공정에 적용하여 바나듐 전해액을 제조하였고 이의 특성을 상용 전해액과 비교 분석하였다. 제조된 바나듐 전해액은 높은 밀도 및 낮은 바나듐 농도를 나타내었으며 특히, 순도 99.98%의 상용 전해액 대비 불순물 K, Ca, Na, Al, Mg, Si 성분은 높은 농도를 나타내었고 순도는 99.97%로 분석되었다. 특히, 바나듐 전해액내 불순물 Si 성분은 바나듐 전해액 제조 공정에서 화학적 반응 및 전해 공정 중에 2차적으로 유입되는 것으로 판단된다.