1. Introduction
글로벌 탄소중립 전략과 더불어 전기자동차의 개발은 탈탄소화의 주요 수단 중 하나로 여겨져 그 수요가 급증하였으며, 주요 부품인 리튬이온배터리(Lithium ion battery, LIB) 시장 또한 확대되는 전망이다1,2). 또한, 많은 국가에서는 10~40년 이내에 가솔린 차량의 판매를 금지할 계획으로 이에 상당수의 LIB 팩이 필요하며, 이는 2030년까지 100만 개에 이를 것으로 추정된다3,4,5). LIB의 사용 수명은 제한되어 있기에 이러한 대량 수요는 필연적으로 대규모 폐기로 이어진다. 폐LIB는 단순 폐기 또는 매립이 아닌 유가 자원 회수 및 순환을 통한 2차 자원으로 유용하게 사용할 수 있다. 또한, 이로 인한 경제적 이익을 창출할 수 있으며, 이에 전 세계 폐LIB 재활용 시장은 2027년까지 110억 7천만 달러에 이를 것으로 예상된다6,7).
LIB의 종류는 양극재의 종류에 따라 나누어지며, 기존의 전기자동차에 주로 사용되던 삼원계 니켈코발트망간(Nickel-Cobalt-Manganese, NCM)계 배터리에서 상대적으로 경제적이며, 구조 안정성이 우수하고 수명이 높은 리튬인산철(Lithium iron phosphate, LFP)계 배터리로 교체되면서 LFP계 시장이 활성화되고 있다8,9,10).
폐LFP로부터 유가금속을 회수하는 방법으로 크게 건식 및 습식 제련이 있으며, 가장 높은 가치를 가진 리튬을 얼마나 효율적으로 회수할 수 있는지에 관한 다양한 연구가 수행되고 있다11,12,13,14,15,16,17,18,19,20). 먼저, 건식 제련의 경우 단순한 공정 대비 처리량이 많고, 원료 적용이 다양하기에 많은 기업에서 채택하여 사용됐지만12,13), 높은 에너지 비용, 탄소 및 유해 가스 배출 그리고 다량의 불순물 발생에 관한 문제가 제기되어 이러한 문제를 보완하기 위해 습식 제련이 적용되고 있다.
습식 제련은 빠른 금속 회수 속도, 비교적 낮은 유해 가스 배출, 낮은 에너지 비용 등으로 많은 기업에서 폐배터리 재활용을 위해 채택되고 있지만, 무기산의 사용 시 유해 물질과 폐수의 발생이 문제 되고 있다14,15). 또한, Wang et al.(2022)의 연구에 의하면 폐LFP 분말 내 바인더(Polyvinylidene Fluoride, PVDF)가 남아있어 침출 반응을 저하해 부정적인 영향을 미치며, 추후 F와 같은 불순물의 오염을 지적하였다16).
이렇듯 최근 무기산의 사용을 줄여 환경 오염을 최소화하고자 기계화학적 방법을 사용하여 리튬을 회수하거나 열처리를 통한 리튬 회수 및 분리 효율을 증대시키는 연구가 수행되고 있다18,19,20). Jie et al.(2020)의 연구에 의하면 열처리를 통해 LFP 내 철을 산화시켜 철의 침출율을 저하하여 0.1 M H2SO4 용액으로 침출하여 리튬은 최대 약 100% 침출하였다19). Liu et al.(2023)의 연구에서는 과황산계 산화제인 (NH4)2S2O8와 과산화수소수를 이용하여 기계적 활성을 이용해 리튬을 LiNH4SO4로 전환하여 수침출하였고, 이때 리튬은 최대 약 95.3%로 침출되었다20).
이에 본 연구에서는 폐LFP 양극재로부터 회수된 블랙파우더(Black powder)를 이용하여 리튬을 선침출하고자 하였다. 환경 오염의 문제가 있는 무기산이 아닌 과황산계 산화제인 과황산나트륨을 사용하였고, 바인더 제거 및 침출 효율 향상을 위해 열처리 및 기계화학적 처리를 하였다. 각각 대기 및 불활성 분위기에서 열처리하였고, 열처리 후 양극재 분말 내 바인더의 거동 그리고 결정상 변화를 확인하였다. 이후 기계화학적 공정을 통하여 블랙파우더 내 리튬을 가용성 리튬 화합물로 전환 및 증류수를 이용하여 선택적 침출을 하였다. 이에 각각의 변수에 대한 리튬 및 주요 원소의 침출 효율을 비교하고자 하였다.
2. Experimental
폐LFP 양극재를 전단응력을 사용하여 파쇄 후 150 μm로 분급한 블랙파우더를 원료로 사용하였다. 본 연구의 원료인 블랙파우더의 함량을 살펴 보면, 리튬은 약 42,272 ppm 함유되어 있으며, 철은 225,115 ppm 그리고 인은 약 157,661 ppm으로 확인되었다.
폐LFP 블랙파우더의 열처리 조건을 산출하기 위해 TG-DTA(Thermogravimetry-Differential thermal analysis, TG-DTA, STA 449 F5, NETZSCH)을 사용하여, 대기 분위기 및 비활성분위기에서 각각 10℃/min의 속도로 1,000℃까지 온도를 올리면서 무게 변화량을 확인하였다. 분석 결과를 통해 열처리 온도를 설정하였으며, 알루미나 도가니에 블랙파우더를 담아 진공 관상로를 사용하여 대기 분위기 및 비활성분위기 하에서 목표 온도까지 10℃/min의 승온 속도로 올린 후 1시간 유지하며 열처리를 진행하였다. 이때 비활성분위기는 질소가스를 300 cc/min으로 투입하며 제어하였다. 열처리 후 폐LFP 블랙파우더를 XRD(X-ray diffraction spectroscopy, XRD, XRD-6100, Shimadzu) 분석을 통해 결정상 변화를 확인하였으며, 바인더의 분해 유무를 확인하기 위해 FT-IR(Fourier Transform Infrared Spectroscopy, FT-IR, Nicolet iS50, Thermo Fisher Scientific) 분석을 진행하였다.
열처리 후 블랙파우더로부터 리튬을 선침출하기 위해 가용성 리튬화합물로 전환하고자 하였으며, 관련 메커니즘 개략도를 Fig. 1에 나타내었다. 이에 과황산계 산화제인 과황산나트륨(Na2S2O8, Sodium persulfate, Sigma-Aldrich)을 이용하여 블랙파우더와 기계화학적 반응으로 아래 식 (1)과 같이 가용성 리튬화합물로 전환을 유도하고자 하였다.
기계화학적 반응은 Ball mill(HAN TECH, HBM-Mini-3R)에 각 조건으로 열처리된 블랙파우더 약 5 g과 과황산나트륨 분말 약 4.15 g 그리고 과산화수소수 1.5 ml을 투입하였다. 또한, 직경 5 mm, 10 mm의 지르코니아 볼을 약 40% 충진하였으며, 3시간 동안 상온에서 임계속도를 고려하여 산출한 160 rpm으로 밀링하였다. 밀링 반응 후 가용성 리튬으로 전환되었다면 증류수로 리튬의 선택적 침출이 가능하므로, 고액비 50 g/L로 증류수를 투입하여 1시간 동안 추가 밀링 반응으로 리튬을 선택적으로 침출시켰다. 침출 반응 후 고액분리하여, 액상은 ICP-OES 분석(inductively coupled plasma optical emission spectroscopy, ICP-OES, iCAP Pro XP, ThermoFisher)을 통해 주요 원소의 함량을 분석하여 침출율을 산출하였으며, 고상은 XRD 분석을 통해 결정상 변화를 확인하였다.
3. Results and discussion
폐LFP 블랙파우더로부터 리튬을 선침출하기 위해서 본 연구진은 앞서 일반 침출법과 기계화학적 침출법에 관하여 선행 연구를 진행하였다21,22). 폐LFP 양극재의 경우 전기적 특성 향상을 위해 양극재 표면을 카본으로 코팅하기에 일반 침출법 사용 시, 분말의 소수성으로 인해 침출 용액에 젖지 않고 표면 위로 뜨는 현상이 나타나 반응 저하를 일으키므로 기계화학적 반응을 통해 침출 용액과의 반응성을 높여 리튬을 먼저 회수하고자 하였다.
또한 열처리를 통해 폐LFP 블랙파우더 내 바인더를 분해하여 입자 간 비표면적을 높여 반응 표면을 넓히고자 하였다. 이에 열처리는 대기 분위기 및 질소 분위기에서 진행하여 비교하고자 하였으며, 열처리에 앞서 TGA 분석을 통해 아래 Fig. 2(a)에 나타내었다. 먼저 대기 분위기에서 열처리 시, 변곡점은 약 250, 430, 500, 800℃로 네 군데에서 확인되었다. 특히 430℃까지 온도 상승에 따라 무게 감소가 나타나는데 이는 분말 내 수분 및 일부 유기물질이 분해됨에 의한 것으로 판단되며, 430℃에서 500℃ 구간에서 무게가 약 0.9% 증가하는 것을 확인할 수 있었다. 이러한 무게 증가는 LFP 구조 내 철 이온이 산화됨에 따라 무게가 증가하는 것으로 사료된다. 500℃에서 800℃까지 약 8.9%의 급격한 무게 감소가 확인되며, 800℃ 이후의 구간에서는 변화가 나타나지 않았다. TGA 분석 결과를 바탕으로 폐LFP 블랙파우더를 각각 10℃/min의 승온 속도로 변곡점 온도까지 올린 후 3시간 유지하여 열처리하였으며, 열처리 후 분말 사진을 Fig. 2에 함께 나타내었다. 열처리온도가 증가함에 따라 폐LFP 블랙파우더의 색상이 검은색에서 연한 갈색, 황토색 그리고 적갈색으로 변한 것을 확인할 수 있었다.
상기 같은 조건으로 질소 분위기에서 진행한 TGA 분석 결과는 Fig. 2(b)에 나타내었다. 대기 분위기와 달리 온도 상승에 따른 무게 증가 부분은 확인되지 않았으며, 변곡점은 약 250, 530, 750℃로 세 군데에서 확인되었다. 또한 열처리 후 폐LFP 블랙파우더의 색상은 변화 없이 모두 검은색이었다. 이에 본 분석 결과를 기반으로 대기 분위기의 열처리 조건을 산출하였다.
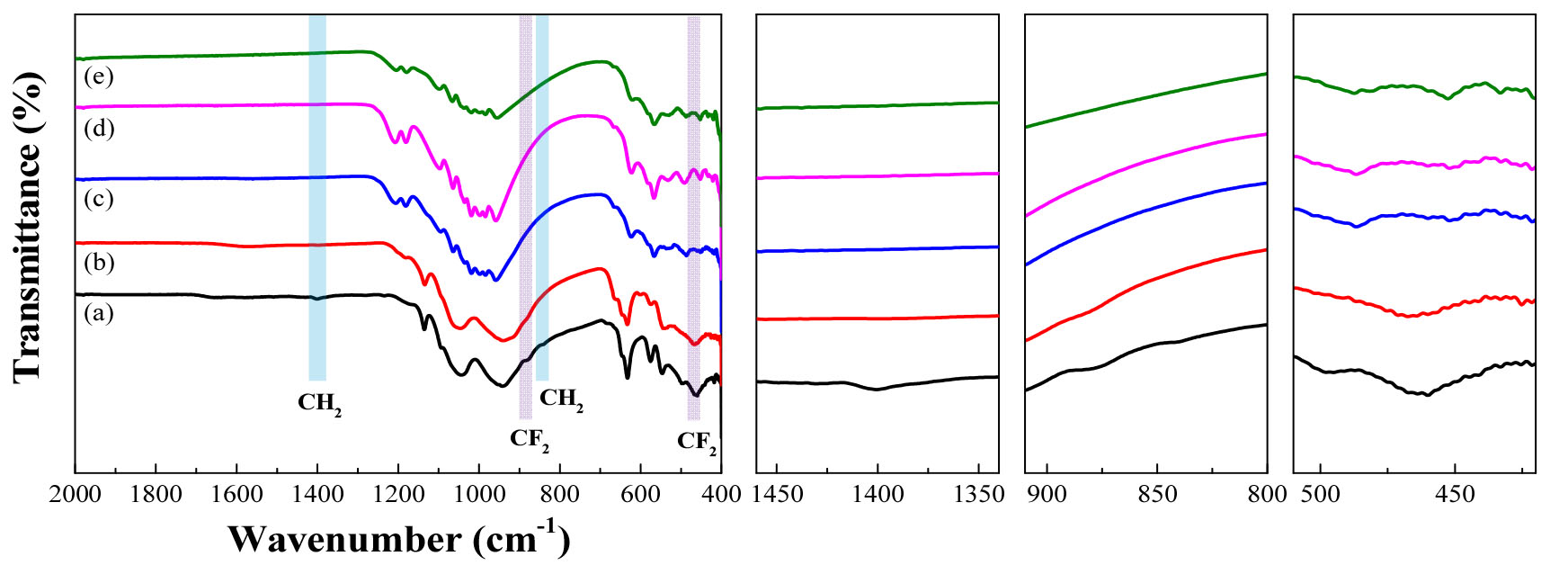
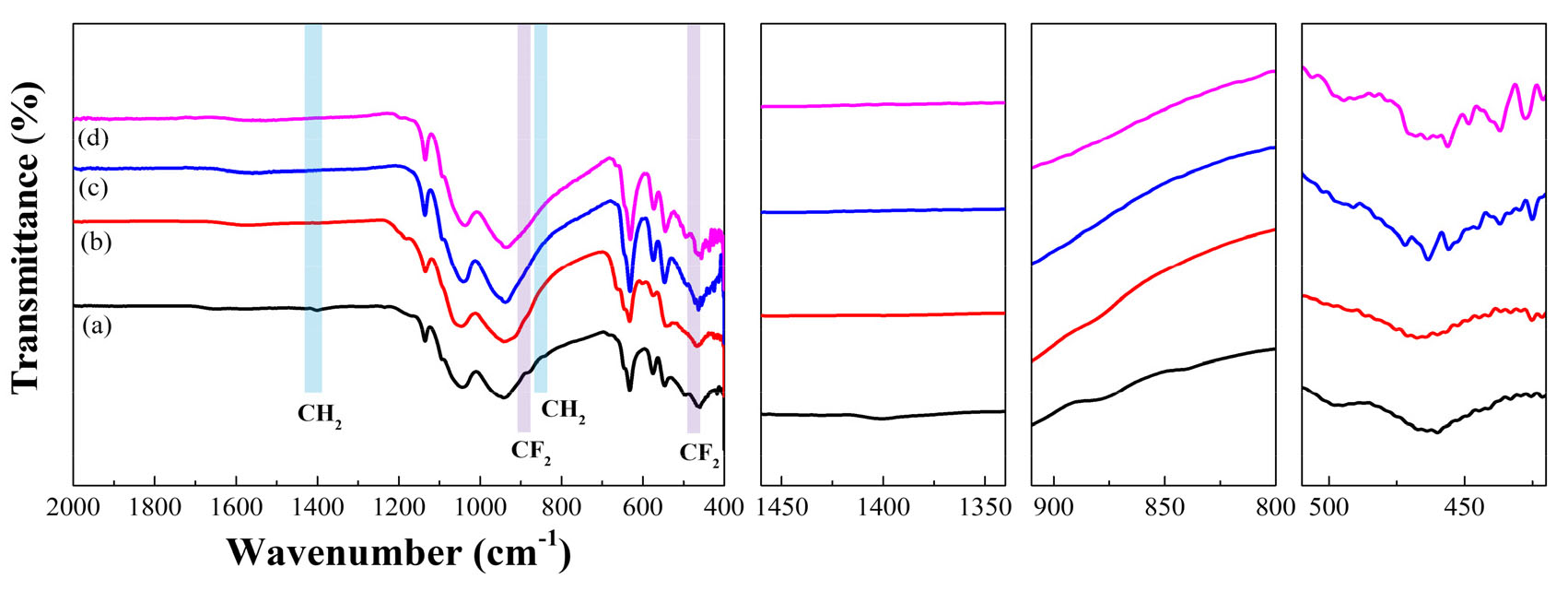
LFP 양극재 제조 시 바인더로 주로 사용되는 PVDF (Polyvinylidene fluoride)가 열처리를 통해 분해되었는지 확인하기 위해 FT-IR 분석을 진행하였다. Wu et al.(2019) 연구에 따르면 LFP 양극재 내 바인더는 약 4% 함유되어 있으며, PVDF는 450℃에서 분해되기 시작한다23). 또한 PVDF는 CH2와 CF2의 분자 결합으로 이루어져 있으며, Wu et al.(2019)23) 및 Dong et al.(2016)24)의 문헌을 참고하여 PVDF의 특성 스펙트럼을 비교하였다. 주로 468, 840, 1400 cm-1 파장에서 피크를 확인할 수 있었다.
대기 분위기에서 열처리한 분말의 FTIR 분석 결과인 Fig. 3과 질소 분위기에서 열처리한 분말의 FTIR 분석 결과는 Fig. 4에서 확인할 수 있듯이 열처리온도가 증가할수록 468, 840, 1400 cm-1 파장의 피크가 없어지는 것을 확인할 수 있었다. 전체 분말 내 바인더의 함유량이 매우 낮아 미세하게 피크의 변화가 나타났으며, 열처리로 인해 바인더가 분해되었음을 확인할 수 있었다.
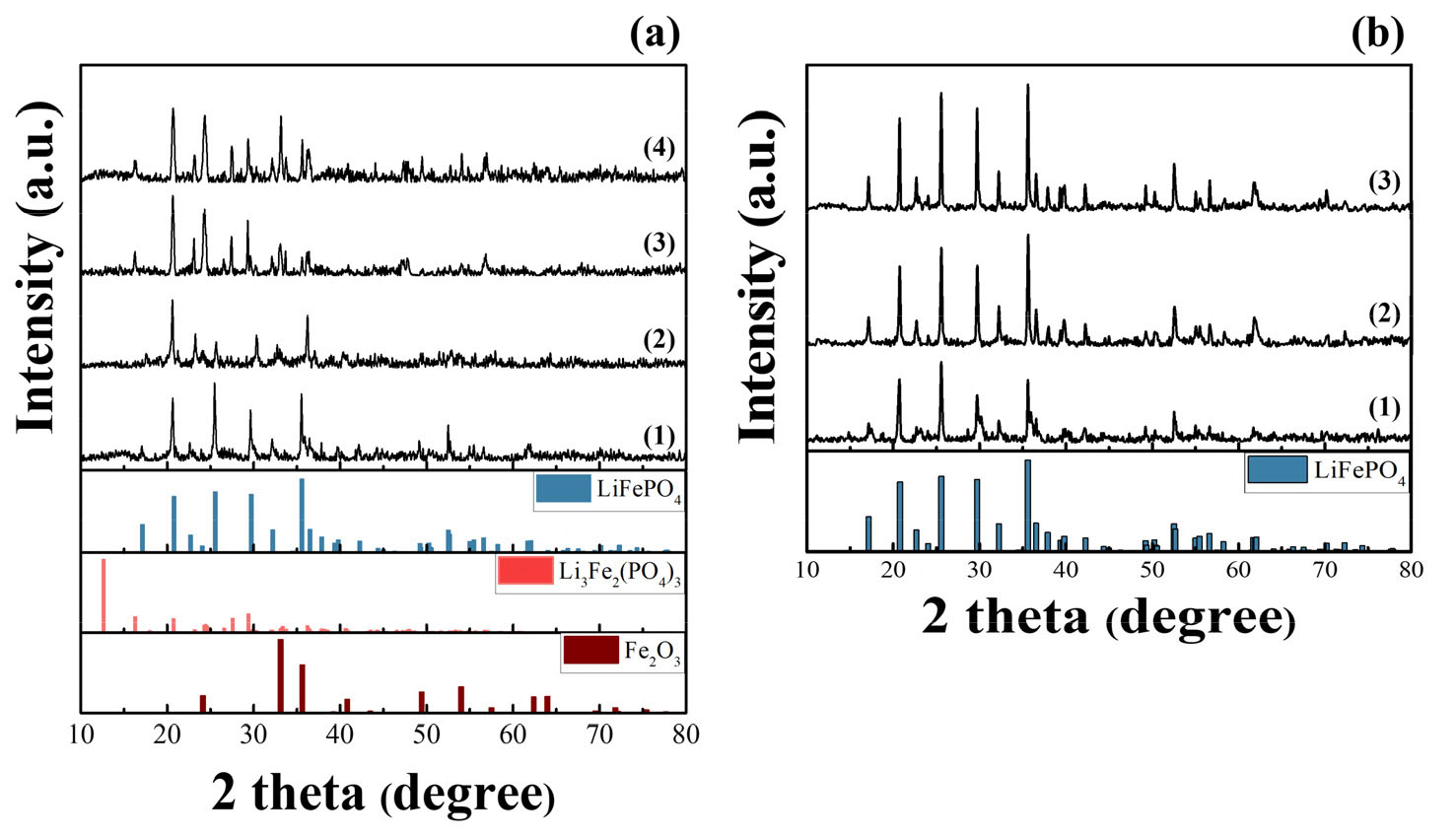
열처리로 인한 폐LFP 블랙파우더의 결정상 변화를 확인하기 위해 XRD 분석을 수행하였고, Fig. 5에 대기 분위기 및 질소 분위기에서 열처리 후 결과를 각각 나타내었다. 먼저 Fig. 5(a)의 대기 분위기에서 약 250℃로 열처리한 분말의 XRD의 분석 결과에서는 LiFePO4 결정상과 일치하는 것을 확인할 수 있었으며, 430℃부터 Li3Fe2(PO4)3의 피크가 나타나며 온도가 증가할수록 Fe2O3 결정상도 뚜렷하게 확인되었다. 이는 기존 연구에서도 언급되었듯이 열처리 후 식 (2)와 같은 반응식에 의해 LFP 양극재가 Li3Fe2(PO4)3와 Fe2O3로 상 전환되었음을 확인할 수 있었다25,26).
반면 Fig. 5(b)와 같이 질소 분위기에서 열처리한 후 분말의 XRD 결과를 보면, 대기 분위기와 달리 열처리 온도가 증가할수록 상대적으로 LiFePO4 결정상의 피크가 뚜렷해지고 인텐시티가 증가하는 것이 확인되는데 이는 수분 및 유기물질이 분해됨에 따른 것으로 사료된다.
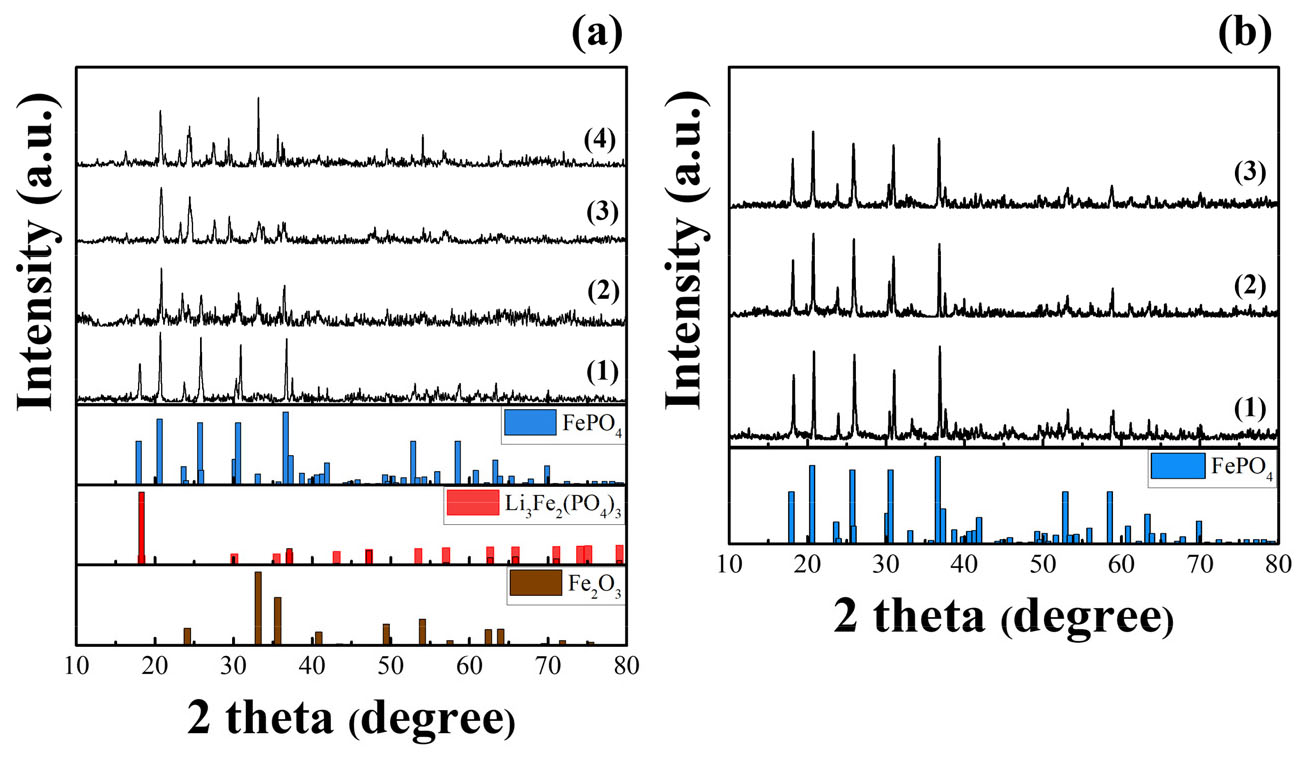
각각의 조건으로 열처리된 분말과 과황산나트륨 분말을 볼밀링기에 넣고, H2O2 1.5 ml 추가하여 기계화학적 반응을 유도하였다. 이때, 과황산나트륨 분말은 폐LFP 블랙파우더 내 리튬 함유량의 1.1배로 혼합하였다. 약 3시간의 볼밀링을 통한 기계화학적 반응 후 분말의 결정상 변화를 확인하기 위해 XRD 분석을 하여 Fig. 6에 나타내었다. Fig. 6(a)는 대기 분위기에서 열처리한 분말의 XRD 결과로 250℃로 열처리한 샘플은 주로 LiNaSO4와 FePO4 그리고 미반응의 Na2S2O8 결정상이 함께 관찰되었다. 열처리 온도가 증가할수록 FePO4 피크가 감소하고, 약 500℃ 조건으로 열처리한 샘플에서부터 Li3Fe2(PO4)3의 피크가 명확하게 관찰되었다.
질소 분위기에서 열처리한 XRD 결과는 Fig. 6(b)에 나타내었고, 분석 결과 열처리 온도에 따라 뚜렷한 결정상 변화는 나타나지 않았으며 상대적으로 피크가 좀 더 뚜렷해지고, 인텐시티 값이 증가하였다. 이때, 기계화학적 반응을 통해 형성된 주요한 결정상은 LiNaSO4와 FePO4로 확인되었다. 이에 질소 분위기에서 열처리한 분말 내 포함된 리튬은 기계화학적 반응을 통해 수침출이 가능한 가용성 형태로 전환되었음을 확인할 수 있었다.
가용성 리튬 화합물로 전환하기 위하여 식 (1)과 같이 원료의 결정상인 LiFePO4 결정과 Na2S2O8 분말이 혼합되어, LiNaSO4와 FePO4 결정상으로 전환될 것으로 예상하였으며, 각각의 열처리 분위기 및 기계화학적 반응을 통한 분말의 XRD 분석 결과 이와 일치하는 것으로 확인되었다.
기계화학적 반응을 통해 리튬을 LiNaSO4 형태로 전환하였고, 고액비 100 g/L의 조건으로 증류수로 리튬을 선택적으로 침출하기 위해 볼밀링기에 투입하여 침출 반응을 진행하였다. 수침출 반응 후 고액분리하여 고상은 침출잔사로 XRD 분석하여 아래 Fig. 7에 나타내었으며, 액상은 ICP 분석을 통해 침출율을 산출하여 Fig. 8에 나타내었다.
먼저 대기 분위기에서 열처리 후 침출잔사의 XRD 분석 결과에서 단순 열처리 후 XRD 결과와 마찬가지로 500℃와 800℃는 결정상이 일치하였고, 250℃ 그리고 430℃로 열처리한 분말의 XRD 결정상에서는 차이를 나타내었다. 먼저 250℃ 분말의 침출잔사는 FePO4가 메인 결정상으로 확인되며, 430℃는 250℃와 500℃에서 관찰되는 피크들이 모두 낮은 인텐시티로 나타난다. 500℃ 그리고 800℃ 열처리 후 침출잔사의 XRD 결과에서는 열처리 과정에서 생성된 Fe2O3 및 Li3Fe2(PO4)3와 같은 결정상은 침출되지 않아 잔사로 남게 된다.
질소 분위기에서 열처리 후 침출잔사의 XRD는 모두 열처리 온도와 관계없이 FePO4 결정상과 일치하였으며, 이는 수침출을 통해 리튬이 회수된 것으로 판단된다.
액상의 ICP 분석 후 Kim et al.(2023)의 연구에서와 같이 침출율을 계산하여 Fig. 8에 나타내었다11). 먼저 대기 분위기에서 열처리한 블랙파우더의 기계화학적 반응 후 수침출 시, 약 250℃의 열처리는 상 전환이 일어나지 않아 열처리하지 않은 결과와 비슷하게 나타났다. 리튬의 침출율은 약 100%, 그리로 철은 250℃로 열처리함에 따라 3.82%에서 1.49%로 감소하였으며, 인은 약 0.02%에서 0.22%로 비슷한 결과를 확인할 수 있었다. 반면 430℃부터 리튬의 침출율은 약 65.12%로 감소하는데 이는 앞선 XRD 결과에서도 확인할 수 있었듯이 일부 LiFePO4 결정상이 유리화됨에 따라 리튬이 수 침출되지 않았기 때문이며, 500℃ 및 800℃로 열처리한 분말의 철이 모두 유리화된 결정상으로 전환되어 침출되지 않았다.
반면 질소 분위기에서 열처리한 분말의 수침출 결과는 리튬은 모든 열처리 온도 조건에서 100% 가까이 침출되었으며, 철은 열처리 온도가 증가할수록 미세하지만, 감소하는 경향을 확인할 수 있었다. 열처리하지 않은 조건에서는 약 3.82%였으며, 250℃에서는 약 2.66% 그리고 500℃에서는 약 2.19%, 800℃에서는 약 2.12%로 산출되었다. 원소 인에 대해서도 모두 0.5% 이하로 추후 본 액상으로 리튬화합물 회수 시, 불순물의 농도가 감소할 것으로 판단된다.
4. Conclusions
폐LFP 블랙파우더(150 μm)를 대상으로 리튬을 선침출하기 위해 분말 내 바인더인 PVDF를 분해하여 반응 면적 및 효율을 향상시키고, 분말 표면의 소수성으로 인한 용매와의 반응성 저하를 보완하고자 기계화학적 반응을 통해 리튬을 가용성으로 전환하여 회수하고자 하였다. 이때, 대기 분위기 및 질소 분위기에서의 블랙파우더의 특성 변화를 확인하고자 하였으며, 최종적으로 리튬의 선택적 침출율에 미치는 영향을 확인하였다.
1) 폐LFP 블랙파우더를 대기 분위기에서 열처리 시, 열처리온도가 증가할수록 LiFePO4의 결정상이 Li3Fe2(PO4)3와 Fe2O3로 전환됨에 따라 모든 원소에 대하여 침출율이 감소하며, 가용성 리튬인 LiNaSO4 결정상이 생성되지 않아 기계화학적 반응 후 수침출 과정에서도 리튬의 침출율이 약 18%까지 감소하였다.
2) 폐LFP 블랙파우더를 질소 분위기에서 열처리 시, 열처리온도와 관계없이 수분 및 유기물질만 분해되어 결정상 변화에는 영향을 미치지 않았다. 이에 따라 기계화학적 반응 후 수침출 시, 리튬의 침출율은 모든 조건에서 약 100%로 나타나며, 철 및 인의 침출율은 열처리온도가 증가할수록 감소하였다.