1. 서 론
전해 채취는 고온에서 화학적 활동도를 갖는 금속 용융염의 전해를 통해 금속 이온을 금속 또는 합금으로 환원시키는 전해 증착 공정으로, 물과의 반응성이 큰 알칼리 금속, 희토류, 알루미늄 등 주요 활성 금속의 생산에 이용되고 있다. 특히 희토류의 경우 비점이 낮은 몇 가지 원소를 제외하고 대부분의 희토류 금속과 합금들이 용융염 전해 채취에 의해 생산되고 있다1,2,3).
용융염 전해 채취 공정에서 가장 중요한 경제 지표 중 하나는 에너지 원단위(energy consumption per unit weight of metal: kwh/kg of metal)로서, 이를 낮추기 위해서는 외부로 손실되는 에너지를 줄이거나 전류 효율을 향상 시켜야 한다.
Yin 등4)은 에너지 절감 방향과 방법을 검토하기 위하여 3kA급 용융염 전해조의 열평형 계산을 통해 전해의 에너지 소비 상황을 이해하고 에너지 손실 감소를 위한 제언을 하였다. 또한 Wang 등5)도 10kA급 하부 음극 용융염 전해조의 열평형 계산을 통해 전해조 내 에너지 구성, 이용 수준을 파악하고 에너지 저감 방법에 대해 검토하였다.
한편, 전류 효율은 전기 분해에 관한 패러데이 법칙에 의해 전극에서 석출(환원)되는 단위 시간 당 이론 석출량(인가전하량/(화학당량×패러데이상수))에 대한 실제 석출량의 비율이다. 전류 효율은 전해지지염의 물성, 전해온도, 전압 및 전류의 세기, 전해시스템의 구성 등 여러 요인에 의해 달라진다. 특히 전해온도는 전해지지염의 유동성, 증발, 석출금속의 재용해 등에 영향을 미치므로 전류 효율을 크게 좌우한다. 따라서 전해온도는 전해지지염과 석출금속의 융점을 고려하되 적절하게 결정되는 것이 매우 중요하다.
그러나 용융염 전해 시 외부로부터 투입되는 전기 에너지와 양극에서의 가스 발생에 기인한 발열량 대비 전해에 소모되는 에너지 및 외부로의 손실 에너지 차이, 즉 열수지로 인해 전해 초기에 염욕의 온도가 급격히 상승할 수 있다. 염욕의 온도는 전해 시작 후 일정 시간이 지나면 전체적으로 열평형을 이루게 되어 일정 온도로 유지되는데 이때 처음에 목표했던 전해온도와 상이해질 수 있으며 이는 전류 효율에 악 영향을 미친다.
앞서 언급하였던 Yin 등4)과 Wang 등5)은 입력되는 직류 전기에너지로 전해 반응과 열평형을 유지하는 상태에서 열평형 계산을 실시하여 염욕의 온도 변화를 고려하지 않았으나 본 보고에서는 전해 초기 염욕의 온도 상승에 주목하여 전해 초기를 대상으로 열수지 검토를 실시하였다.
본 연구에서 사용한 전해 장치는 인용 문헌4,5)이나 공업 전해조와 달리 전해 온도까지 전해조를 승온하기 위한 가열용 교류 전원과 전해용 직류 전원으로 구성되어 있어 전해 개시 후 교류 전원을 차단하지 않으면 전해 중 교류 에너지도 짧게나마 간헐적으로 공급될 가능성이 있다. 그러나 이런 경우에도 교류 공급에 대한 별도의 실시간 전력 모니터링 장치를 갖춘다면 후술하는 전해 열수지 계산에 이를 반영하고 열평형 계산을 실시할 수 있다.
본 연구에서는 앞서 언급대로 전해 초기 수 분간에 주목하였으며 그 시간 동안에는 교류 전원을 차단하지 않았음에도 교류 에너지의 공급은 관찰되지 않았다. 이와 같은 사실을 바탕으로 전해 초기의 열수지 계산을 실시하였으며, 이를 통해 염욕의 온도 변화에 대한 계산치와 실측치를 비교해 보고 외부로 손실되는 에너지를 평가하였다.
이와 같은 인식과 접근을 통하면 에너지 손실(또는 이용률)의 관점에서 전해시스템의 평가 및 개선과 전류 효율의 관점에서 유사 공정의 전해온도 변화 예측, 즉 에너지 원단위 저감에 도움이 될 것이다. 전보6)에서 Nd 금속의 전해 채취 중 전류 효율에 미치는 전해 인자의 영향에 대해 보고한 바 있으므로, 본 논문에서는 저자들의 실험 데이터를 이용하여 용융염 전해 채취 중의 열수지에 대해 보고하고자 한다.
2. 실험방법
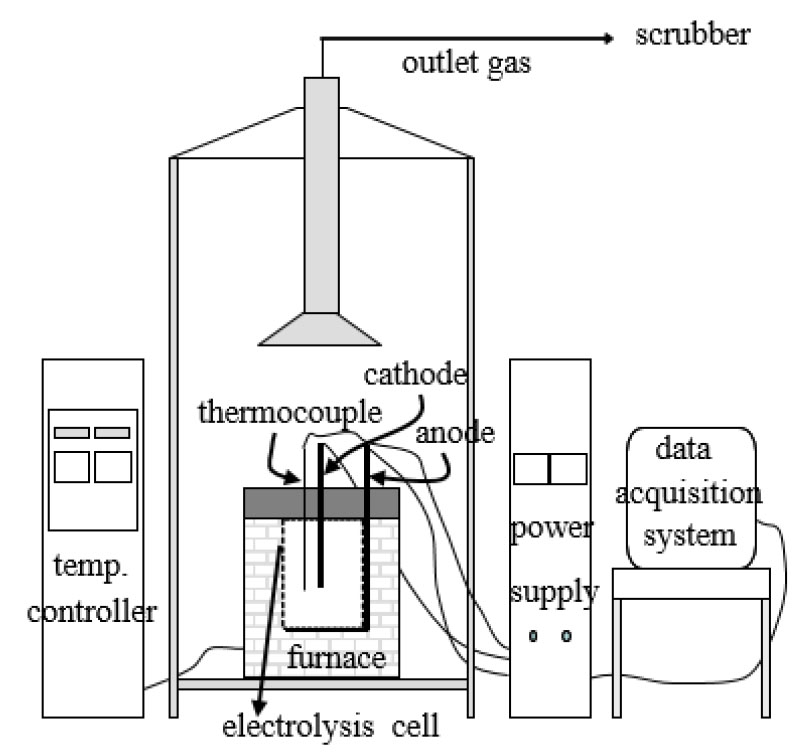
Fig. 1에 용융염 전해 실험 장치의 개략도6)를 나타내었다. 전해 장치는 가열용 교류 전원과 가열로, 가열로 내부의 전해조, 전해용 직류 전원과 전극, 배가스용 후드와 스크러버, 전해 데이터 표시 및 수집 장치 등으로 구성되어 있다. 전해조로는 240h×70∅×10t의 크기를 지닌 원통형의 graphite 도가니, 음극으로는 원통 중심에 위치하여 용융염 내 침지 깊이 조절이 가능한 직경 20∅의 텅스텐 봉, 양극으로는 graphite 도가니를 사용하였다. 가열로의 상부는 배가스, 원료의 추가 장입, 염욕의 온도 측정 등을 위한 구멍들이 가공된 세라믹 보드로 덮었다.
전해지지염으로 LiF-NdF3-BaF2 3원계 염을 사용하였으며 그 구성비는 무게비로 LiF:NdF3:BaF2 = 7.5:67.4:25.1이었다6). 전해지지염의 투입량은 다음과 같이 결정되었다. 미리 정해진 인가전류와 양극 전류 밀도로부터 양극(graphite 전해조)과 전해지지염의 접촉 면적을 계산한 후 이로부터 전해지지염의 부피를 구하였다. 부피는 전해지지염의 고체 평균 밀도를 이용하여 무게로 환산되었다. 그러나 실제 전해 시 전해지지염의 액체 밀도는 고체 밀도보다 작으므로 부피는 증가하고 양극 전류 밀도는 예정된 값보다 작아질 것이다. 그러므로 양극 전류 밀도 값을 보다 정확히 알기 위해서는 용해된 전해지지염의 전해조 내 부피를 실측할 필요가 있다. 본 연구에서 전해지지염의 총량은 2,485g이었으며 초기 혼합되는 Nd2O3 량은 용해도7) 이내가 되도록 NdF3와 LiF 총량의 1.5 wt%, 즉, 27.9g이었다.
전해지지염과 초기에 장입되는 원료 Nd2O3를 잘 혼합한 후 graphite 도가니에 장입할 수 있는 만큼 최대로 장입하고 가열로를 가열하였다. 전해조 내 온도가 상승하여 전해지지염의 융점에 이르면 지지염의 용해가 시작되고 전해조 내 전해지지염의 장입 높이가 감소한다. 부피 문제로 초기에 장입하지 못한 여분의 전해지지염을 추가로 장입하고 용해시켰다. 용해가 완료되고 온도가 재 상승하여 목표하는 전해온도에 도달하면 교류 전원을 차단하지 않은 채 직류 전원을 인가하여 전해를 시작하였다. 앞서 언급하였듯 전해 개시 후 교류 전원을 차단하지 않으면 전해 중 교류 에너지도 짧게나마 간헐적으로 공급될 가능성이 있다. 그 양상은 전해조의 보온성에 따라 다를 수 있으므로 전해 열평형 상태에서 검토를 위해서는 전해 중 조금이라도 인가되는 교류 에너지를 모니터링 할 별도의 장치가 필요하나 본 연구에서 사용된 전해 장치는 이를 갖추고 있지 못하였다. 다만, 전해 실험 중 간헐적 관찰에 의해서는 교류 에너지의 공급을 확인할 수 없었다. 더욱이 적어도 본 연구에서 주목하는 전해 초기 수 분간은 교류 에너지의 공급이 없었음은 육안으로 확인하였고 따라서 후술하는 열수지 계산에서 이를 배제할 수 있었다.
실험은 1030~1130℃의 범위에서 실시되었다. 즉, 음극에서 Nd금속을 액상으로 회수하기 위하여 Nd의 융점(1021℃) 이상이되 전해지지염의 증기압과 석출 금속의 재 용해6,8,9,10,11)를 고려하여 최고 1130℃를 초과하지 않도록 하였다. Fig. 2는 실험 온도 범위를 대표할 수 있는 서로 다른 3개의 실험 온도에서 실측된 전해 중의 염욕 온도 변화를 실험 조건과 함께 나타낸다. 실험에 대한 보다 상세한 내용과 전해 온도의 영향 등은 전보6)를 참고하기 바란다.
3. 결과 및 고찰
Fig. 2는 전해 시작 후 약 5분 이내에 염욕의 온도가 약 10℃ 상승하고 이후에는 거의 일정한 온도로 유지됨을 나타내고 있다. 전해 조건이나 전해시스템에 따라서 온도 상승 정도가 더욱 커질 수 있다. 이는 앞서 언급하였듯이 전해 온도, 즉 전류 효율에 큰 영향을 미친다.
Yin 등4)과 Wang 등5)은 열평형 상태에서의 계산을 통해 전해 시 에너지 투입량과 소모량의 차 가 모두 외부와의 열 출입, 즉, 외부로 손실되는 것으로 보고 전해조 측면, 상부, 액면, 하부 등으로 구분하여 계산함으로써 열 손실 관점에서 고찰하였으나 본 연구에서는 전해조 내 용융염의 초기 온도 변화와 외부로의 열 손실을 함께 고려하고자 한다. 또한 Wang 등5)은 양극에서의 발생 가스를 모두 CO라고 가정한 반면 Yin 등4)은 CO:CO2가 85:15로 발생 하는 것으로 가정하였다. 그러나 C, CO, CO2 간의 Boudouard Reaction(2CO=C+CO2)을 고려하면(980℃에서 ) 본 연구에서의 실험 온도인 1030℃ 이상에서는 CO2의 발생(<1%)이 무시 가능하며 거의 CO만 발생하는 것으로 가정해도 좋을 것이다.
용융염 전해 중의 열수지를 고려하기 위하여 다음과 같이 정의한다.
: 전해에 투입되는 직류 전기에너지
: 양극에서 발생하는 CO 가스의 생성에너지
: 전해 중 추가 장입된 Nd2O3의 가열에너지
: 전해 중 추가 장입된 Nd2O3의 분해에너지
: CO 가스 버블링에 의한 에너지 소모
여기서 i는 energy in, o는 energy out을 의미한다.
이때 아래의 식 (1)과 같이 쓸 수 있으며
energy in, energy out 차이인 가 전해조의 온도 변화와 전해시스템-외부 간의 열 출입에 관련된다는 것을 알 수 있다.
식 (1)을 단위 시간(한 시간)에 대해 고려하면,
여기서 는 한 시간 당 생성되는 CO 가스의 몰 수, 는 온도 T에서 CO 가스의 생성에너지12) ( cal/mol), 은 생성 가스의 가중평균 화학당량(=2), 는 Faraday 상수(96,487A·sec/mol)를 의미한다.
한편, 는 각각 다음과 같다.
위에서 는 한 시간 당 첨가된 Nd2O3의 몰 수, 는 온도 T에서 Nd2O3의 분해환원전위를 나타낸다.
Nd2O3와 CO의 값4)은 각각 아래의 식 (8)과 (9)를 이용하였다.
한편, 온도 T에서 Nd2O3의 분해환원전위 는 양극에서 CO 가스만 발생하는 것으로 가정했을 때 아래의 반응식 (10)으로부터 구할 수 있다.
즉,
식 (11)에서, 는 Nd2O3의 표준환원전위, 은 기체상수 8.314 J/mol·K, 는 절대온도 K, 은 반응에 참여한 전자 수 6, 는 Faraday 상수, 와 는 각 상의 활동도 및 분압을 의미한다. Fig. 2에 나타낸 실험들의 전해시작온도인 1303K, 1348K, 1392K에서 반응식 (10)의 값은 Factsage 8.0 FactPS 데이터베이스13)로부터 각각 729.9 kJ/mol, 706.5 kJ/mol, 683.6 kJ/mol이다. 따라서 아래의 식 (12)를 통해 표준환원전위 로 환산할 수 있으며 그 값들은 각각 -1.2607V, -1.2203V, -1.1809V이다.
또한 액상 Nd의 활동도는 1, CO 가스의 분압은 1, C의 활동도는 1로 가정하였으며 전해지지염에 용해된 Nd2O3의 활동도는 용융 불화물 내 Y2O3의 활동도를 제시한 선행 연구14)를 참고하여, 이상 용액을 가정했을 때인 4.178× 10-3과 1×10-9 사이의 값을 갖는다고 가정하였다.
식 (11)에 이상의 값들을 대입하면 1303K에서 Nd2O3의 분해환원전위 의 범위는 -1.363V부터 -1.649V까지 이며, 1348K에서는 -1.326V부터 -1.621V, 1392K에서는 -1.290V부터 -1.595V까지 이다. 이하 계산에서는 중간 값, 즉, 1303K에서는 -1.506V, 1348K에서는 -1.474V, 1392K에서는 -1.443V를 Nd2O3의 분해환원전위 의 값으로 사용하였다.
이제, 식 (1)에서의 를 상기 식 (2), (3), (4), (5), (6), (7), (8), (9), 식 (11), 전류 효율, 한 시간 당 첨가된 Nd2O3의 몰 수(), (실온), (전해시작온도), 인가 전류 및 전압 등 실험 데이터를 이용하여 하기 식 (13)으로부터 구할 수 있다.
아래 Table 1에 Fig. 2에 나타낸 실험들의 실제 데이터와 이 값들을 이용하여 위와 같이 계산한 각 실험에 대한 식 (13)의 결과를 정리하였다. 참고로 Table 1에는 계산 결과로서 값만 나타내었으나 계산 과정에서 순차적으로 얻어지는 식 (13)의 각각의 에너지 요소에 대한 값들도 알 수 있다.
이로부터 전해 초기에 염욕의 온도 상승분을 계산하고 실제와 비교해 볼 수 있다. 즉, Fig. 2에서 염욕의 온도가 상승한 시간을 초기 5분이라 가정하면, Table 1에서의 값(열 손실이 없을 경우 한 시간 동안 누적되는 열량)을 5분으로 환산하고 전해조 구성물들의 중량과 비열15)을 고려하면 염욕의 온도 상승분을 계산할 수 있다. 전해조 구성물들은 실험 차수에 관계없이 모두 동일하였고 각각의 비열은 전해시작온도의 값으로 가정하였다. Table 2에 전해조 구성물들의 중량과 비열을 나타내었고 Table 3에 결과를 나타내었다.
Table 3으로부터, 전해 초기 5분간 외부로의 열 손실이 없다고 가정했을 경우, 실험 A, B, C 각 염욕의 온도는 17.9℃, 18.0℃, 16.3℃ 상승할 것임을 알 수 있다. 그러나 실제로는 각각 11℃, 11℃, 10℃ 상승했을 뿐이므로, 각 실험에 대해 실제 온도 상승에 사용된 열량과 손실되는 열량을 구분 지을 수 있으며, 이 값들은 실험 A의 경우 각각 50.64kJ(61.5%), 31.76kJ(38.5%), B의 경우 49.97kJ(60.6%), 32.46kJ(39.4%), C의 경우 46.07kJ(61.3%), 29.12kJ(38.7%) 임을 알 수 있다.
Table 1.
The experimental data and the calculation results for the difference in heat balance (C.E.: current efficiency, E.S.T.: electrolysis start temperature)
Table 2.
The weights and the specific heats per mole of the constituents in the salt baths (G.C.: graphite crucible, T.C.: Tungsten Cathode, TC: thermocouple)
Table 3.
Comparison of measured and calculated values for the temperature increase at the early stage of electrolysis (E.S.T.: electrolysis start temperature)
| Exp. | (kJ/initial 5min.) |
E.S.T. (K) |
Calculated (K) |
Measured Temp. (K) (Mea. ) |
| A | 82.40 | 1303 | 17.9 | 1314 (11) |
| B | 82.43 | 1348 | 18.0 | 1359 (11) |
| C | 75.20 | 1392 | 16.3 | 1402 (10) |
4. 결 론
본 연구에서는 Nd 금속 제조를 위한 산화물 용융염 전해에 대한 저자들의 실험 데이터를 이용하여 전해 초기의 열수지에 대해 고찰하였다. 결론을 요약하면 다음과 같다. 용융염 전해 중의 열수지 계산에 의해 전해 초기 염욕의 온도 변화에 대한 계산치와 실측치의 비교를 통해 외부로의 열 손실과 염욕의 온도 상승을 정량적으로 평가할 수 있었다. 본 연구의 경우 염욕의 온도 상승기인 초기 5분 동안 열 출입 간 잉여 열의 61%는 온도 상승에 기여하였고 39%는 외부로 손실되었다. 이와 같은 방법을 통하면 열 손실 측면에서 전해시스템을 평가할 수 있고 이후 유사 공정에서의 전해온도 변화를 예측할 수 있다. 따라서 외부로의 열 손실 저감 방안을 도출하고 전해온도 제어를 통해 전류 효율을 제고시킴으로써 용융염 전해 채취 공정에서 가장 중요한 경제성 지표 중 하나인 에너지 원단위 저감에 기여할 수 있다.