1. 서 론
리튬이온배터리는 우수한 성능으로 인해 휴대전화 및 노트북과 같은 휴대용 장치의 발전과 함께 수요가 급증하고 있다1). 2010년 세계 리튬이온배터리의 생산량은 약 46억개에서 2012년에는 약 50억개로 증가했으며, 전기자동차 시장의 급속한 발전과 함께 2025년에는 136만톤의 폐리튬이온배터리가 발생할 것으로 예측된다2,3,4). 따라서 장래 발생할 대량의 폐리튬이온배터리를 처리하기 위해 경제적이고 효율적인 공정 개발이 필요하다5). 특히 리튬이온배터리에는 5~20% 코발트, 5~10% 니켈, 5~7% 리튬 등의 유가금속이 함유되어 있으므로 이를 효과적으로 회수하기 위해 현재 다양한 연구가 진행되고 있다6).
폐리튬이온배터리에서 유가금속을 회수하는 것은 코발트와 니켈을 함유한 원광이 전무한 국내의 경우 소재 확보측면에서도 바람직하다7). 그러나 폐리튬이온배터리는 리튬의 폭발 위험 및 배터리 내 중금속으로 인한 환경오염문제를 초래할 수 있어 처리에 많은 어려움이 따른다8). 최근 이러한 문제의 대안으로 Umicore공정이 주목받고 있다9). Umicore 공정은 건식과 습식단계로 구성되어 있으며, 건식단계에서 리튬을 슬라그로 분리하고, 코발트, 니켈, 구리와 같은 산화물은 금속으로 환원된다. 여기서 금속혼합물은 후속공정인 습식제련을 통해 분리정제한다10). 일반적으로 폐리튬이온배터리내 금속은 염산, 황산 및 질산과 같은 무기산에 침출시킨 다음 습식법인 용매추출, 침전 및 이온교환으로 분리한다11,12,13,14,15). 그러나 침출에서 금속의 회수율을 높이기 위해서는 과산화수소와 같은 산화제를 첨가하거나 고농도의 산을 필요로 한다16).
본 연구에서는 폐리튬이온배터리에 함유된 유가금속을 회수하기 위해 건식용융환원공정에서 얻은 금속혼합물을 침출하기에 앞서 코발트, 니켈 및 구리금속의 최적 침출조건에 대해 조사했다. 침출제로는 무기산과 유기산을 사용해 비교했으며, 산농도, 반응온도, 반응시간 및 광액농도를 조절해 각 금속의 침출거동에 미치는 영향을 조사했다. 구리금속의 경우 산화제를 첨가하지 않으면 침출되지 않으므로 니켈과 코발트의 중량비를 동일하게 섞은 금속혼합물의 침출거동을 조사했다. 염산과 황산용액에서 코발트와 니켈 모두 99%이상 침출이 가능했다. 반면 메탄술폰산으로 금속혼합물을 침출하면 코발트가 선택적으로 침출됐다.
2. 실험재료 및 실험방법
본 연구를 위해 니켈(Ni, size: 3-7 μm, Alfa Aesar, 99.9%), 코발트(Co, size < 44 μm, Alfa Aesar, 99.5%) 및 구리(Cu, granular, Junsei Chemical Co., 99.5%) 금속분말을 사용했다. 각 금속분말을 50 g/L의 광액농도조건에서 단독 침출시켜 각 금속의 침출거동을 먼저 조사했다. 이와 같이 각 금속을 단독으로 침출시 산화제가 없는 조건에서 구리가 전혀 침출되지 않는 것을 확인했다. 따라서 산화제가 없는 조건에서도 침출되는 코발트와 니켈을 동일한 중량으로 혼합하여 100 g/L의 광액농도에서 침출시켰다. 침출용액으로는 염산(Daejung chemicals & metals Co. Ltd., Korea., 35%), 황산(H2SO4, Daejung Co., >95%, Korea), 메탄술폰산(CH3SO3H, Daejung Co., >99.0%, Korea), 아세트산(CH3COOH, Samchun pure chemical. Co., >99.5%, Korea), 푸말산(C4H4O4, Daejung Co., >99.0%, Korea), 시트르산(C6H8O7, Daejung Co., >90.0%, Korea) 및 젖산(C3H6O3, Daejung Co., >99.0%, Korea)을 2차 증류수에 희석해 준비했다.
침출실험은 20 mL 침출용액이 담긴 100 mL 3구 비이커형 반응조를 디지털 가열식 자력 교반기(WiseStir MSH-20D, Daihan Scientific Co., Korea)에 올려놓고, 온도를 조절해 300 rpm으로 교반해 수행했다. 침출용액이 반응온도에 도달하면 일정량의 금속분말을 첨가한 다음 반응시간 동안 교반했다. 반응시간 뒤 침출용액은 여과지를 사용해 용액과 잔사로 분리했다. 용액내 금속의 농도는 ICP-OES(Arcos, Spectro, Germany)로 측정했으며, 금속의 침출률은 물질수지를 이용해 다음 식으로 구했다.
여기서 VM 과 CM 은 각각 침출용액에서 금속 이온의 부피와 농도이고, MO 는 침출 전 시료에서 금속의 질량이다.
3. 결과 및 고찰
3.1. 단일 금속의 침출거동
코발트, 니켈 및 구리의 침출거동을 조사하기 위해 각 금속분말을 무기산과 유기산을 사용해 단독으로 침출했다. 무기산으로는 염산과 황산, 유기산으로는 메탄술폰산, 아세트산, 푸말산, 시트르산 및 젖산을 사용했다. 각 산의 농도는 2 M, 반응온도 60°C, 반응시간 60분, 교반속도 300 rpm, 광액농도 50 g/L로 고정했고, 실험결과를 Table 1에 나타냈다. 본 논문의 실험조건에서 표준환원전위가 높은 구리는 전혀 침출되지 않았으며, 구리를 용해시키기 위해서는 산화제가 필요하다17). 또한 메탄술폰산을 제외한 유기산에서 금속의 침출률이 매우 낮으므로 추가실험을 수행하지 않았다.
Table 1.
Leaching percentage of each metal from several inorganic and organic acid solutions
| HCl | H2SO4 | CH3SO3H | CH3COOH | C3H6O3 | C4H4O4 | C6H8O7 | |
| Co | 85.94 | 78.1 | 55.04 | 5.04 | 12.3 | 15.77 | 13.11 |
| Ni | 100 | 70.77 | 42.05 | 4.2 | 3.67 | 9.12 | 4.01 |
| Cu | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
3.1.1. 산농도의 영향
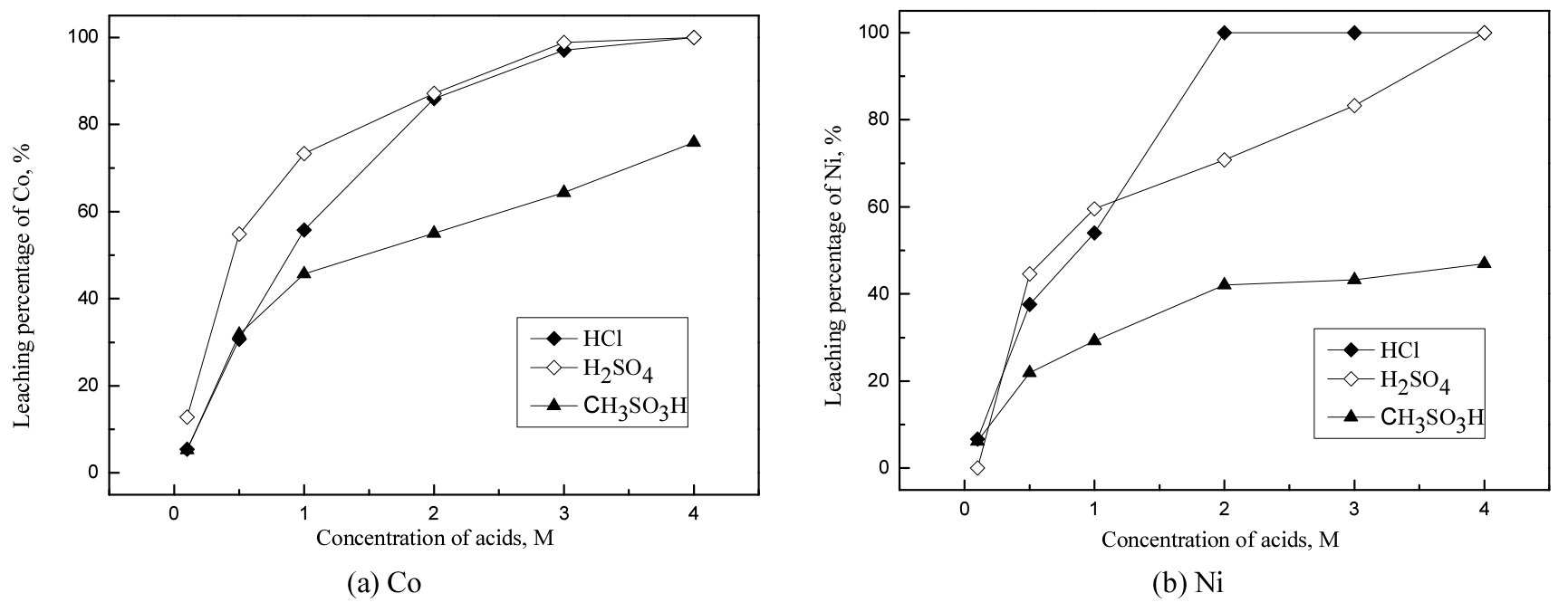
산농도가 금속의 침출률에 미치는 영향을 조사하기 위해 침출용액의 산농도를 0.1에서 4 M까지 변화시켰다. 이때 반응온도는 60°C, 반응시간 60분, 광액농도는 50 g/L로 고정했고, 결과를 Fig. 1에 나타냈다. 코발트와 니켈 모두 유기산보다 무기산에서 침출률이 높았고, 산농도가 증가함에 따라 침출률이 증가했다. 니켈은 2 M이상 염산에서 완전히 침출됐으며, 4 M의 무기산에서 니켈과 코발트가 모두 침출됐다. 따라서 무기산에서 두 금속을 침출하기 위해 최소 4 M이상의 농도가 요구된다. 반면 4 M 메탄술폰산에서 코발트와 니켈의 최대 침출률은 각각 75.8, 46.9%로 무기산과 비교해 낮았다. 염산, 황산 및 메탄술폰산의 pKa의 값은 각각 -6.3, -3.0, -1.9로 메탄술폰산에서 침출률이 염산과 황산보다 낮은 이유는 비교적 산성도가 작기 때문이다18).
3.1.2. 반응온도 및 반응시간의 영향
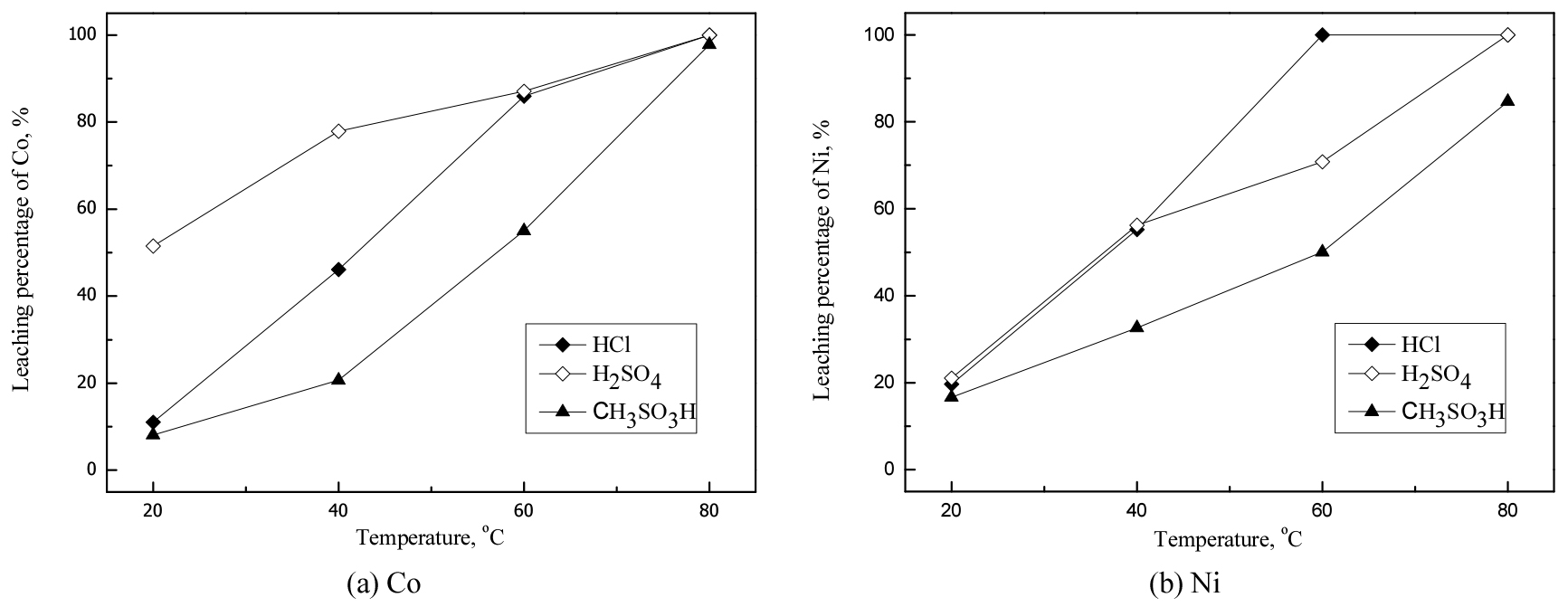
3.1.1절의 연구에 의하면 4 M이상 무기산에서 코발트와 니켈이 대부분 침출되므로 무기산 및 유기산에서 반응온도 및 반응시간의 영향을 알아보기 위해 모든 산농도는 2 M, 광액농도는 50 g/L로 고정했다. 이때 반응온도는 20~80°C까지, 반응시간은 10~180분까지 변화시켰고 실험결과를 Figs. 2와 3에 나타냈다.
반응온도가 증가함에 따라 모든 산에서 코발트와 니켈의 침출률은 증가했다. 80°C의 메탄술폰산에서 코발트와 니켈의 침출률이 97.8, 84.6%인 것을 제외하면 모든 산에서 코발트와 니켈이 99%이상 침출됐다. 따라서 금속의 침출률을 높이기 위해 반응온도를 80°C로 유지하는 것이 바람직하다. 무기산의 경우 코발트는 염산보다 황산에서 침출률이 높았고, 니켈은 염산에서 침출률이 더 높았다. 이는 진한 염산용액에서 코발트이온은 CoCl42-를 형성해 쉽게 침출되고, 니켈의 경우는 코발트에 비해 착물을 형성하려는 경향이 작기 때문이다17). 반면 메탄술폰산에서 두 금속의 침출률은 비슷했다.
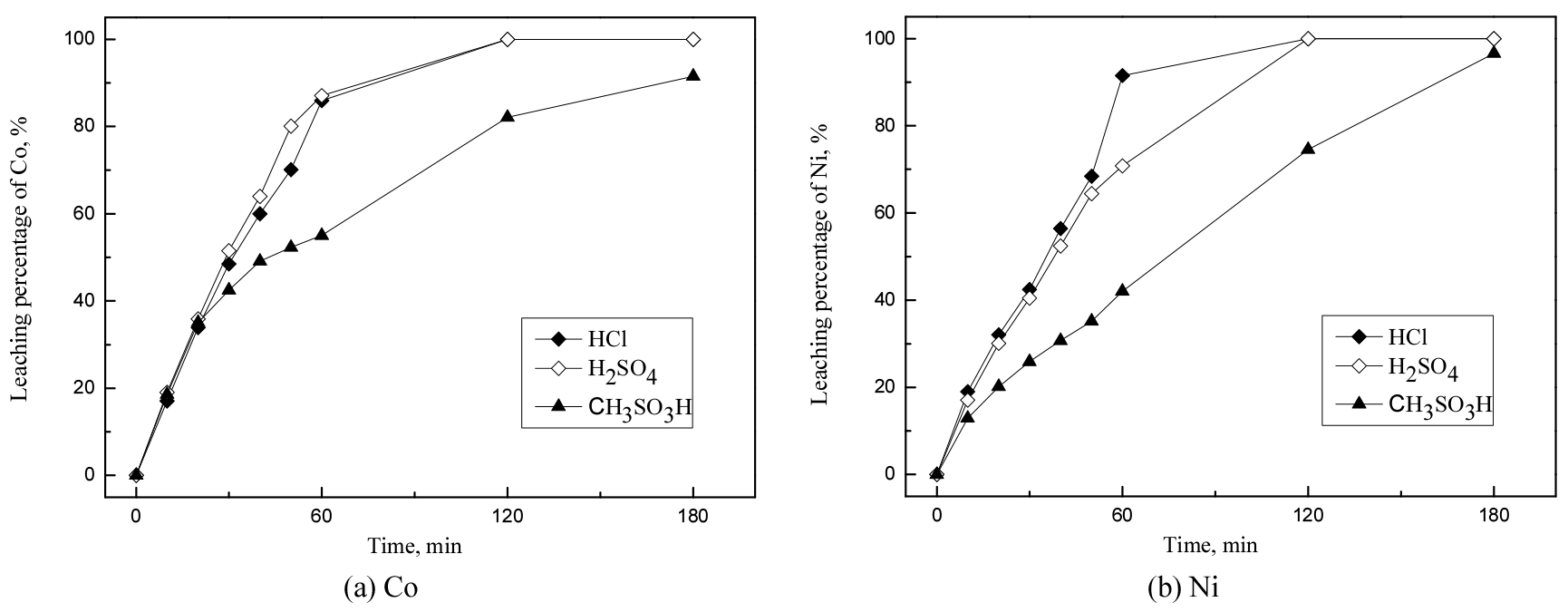
반응시간이 침출에 미치는 영향을 조사하기 위해 반응온도를 60°C로 고정했다. 반응시간 1시간까지 코발트와 니켈의 침출률은 급격히 증가했고, 2시간 이후 무기산에서 두 금속은 완전히 침출됐다. 따라서 무기산에서 두 금속을 침출하기 위해 최소 2시간 이상의 반응시간이 필요하므로 후속실험에서 광액농도의 영향을 조사하기 위해 반응시간을 1시간으로 고정했다. 반면 메탄술폰산의 경우 반응시간 3시간 이후에도 완전히 침출되지 않았으며, 이 때 코발트와 니켈의 최대 침출률은 각각 91.5%와 96.5%였다.
3.1.3. 광액농도의 영향
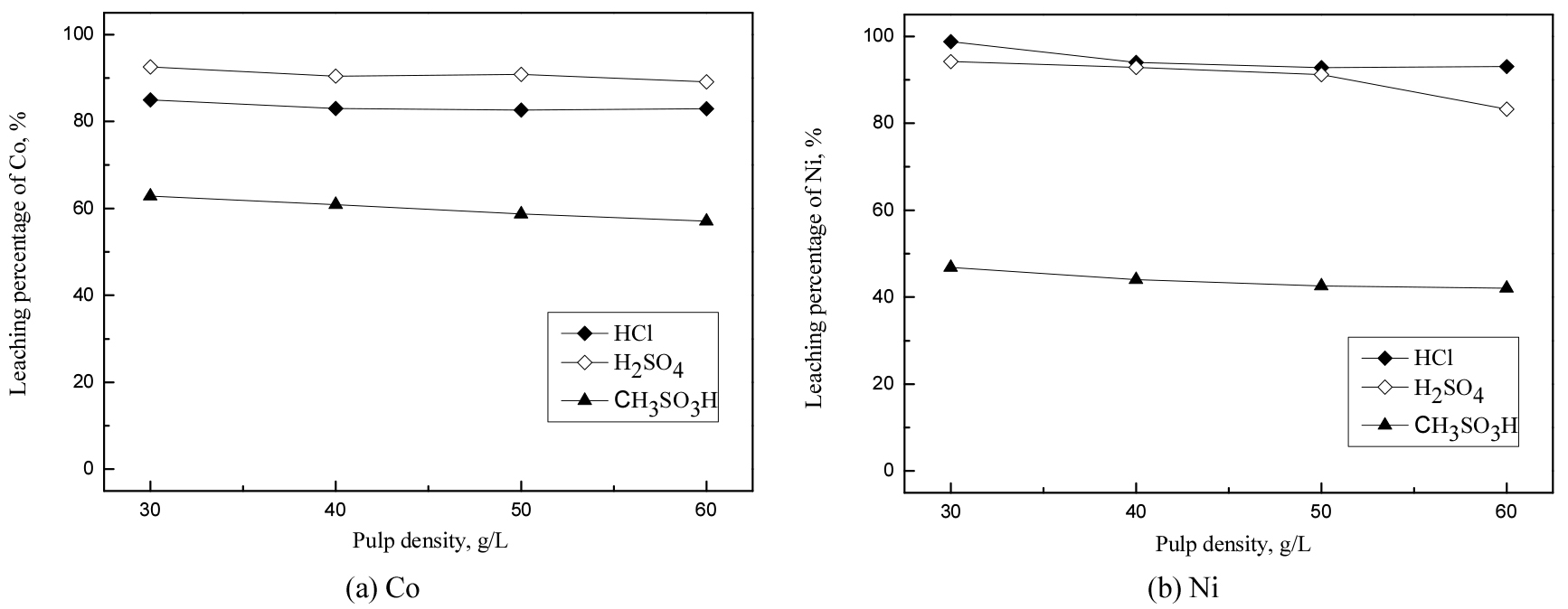
코발트와 니켈의 침출거동에 미치는 광액농도의 영향을 알아보기 위해 광액농도를 30에서 60 g/L까지 변화시켰다. 이 때 산농도는 2 M, 반응온도 60°C, 반응시간 1시간으로 고정했고, 실험결과를 Fig. 4에 나타냈다. 또한 염산, 황산, 및 메탄술폰산의 각 금속의 침출 반응은 식 (2)와 (3)에 나타냈다.
여기서 M은 각 금속, Mn+은 금속이온을 의미하고, A-는 Cl-, HSO4-, CH3SO3-과 같은 산의 음이온을 나타낸다.
광액농도가 증가함에 따라 코발트와 니켈의 침출률이 약간 감소했는데, 이는 식 (2)와 (3)에 나타낸 반응식의 화학량론에 따라 광액농도가 증가할수록 반응에 필요한 산의 양이 충분하지 않기 때문인 것으로 판단된다. 특히, 광액농도가 50 g/L를 초과하면 니켈의 침출률이 급격히 감소하므로 후속실험에서는 광액농도를 50 g/L로 고정했다.
3.2. 코발트와 니켈 금속혼합물에서 코발트의 선택적 침출
일반적으로 폐리튬이온배터리의 회수 공정은 플라스틱과 같은 비금속 불순물을 제거한 다음, 코발트, 니켈, 구리 산화물을 금속으로 용융환원시켜 습식법으로 각 금속을 분리한다19). 본 논문에서와 같이 산화제를 첨가하지 않는 조건에서 구리는 침출되지 않으므로, 구리를 제외한 코발트와 니켈 금속 분말을 동일한 중량으로 혼합해 금속혼합물을 준비했다. 금속혼합물을 이용한 실험에서 광액농도는 100 g/L로 고정했다.
3.2.1. 유기산과 무기산에서 침출 비교
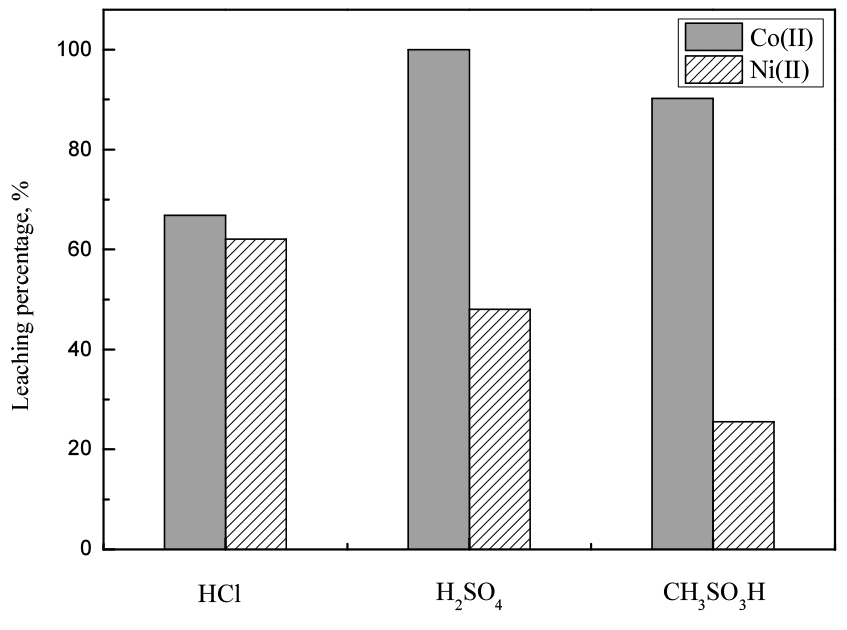
3.1.3절에서 얻어진 염산, 황산 및 메탄술폰산의 최적조건에서 금속혼합물의 침출거동을 비교했다. 무기산인 염산과 황산의 경우, 단일 금속으로 침출시 산농도 4 M, 반응온도 80°C, 반응시간 2시간, 50 g/L의 광액 농도 일 때 99%이상 코발트 및 니켈의 침출률을 얻었다. 이 조건에서 100 g/L 금속혼합물 침출시 염산과 황산에서 단독 침출과 동일하게 99% 이상 침출률을 얻었다.
상기 조건에서 무기산에 의해 코발트와 니켈은 대부분 침출되므로 산농도 및 반응온도를 낮춰 두 금속의 침출거동을 조사했다. 산농도는 2 M, 반응온도 60°C, 반응시간 2시간, 광액농도 100 g/L으로 고정했고, 결과를 Fig. 5에 나타냈다. 코발트의 침출률은 황산 > 메탄술폰산 > 염산의 순서로 높았고, 니켈의 경우 염산 > 황산 > 메탄술폰산의 순서로 높았다. 또한 본 논문의 실험조건에서 니켈의 침출률이 코발트에 비해 낮았다. 또한 황산과 메탄술폰산에서 코발트는 니켈보다 선택적으로 침출됐다. 특히, 메탄술폰산에서 코발트의 선택성이 우수했다. 따라서 메탄술폰산에서 두 금속의 분리성을 향상시키기 위해 추가실험을 수행했다.
3.2.2. 메탄술폰산에서 코발트의 선택적 침출에 영향을 미치는 요인
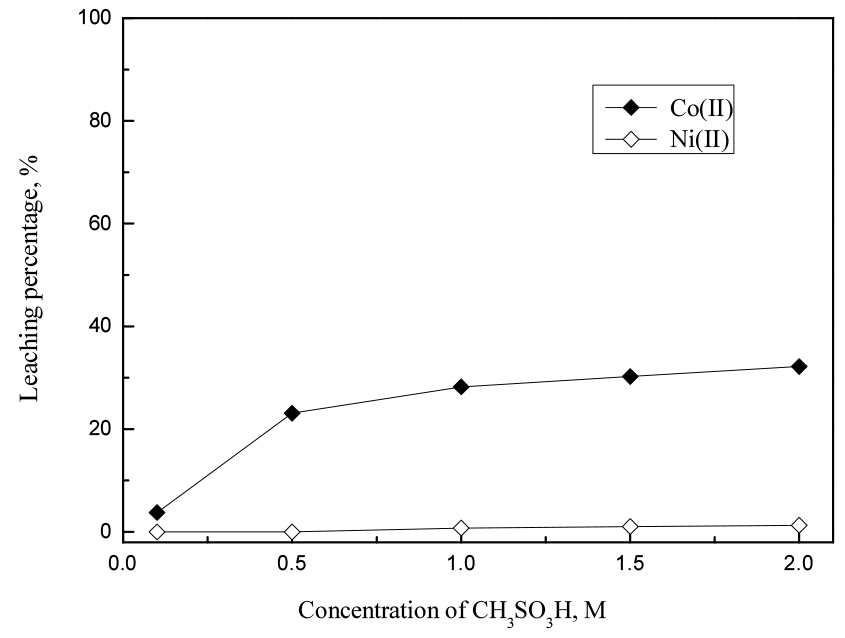
메탄술폰산에서 산농도, 반응온도, 반응시간 및 광액농도를 변화시켜 금속혼합물에서 두 금속의 분리거동을 조사했다. 광액농도의 영향에 대한 실험을 제외하고 모든 실험에서 광액농도를 100 g/L로 고정했다. 먼저 메탄술폰산의 농도를 0.1에서 2 M까지 변화시켜 산농도가 침출에 미치는 영향을 조사했다. 이 때 반응온도는 20°C, 반응시간은 2시간으로 고정했고, 결과를 Fig. 6에 나타냈다. 산농도가 증가함에 따라 두 금속의 침출률은 증가했으나 2 M의 메탄술폰산에서 코발트와 니켈의 침출률은 각각 32.1%와 1.28% 로 니켈은 거의 침출되지 않았다.
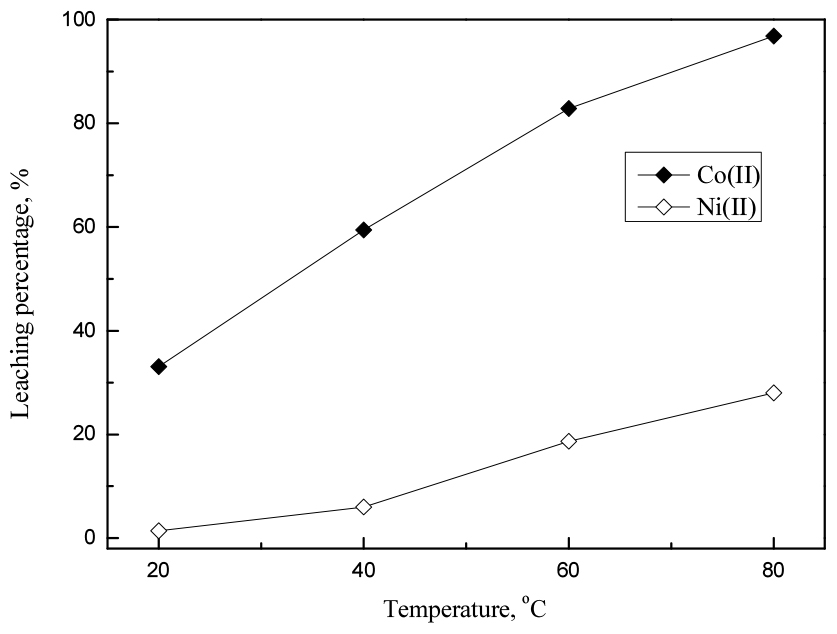
다음으로 온도가 침출에 미치는 영향을 조사하기 위해 반응온도를 20에서 80°C까지 변화시켰다. 이때 산농도는 2 M, 반응시간은 2시간으로 고정했으며 결과를 Fig. 7에 나타냈다. 실험결과 반응온도가 증가함에 따라 니켈의 추출률이 급격히 증가했다. 따라서 두 금속을 침출단계에서 분리하기 위해서는 온도를 낮게 유지하는 것이 유리하므로 후속 실험에서 반응온도를 20°C로 고정했다. 그런데 80°C에서 금속혼합물 침출시 니켈의 침출률은 28.0%로, 니켈금속을 단독으로 침출했을 때 84.6%인 것과 비교해 침출률이 현저히 낮았다. 이는 금속혼합물에서 코발트가 니켈에 비해 높은 선택적 침출거동을 보이기 때문이다. 일반적으로 표준환원전위 값이 클수록 환원이 잘 일어나고, 코발트와 니켈의 표준환원전위는 각각 -0.28, -0.25 V이다. 표준환원전위가 작은 코발트는 이종금속효과로 인해 니켈 보다 산화하려는 경향이 강해 비교적 침출률이 높다.
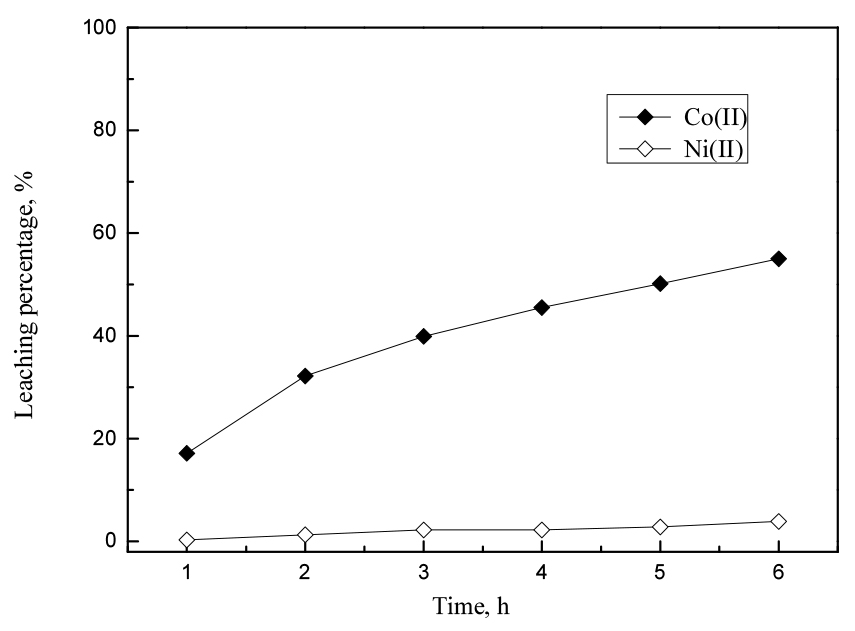
다음으로 반응시간이 침출에 미치는 영향을 조사하기 위해 시간을 1에서 6시간까지 변화시켰다. 이 때 메탄술폰산의 농도는 2 M, 반응온도는 20°C, 광액농도는 100 g/L로 고정했고, 실험결과를 Fig. 8에 나타냈다. 반응시간이 증가함에 따라 코발트의 침출률은 17.1에서 55.0%로 증가한 반면, 니켈의 침출률은 약간 증가해 6시간 이후 최대 3.92% 였다. 그러나 두 금속의 분리를 위해서는 니켈이 전혀 침출되지 않는 조건이 유리하므로 후속실험에서 반응시간은 니켈이 전혀 침출되지 않는 1시간으로 고정했다.
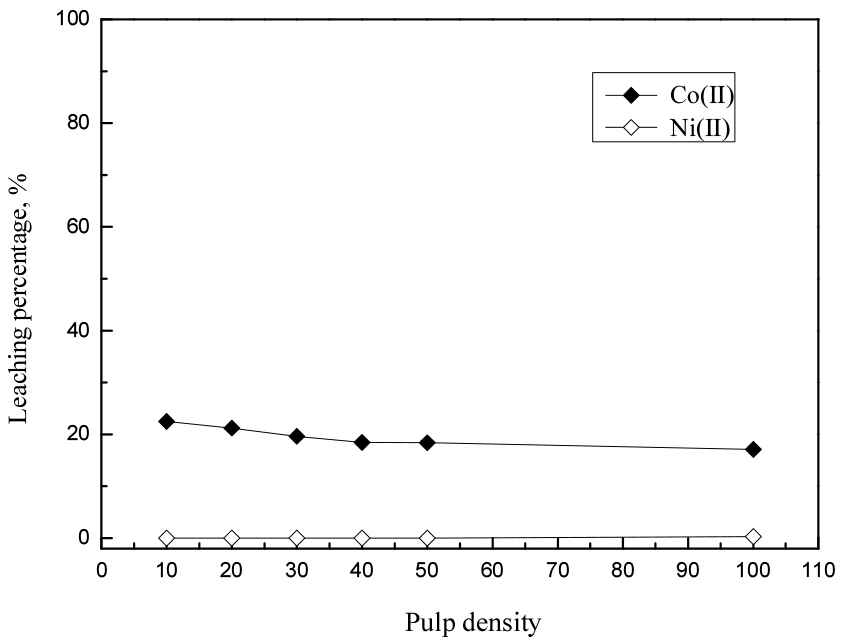
광액농도가 코발트와 니켈의 침출률에 미치는 영향을 알아보기 위해 광액농도를 10에서 100 g/L까지 변화시켰다. 이 때 산농도 2 M, 반응온도 20°C, 반응시간은 1시간으로 고정했고, 결과를 Fig. 9에 나타냈다. 광액농도가 증가함에 따라 코발트의 침출률이 감소했으며, 본 조건에서 니켈은 전혀 침출되지 않았다. 실험결과 산 농도 2 M, 반응온도 20°C, 반응시간 1시간, 광액농도 10 g/L에서 니켈이 전혀 침출되지 않으므로 코발트와 니켈의 분리가 가능하다. 그러나 니켈이 침출되지 않는 조건에서 코발트의 침출률이 22.5%로 여전히 낮으므로 코발트의 침출률을 향상시킬 필요가 있다. 일반적으로 산화제를 첨가하면 금속의 침출률이 증가하는데, 이전의 연구를 통해 H2O2를 첨가시 낮은 온도에서 니켈과 구리를 제외한 코발트의 침출률이 향상된다는 것을 확인했다20). 이는 구리의 표준환원전위가 +0.34 V로 코발트 및 니켈보다 높기 때문이다. 또한 니켈은 부동태 피막을 형성해 침출이 어려운데, H2O2첨가시 이러한 경향이 더욱 강화되기 때문이다21,22).
4. 결 론
폐리튬이온배터리를 용융환원시켜 얻을 수 있는 코발트, 니켈 및 구리 금속의 침출거동을 조사하기 위해 산화제를 첨가하지 않은 조건에서 침출실험을 수행했다. 산화제가 첨가되지 않은 무기산과 유기산용액에서 구리는 전혀 침출되지 않았다. 염산과 황산의 농도가 4 M이상의 조건에서 코발트와 니켈이 99%이상 침출됐다. 또한 단일금속의 최적 침출조건에서 코발트와 니켈의 금속혼합물 역시 염산과 황산에 99%이상 침출됐다. 따라서 니켈, 코발트 및 구리 금속의 혼합물을 염산과 황산으로 침출하면 니켈과 코발트만을 용해시키는 것이 가능하다. 반면 메탄술폰산으로 코발트와 니켈의 금속혼합물 침출시 코발트의 침출률이 니켈에 비해 높았으며, 반응온도가 낮을수록 코발트가 선택적으로 침출됐으나 침출률이 낮았다.