1. 서 론
2. 실험방법
3. 결과 및 고찰
3.1. CaO 함량 및 온도에 따른 CaO 배소 반응 결과
3.2. 바나듐 침출률에 미치는 CaO 함량 및 배소 온도의 영향
4. 결 론
1. 서 론
바나듐은 단단하고, 연성, 전성을 띈 전이금속으로 지구상에는 지각에 20번째로 많으며 약 65종 이상의 미네랄 형태로 분포되어 있다. 바나듐은 주로 철강 산업에 물리적 특성을 증가시키는 특성을 지녀 첨가제로 많이 사용되며 그밖에 합금용, 촉매재, 유리, 안료 등에 적용되고 있다. 또한 2~5가 까지 다양한 산화가로 존재하기 때문에 최근 다양한 신재생 에너지 산업에 적용이 가능한 바나듐레독스 흐름전지(Vanadium Redox Flow Batteries, VRFB)에 사용될 것으로 기대되고 있다1,2).
바나듐의 생산은 1900년대 초에는 Patronite (VS4), Carnotite (K2(UO2)2(VO4)2·3H2O), Vanadinite (Pb5(VO4)3Cl)등에서 생산이 되었으나 최근에는 Vanadium bearing titanomagnetite (VTM)과 중국의 Stone coal 등에서 주로 생산되고 있다3,4). 그 밖에 바나듐은 Fly ash, 석유 부산물(Petroleum residues), Vanadium bearing slag, 폐촉매 등의 2차 자원으로부터 회수하고 있다2,4).
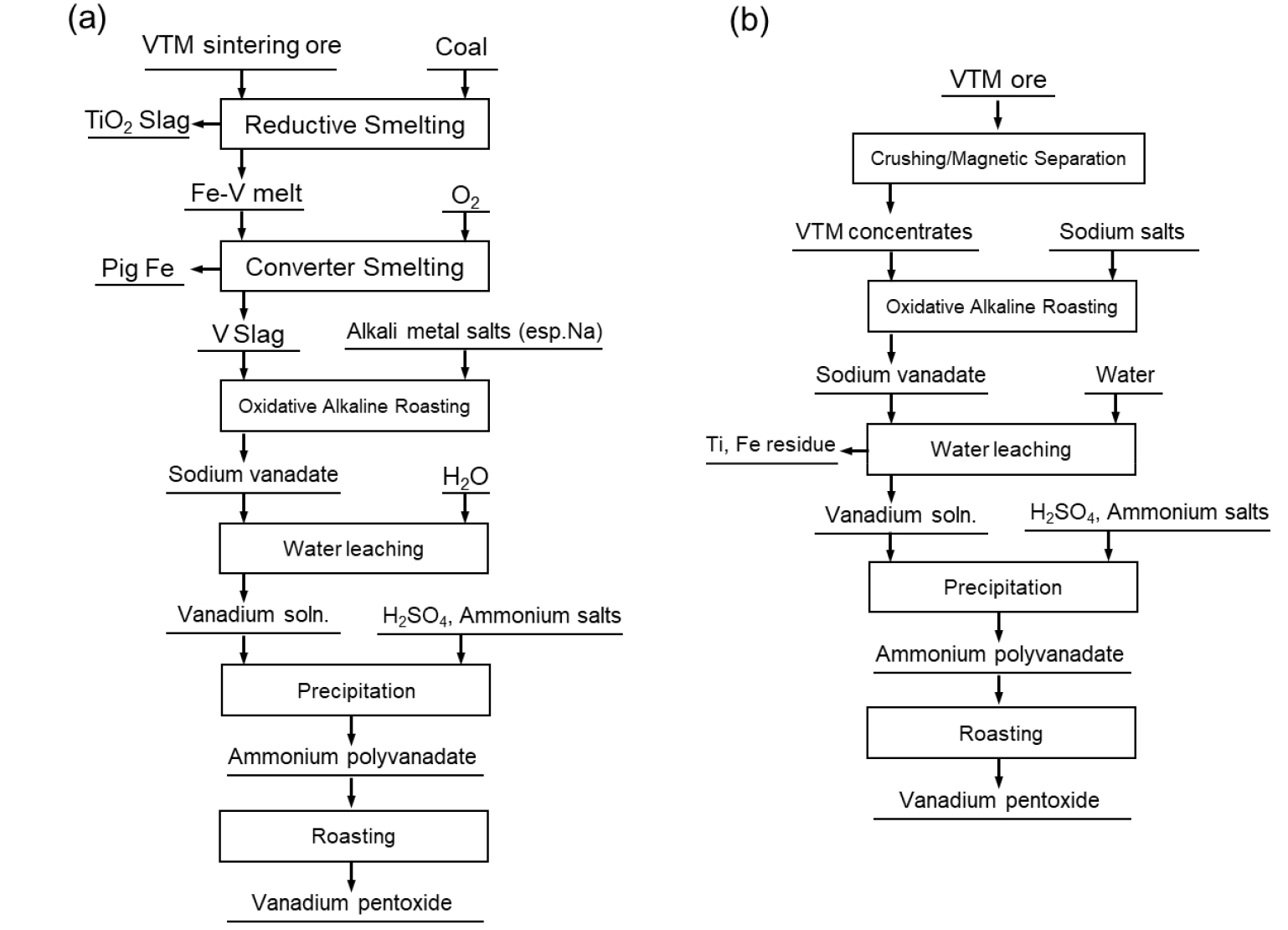
1차 자원인 함 바나듐 티탄자철광(Vanadium bearing titanomagnetite, VTM) 광물에는 V2O5 기준 2% 이하의 바나듐을 함유하고 있어 바나듐을 회수하는 공정은 철을 주생산품으로 생산하고 바나듐은 부산물로서 회수한다. 먼저 Fig. 1(a)를 살펴보면 공정별로 세부적인 조건들은 다르나, 일반적으로 VTM 광물 소결(Sintered VTM ore) → 용융환원(Vanadium bearing pig iron) → 제강공정(Vanadium rich slag) → 염배소(Soda roasted vanadium slag) → 침출(Vanadium solution) → 침전(Ammonium vanadate) → 고온산화처리(Vanadium pentoxide)의 공정을 따른다5,6). 반대로 VTM 광물에서 바나듐을 직접 회수하는 공정도 있는데 Fig. 1(b)에 나타내었듯이 대표적으로 브라질의 Maracas Menchen Mine이나 남아프리카공화국의 Bushveld Minerals에서는 VTM 광물 파/분쇄(Crushed VTM ore) → 자력선별(VTM concentrates) → 염배소(Soda roasted vanadium concentrate) → 침출(Vanadium solution) → 침전(Ammonium vanadate) → 고온산화처리(Vanadium pentoxide)의 공정을 통해 바나듐을 회수한다7,8). 이들 공정들은 대부분 염배소 공정(Soda roasting process)에서 소듐(Na) 계열의 염을 사용하며, 대표적으로 Na2CO3, Na2SO4와 NaCl 이다. 이러한 염들의 사용은 Cl2, SO2, HCl과 같은 유해성 가스를 발생시킬 뿐만 아니라 배소 반응 중 광석의 Si과 반응하여 점성이 높은 Sodium silicate를 형성하여 로(Furnace) 내에 쌓여 조업 효율을 떨어뜨리는 문제를 가지고 있다7,8,9,10). 이에 몇몇 연구에서는 소듐 계열이 아닌 칼슘 계열의 염을 사용하여 배소를 진행하나 이 역시 바나듐의 회수율 및 순도가 떨어지는 문제점을 가지고 있으며, 대부분 바나듐 계열 슬래그나 Stone coal 내의 바나듐을 회수하기 위해 적용하지 VTM으로부터 적용하고 있지 않는다11,12,13,14,15).
따라서 본 연구에서는 국내산 VTM 광물로부터 칼슘 계열의 염을 사용하여 배소를 진행하고 산침출을 통해 바나듐 침출 거동을 고찰하는 연구를 진행하였다.
2. 실험방법
본 연구에서 사용한 VTM 광물은 국내 포천 지역의 관인광산에서 제공받아 선광 공정을 통해 얻은 바나듐 정광이다. VTM 광물은 광물학적인 특성상 자철석(Magnetite, Fe3O4)의 3가 철(Ferric ion, Fe3+) 격자에 3가 바나듐(Trivalent vanadium ion, V3+)과 치환되어 존재하여16,17) 선광공정에서 바나듐을 농축하기 위해 파분쇄 후 자력선별을 통해 이루어졌다. VTM 원광과 선광공정 후 얻은 VTM 정광의 화학적 조성 및 품위를 Table 1에 나타내었다. 칼슘 배소에 사용한 칼슘염은 CaO로 시약급 탄산칼슘(CaCO3, Junsei)를 Air 분위기, 1000°C에서 6시간 반응하여 제조하였으며 제조된 CaO는 진공 데시게이터에 보관하여 대기 중 수분 및 CO2와의 반응을 차단하였다.
Table 1.
The chemical composition in sample from domestic VTM ore and concentrates
| Materials | Chemical composition (wt.%) | |||||||
| TiO2 | Fe2O3 | SiO2 | Al2O3 | CaO | MgO | MnO | V2O5 | |
| VTM ore | 18.5 | 64.2 | 6.4 | 4.9 | 0.9 | 4.4 | 0.4 | 0.6 |
| VTM concentrates | 13.8 | 70.9 | 4.8 | 4.8 | 0.8 | 3.6 | 0.3 | 0.8 |
배소 실험은 VTM 정광과 CaO를 일정 비율로 혼합하여 혼합시료 내 CaO의 함량을 10, 20, 30 wt.%로 고정하였다. 각 시료는 막자사발에 갈아서 혼합한 후 알루미나 도가니에 넣어 Air 분위기(산화 분위기)에서 Muffle furnace에서 반응하였다. 반응 온도는 900 ~ 1300°C이며 반응 시간은 12시간 이다.
배소 후 산물은 파분쇄 후 XRD (X-ray Difrraction, D/ Max-2200, Rigaku) 분석을 실시하여 상(Phase) 변화를 살펴보았으며, 1M (mol/L) 황산(H2SO4, Samchun), 50°C, 고액비 10% (5 g/50 ml), 교반속도 300 rpm에서 6시간 침출 반응을 진행하였다. 침출 후 고액분리 한 다음 침출액과 잔사는 ICP (Inductively coupled plasma, Optima 7300, PerkinElmer)를 이용하여 분석하여 바나듐의 침출률을 도출하였다. 이때 잔사는 왕수에 녹지 않으므로 드라이오븐에서 건조 후 Lithium tetraborate (Li2B4O7, Junsei)를 혼합하여 관상로에서 Alkali fusion을 실시하였고 이 산물을 왕수(Aqua regia)에 용해하여 분석하였다.
3. 결과 및 고찰
3.1. CaO 함량 및 온도에 따른 CaO 배소 반응 결과
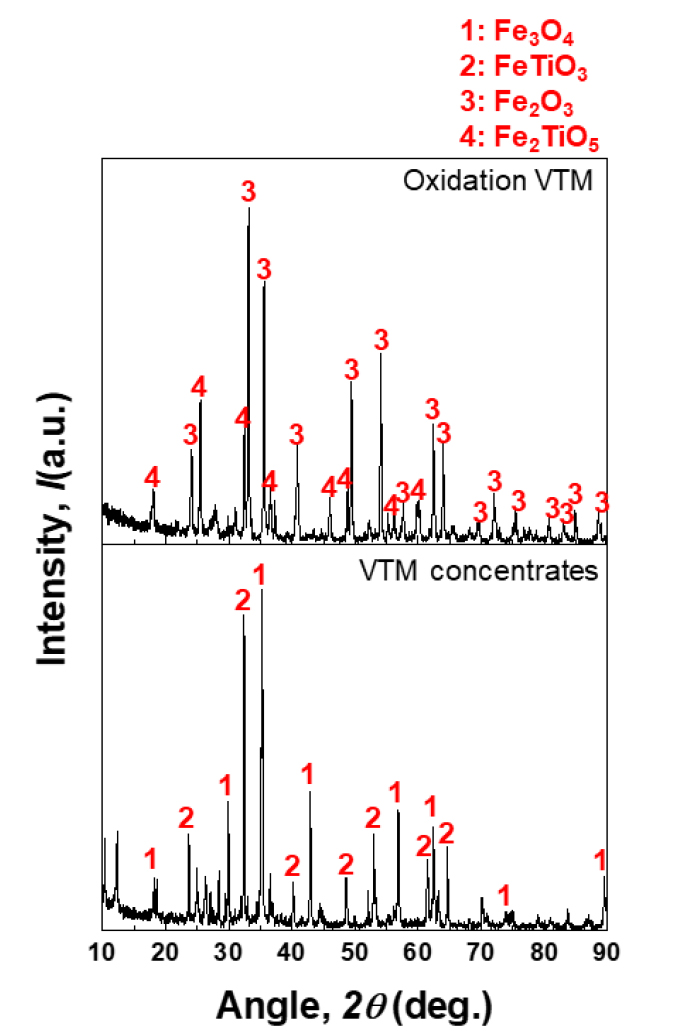
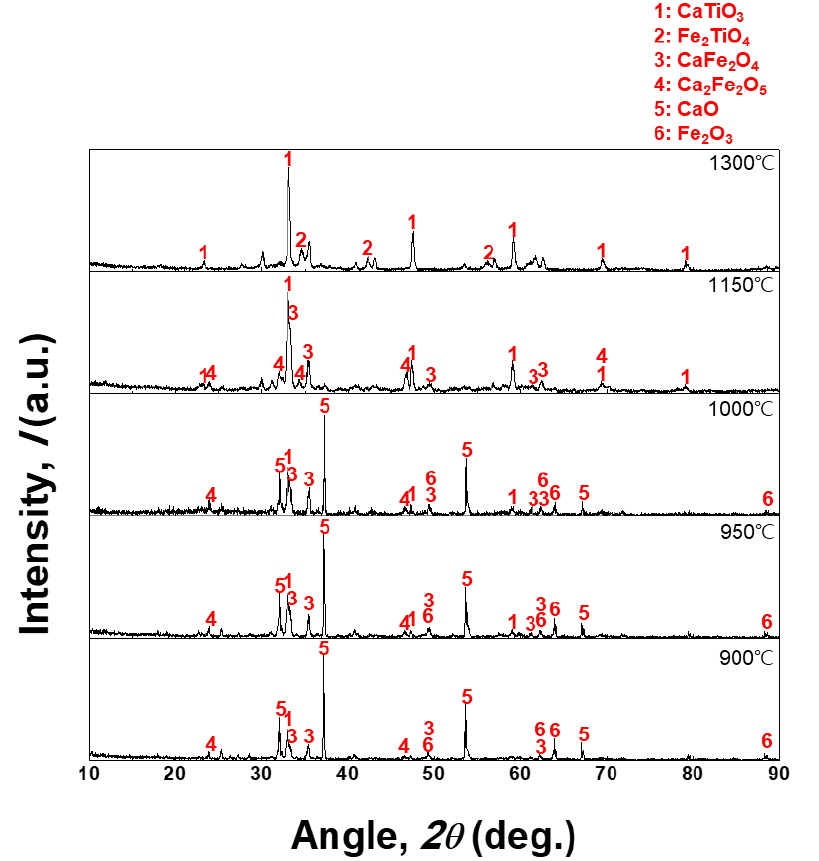
먼저 시료로 사용한 VTM 정광과 이 정광을 CaO 첨가 없이 1150°C에서 12시간 산화배소 한 시료의 XRD 결과를 Fig. 2에 나타내었다. CaO 첨가 없이 1150°C에서 산화배소만 진행한 것은 3.2 절에서 기술할 침출 시 CaO 첨가의 영향을 살펴보기 위함이다. VTM 정광은 Ilmenite (FeTiO3)와 Magnetite (Fe3O4)로 이루어져 있고 산화배소한 시료는 Ilmenite와 Magnetite가 각각 산화된 상인 Pseudobrookite (Fe2TiO5)와 Hematite (Fe2O3)로 이루어져 있다18,19). 앞서 실험 방법에 기술하였듯 이 VTM 정광에 일정량의 CaO를 혼합한 후 CaO 배소를 진행하였으며 CaO의 함량 및 배소 온도에 따른 XRD 결과를 Figs. 3 (10 wt.% CaO), 4 (20 wt.% CaO), 5 (30 wt.% CaO)에 나타내었다.
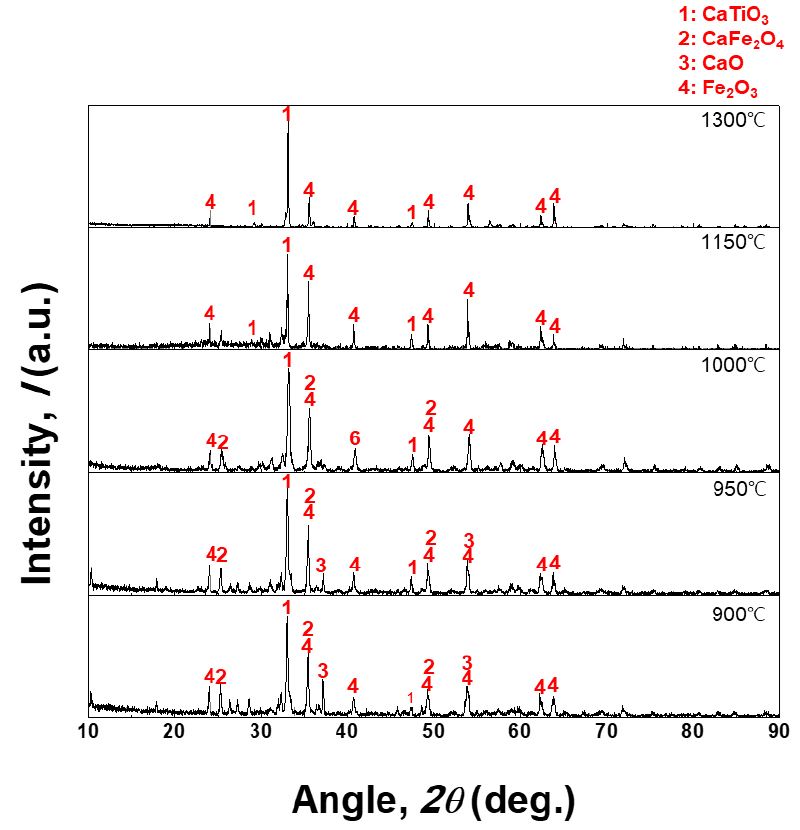
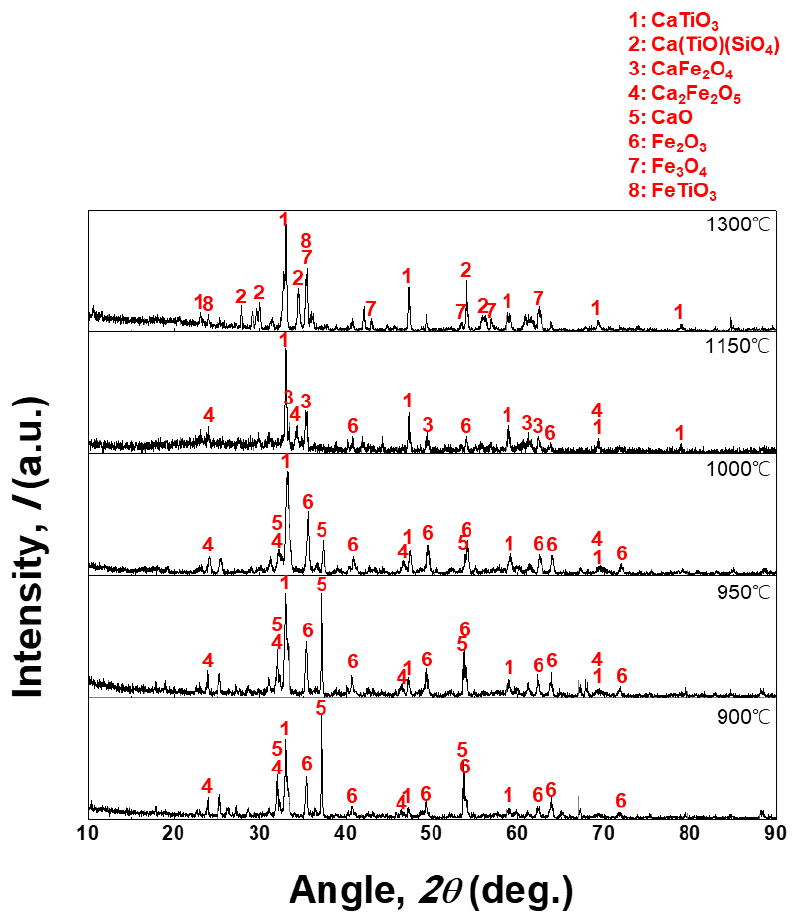
먼저 온도와 CaO의 함량과 관계없이 모든 XRD 결과에서 Perovskite (CaTiO3)가 관찰이 되었다. CaTiO3는 CaO- Fe2O3 (or FeO)-TiO2 3원계 상태도에서 조성에 따라 매우 넓은 안정상으로 존재한다20,21). CaO-TiO2가 존재할 시 CaTiO3의 상의 발현을 제한할 수 있는 조건은 매우 제어하기 어려우며 혼합물의 TiO2의 조성을 3 wt.% 이하로 제어하여 반응 시 TiO2의 활동도를 감소하여야 한다20).
CaO의 함량이 높을수록, Calcium ferrite (CaFe2O4 or Ca2Fe2O5, 이하 CaFeOx)의 상이 잘 발현되는 것을살펴볼 수 있는데 이는 CaO가 TiO2과 먼저 반응하여 안정상이 CaTiO3를 형성한 후 남은 잔류 CaO가 Fe2O3와 반응할 수 있기 때문이다. XRD 결과에서는 원료 내 바나듐의 함량이 산화물 기준으로 0.8 wt.%로 매우 낮기 때문에 Calcium vanadate (CaVOx) 상이 직접 관찰되지 않았다. 따라서 상대적으로 CaFeOx 상이 발현된 배소 결과물에서 CaVOx 상이 상대적으로 잘 형성이 되었다고 단언하기 어렵다.
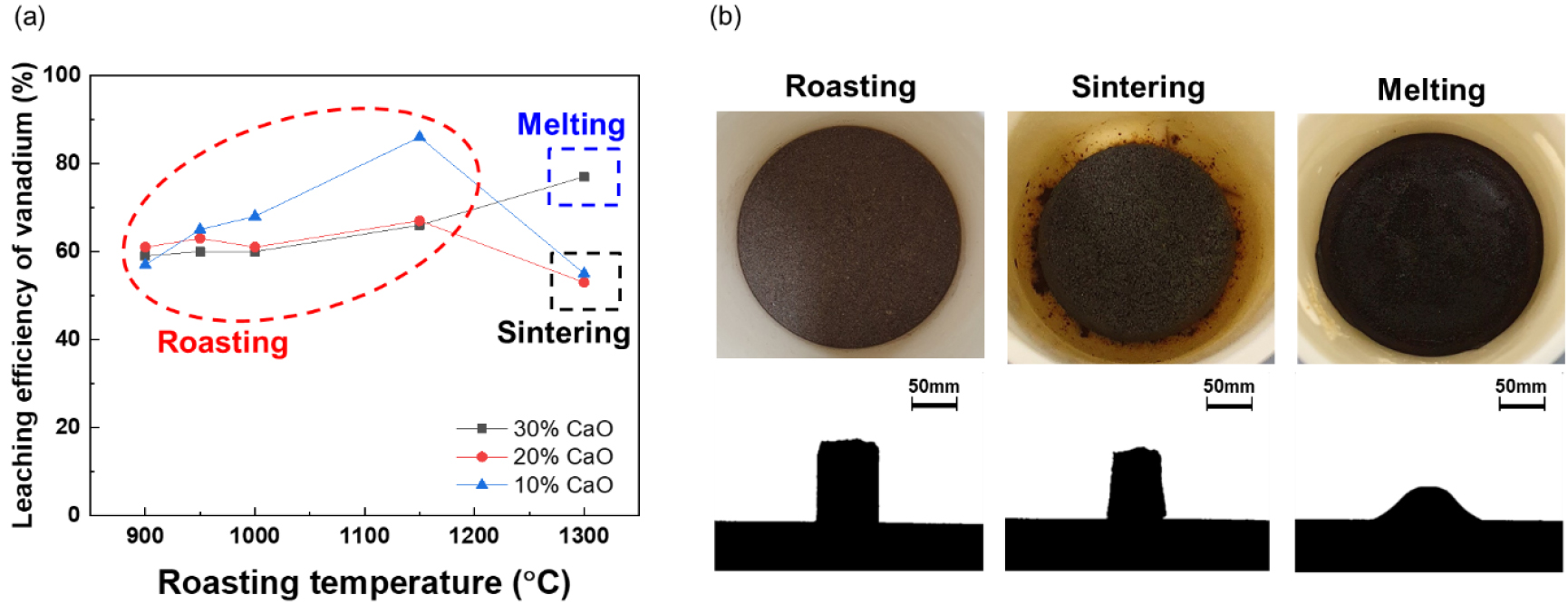
배소 온도의 영향은 상의 형성 뿐만 아니라 산물의 형태에도 큰 영향을 미친다. 특히 1300°C에서 CaO 배소 반응을 실시할 경우에 30 wt.% CaO 첨가에서 용융이 되어 슬래그가 형성되었으며 20 wt.%와 10 wt.% CaO 첨가에서는 소결 현상이 발생하여 겉표면에 일부 시료가 용융되어 매우 딱딱하게 굳어져 있었다11). 나머지 온도 실험에서는 모두 배소가 되었다. 이는 바나듐의 침출률에도 영향을 미칠 뿐만 아니라 침출 시료를 준비하기 위한 파/분쇄 공정에도 영향을 미칠 수 있다. 용융과 소결이 발생되면 침출 실험을 위해 산물의 파/분쇄를 위해 높은 기계적 에너지를 소모하게 된다. 반면 배소된 나머지 시료들은 손으로도 쉽게 으스러지며, 침출 시료 제조를 위해 높은 기계적 에너지를 요하지 않는다.
하지만 침출 시료의 용이한 확보를 위해 배소온도를 너무 낮추게 되면 XRD 결과에서 보듯이 미 반응한 CaO의 peak들을 관찰할 수 있다. 이들은 침출 공정에서 쉽게 석고(Gypsum, CaSO4)를 형성하여 여과 등에 영향을 미칠 수 있으니 잔류 CaO를 형성하지 않는 1000°C 이상의 배소 온도가 필요할 것으로 사료된다.
3.2. 바나듐 침출률에 미치는 CaO 함량 및 배소 온도의 영향
우선 배소 온도 및 CaO 함량에 따른 바나듐의 침출 결과를 Fig. 6(a)에 나타내었다. 배소 온도 및 CaO 함량에 따라서 배소 산물의 형태가 크게 배소(Roasting), 소결(Sintering), 용융(Melting) 3가지로 나누어지는데 각각의 실험 후 모습과 Heating microscope로 관찰한 형태를 Fig. 6(b)에 나타내었다.
Fig. 6(a)를 살펴보면 바나듐의 침출률은 1150°C 배소 온도 까지는 배소 온도에 따라 침출률이 증가하는 경향을 보이나 1300°C 배소 실험에서는 시료의 형태에 영향을 받음을 알 수 있다. 즉, 소결이 이루어진 결과(온도: 1300°C, CaO 함량 10, 20 wt.%)에서 바나듐의 침출률이 감소한다. 바나듐은 배소반응에서 원료인 정광 내 V3+를 V5+로 산화하여 침출률을 증가시켜야 한다15). 하지만 소결이 발생하게 되면 혼합물의 겉 표면에서 일부 산화물들이 우선 반응하여 부분적인 용융점을 형성하게 되고 이러한 부분들이 표면을 덮어버리게 된다. 이는 혼합물의 용융온도(Melting point)가 반응 온도보다 높아 용융이 되지 않으며 단지 혼합물 표면을 덮어버린 일부 용융된 부분들이 시료 내부로 산소의 확산을 차단하게 되어 V3+의 V5+의 산화를 억제하게 된다13,14). 이로 인해 바나듐의 침출률이 소결 시료에서는 감소한게 된다. XRD 결과에서도 산화배소 임에도 불구하고 소결된 시료에서 산화가 덜 이루어진 Fe3O4와 FeTiO3 peak가 일부 관찰됨을 알 수 있다. 시료가 용융이 이루어진 경우(반응온도: 1300°C, CaO 함량 30 wt.%), 바나듐의 침출률이 77%로 상대적으로 높아지는데, 이는 용융된 상태, 즉 액상일 경우 산소의 확산이 용이해짐에 따라 바나듐의 산화가 충분히 일어나기 때문이다. 나머지 1150°C 이하의 반응에서 얻어진 배소 형태의 산물은 표면 용융이 발생하지 않기 때문에 혼합물 내부로의 산소의 확산 및 5가 바나듐으로의 산화가 상대적으로 용이하여 침출률이 증가한다.
동일한 CaO 함량과 배소 형태를 지닌 실험에서는 고온반응 온도가 떨어질수록 바나듐의 침출률이 감소하는데, 이는 1000°C 배소 이하에서는 미반응한 CaO에 의해 바나듐이 일부 산화철 격자에 존재하기 때문으로 사료된다.
최적의 바나듐 침출을 위한 배소 조건을 설정하기 위해서는 높은 바나듐의 침출률도 중요하나 다른 불순물들의 침출을 최대한 억제할 필요가 있다. VTM 정광 내에는 바나듐의 함량보다 철, 타이타늄 등의 함량이 매우 높기 때문에 정제공정에서 고순도의 바나듐 용액 및 화합물을 획득하기 위해 제련공정에서 이들 불순물들을 제어하는 것은 매우 중요하다.
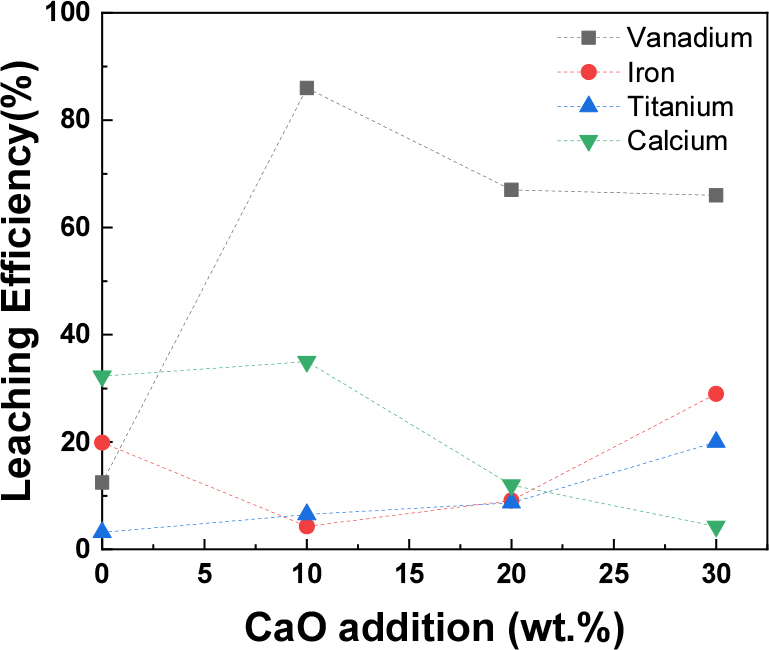
Fig. 6(a)에서 나타내었던 바나듐의 침출률이 가장 높은 1150°C 배소 반응에 대해 CaO 첨가에 따른 철, 타이타늄, 칼슘, 바나듐 의 침출률을 Fig. 7에 나타내었다. 철의 침출률은 철이 어떤 산화물 형태로 존재하는지가 침출률에 영향을 미치고 있다. Figs. 3, 4, 5의 XRD 결과와 Fig. 7의 침출률을 비교하면 철은 CaO의 함량이 높아질수록 침출률이 높아진다. 이는 CaO이 TiO2와 반응 후 남은 잔류 CaO에 의하여 철이 CaFeOx로 전환되었기 때문이다. 반면 CaO의 함량이 적어지면 일부 CaFeOx로 전환이 되나 대부분 Fe2O3로만 산화가 된다. 이때 철의 침출률이 감소하게 되는데, 이는 CaFeOx가 Fe2O3보다 침출 조건에서 황산에 열역학적으로 더 안정적으로 반응하기 때문이다. 이를 살펴보기 위해 50°C의 황산 침출 반응의 깁스 자유 에너지(Gibbs free energy for reaction)를 HSC 소프트웨어로 계산한 결과를 Table 2에 나타내었다22).
Table 2.
The value of Gibbs free energy at 50°C for leaching reactions22)
타이타늄의 경우 VTM 정광 내 FeTiO3와 산화배소하였을 때 배소광의 Fe2TiO5가 산 침출이 어려워 침출률이 매우 낮으나 Table 2에서 보듯이 정광을 CaO 배소를 진행하여 생성된 CaTiO3는 침출조건에서 황산에 열역학적으로 더 안정적으로 반응을 한다.
바나듐의 침출률은 CaO의 함량이 증가할수록 감소한다. Stone coal을 CaO 배소한 연구에서는 Stone coal 내 SiO2의 함량이 높아 CaO 첨가량을 늘릴 경우 CaO·SiO2 (Calcium silicate)가 형성되어 바나듐을 격자속에 가두게 되는 Vanadium wrapping 현상에 의해 바나듐의 침출률이 감소된다고 보고하고 있으나14), 본 실험에서 사용한 VTM 광물 내 SiO2의 함량이 매우 낮아 CaO·SiO2에 의한 Vanadium wrapping 현상의 영향은 미비할 것으로 사료된다.
바나듐의 침출률이 CaO의 양을 증가함에 따라 뚜렷한 효과를 가져오지 않기 때문에 철, 타이타늄의 침출률이 높아지고 원료 내 바나듐을 희석시키는 효과를 가져오는 배소 조건인 CaO의 첨가량을 늘리면 안된다. 다만 Fig. 2의 XRD 결과와 Fig. 7의 침출률 결과에서 나타내었듯이 CaO을 첨가하지 않고 산화배소만 진행하였을 경우 산화철 격자 내의 바나듐이 충분히 산화가 이루어지지 않고 Fe2O3의 낮은 철 침출률에 따라 바나듐 침출률 역시 낮아지는 것으로 볼 때 CaO 첨가는 VTM 내 바나듐의 산화 및 침출률에 영향을 미치는 것을 알 수 있다.
최종적으로 바나듐은 1150°C, CaO 10 wt.% 함량 조건에서 86% 침출이 된 반면, 철과 타이타늄은 각각 4.3%, 6.5% 침출이 되었다.
4. 결 론
본 연구에서는 국내산 함바나듐 티탄자철광을 활용하여 친환경적 공정으로 알려진 CaO 염배소 및 황산 침출을 통해 바나듐을 회수하였다. CaO의 첨가량과 배소 온도에 따른 함바나듐 티탄자철광의 상변환 및 바나듐, 철, 타이타늄 침출에 미치는 영향을 살펴보았다. CaO 함량 및 배소 온도에 관계없이 CaTiO3는 매우 안정상으로 모든 조건에서 형성이 된다. CaFe2O4, Ca2Fe2O5등의 CaFeOx는 CaO 함량이 높을 때 잘 형성이 되며, CaO 함량이 낮을때는 Fe2O3로 산화가 되었다. 특히 배소 온도가 1300°C에서는 10 wt.%, 20 wt.% CaO 첨가에서는 소결현상이 발생하였고, 30 wt.% CaO 첨가에서는 용융현상이 발생하였다. 1M 황산, 50°C, 고액비 10%, 6시간 침출에서 바나듐은 배소온도가 높아질수록 높았으나 소결이 발생한 조건에서는 소결 특성상 시료 내부의 바나듐이 충분히 산화되지 못해 바나듐의 침출률이 감소하였다. CaO 함량이 낮을수록 바나듐 침출률이 높고 철과 타이타늄의 침출률이 낮아졌으며 이는 CaFeOx와 CaTiO3가 각각 Fe2O3, Fe2TiO5 보다 침출 반응의 깁스 자유 에너지가 더 낮기 때문이다. 최종적으로 1150°C, 10 wt.% CaO 염배소 산물을 침출한 결과 86%의 높은 바나듐 침출률과 4.3%의 철과 6.5%의 타이타늄의 침출률을 얻을 수 있었다.