1. 서 론
2. 실험장치 및 방법
3. 결과 및 고찰
3.1. 황산 첨가에 의한 소듐바나데이트 수용액 거동 고찰
3.2. 바나듐 함유 수침출 수용액으로부터 암모늄메타바나데이트 회수공정 고찰
4. 결 론
1. 서 론
바나듐은 바나듐광 염배소, 수침출 그리고 암모늄바나데이트 침전 과정을 통하여 얻어지는데, 특히 바나듐의 회수과정인 암모늄바나데이트 침전과정은 바나듐의 회수율과 순도를 결정짓는 중요한 공정으로 간주된다1,2,3). 회수단계인 침전과정을 통하여 얻어지는 암모늄바나데이트(NH4VO3)는 바나듐을 추출하는 화학공정에서 중요한 중간체이며, 촉매나 안료 같은 바나듐 물질 제조에서 중요한 역할을 한다4,5). 본 연구진에 의한 이전의 연구결과에 의하면6), 바나듐 함유 수용액은 pH 9 정도 부근에서는 결정구조가 (NH4VO3)인 암모늄메타바나데이트, 그리고 바나듐 함유 수용액의 pH를 황산으로 조절하여 수용액 pH 6 이하에서 침전시키면 결정구조가 ((NH4)2V6O16)인 암모늄폴리바나데이트가 침전되는 것을 알 수 있었다. 특히 암모늄메타바나데이트 침전반응은 발열반응, 자발적 반응으로서, 온도를 증가시킨 등온반응에서 침전속도가 증가하는 전형적인 반응의 특성을 보여주고 있다7). 그리고 수용액의 온도 및 pH 변화에 따른 암모늄메타바나데이트 용해도와 암모늄 이온의 분해 정도가 반응속도 및 침전률에 커다란 영향을 미치는 것을 확인하였다7).
일반적으로 바나듐광 염배소 및 수침출 과정을 통하여 얻어지는 바나듐 함유 수용액은 pH 13 정도의 강알칼리성 수용액으로서, 알루미늄, 인, 실리케이트 그리고 나트륨 이온들이 존재한다. Xiong 연구진은 알칼리 그리고 산성 영역의 특정 조건에서 암모늄바나데이트를 침전시켰으며, 이 때 존재하는 불순물이 산화바나듐 순도 및 회수율에 미치는 영향을 고찰하였다8). 이들의 연구결과에 의하면, 나트륨은 알칼리 조건에서 침전되는 암모늄메타바나데이트 순도에 그리고 인은 산성조건에서 암모늄폴리바나데이트 순도 및 회수율에 영향을 미친다고 보고하였다. 그러나 이와 같은 연구는 수용액의 pH 를 일정하게 유지시킨 조건에서 금속 이온들이 암모늄바나데이트 침전률과 순도에 미치는 영향을 단순하게 조사한 결과들로서, 강알칼리성인 바나듐광 염배소 산물 수침출 용액으로부터 바나듐을 침전회수 시키는 과정에서 금속 이온들이 미치는 영향을 체계적으로 연구된 결과들은 발표된 것이 없는 실정이다.
그러므로 본 연구에서는 바나듐광 처리과정을 거쳐 얻은 바나듐 함유 수용액으로부터 침전제인 염화암모늄을 첨가하여 암모늄메타바나데이트를 침전시킬 때, 수용액에 존재하는 알루미늄, 실리케이트 등의 성분들이 바나듐 회수에 미치는 영향을 알아보았다.
2. 실험장치 및 방법
암모늄메타바나데이트 침전실험에 사용된 반응기는 응축기가 장착된 250 mL pyrex 반응기였으며, 온도조절기가 장착된 핫플레이트를 이용하여 침전반응온도를 조절하여 마그네틱 바로 반응물을 교반시켰다.
암모늄메타바나데이트 침전에 사용된 출발용액은 바나듐광의 염배소 산물을 수침출하여 얻은 소듐바나데이트 수용액으로서, 수용액 pH는 13 정도의 강알칼리 수용액이다. Table 1은 본 연구에서 출발물질로 사용된 소듐바나데이트 수용액의 성분과 함량을 보여주고 있는데, 주요 원소들은 바나듐, 알루미늄 그리고 나트륨이 과량 존재하며, 인과 실리콘이 소량 존재하였다.
Table 1.
Chemical composition of leaching solution of salt-roasted vanadate ore
| Element | V | Al | Si | P | Na |
| Concentration [mg/L] | 17000 | 9603 | 151.1 | 786.5 | 35900 |
이와 같이 강알칼리성 소듐바나데이트 수용액은 염화암모늄 첨가에 의한 암모늄메타바나데이트 침전과정에서 암모늄 이온이 암모니아로 거의 다 분해되는 pH 영역이기 때문에7) 수용액의 pH를 낮추어야 한다. 따라서 황산을 이용하여 수용액 pH를 9 이하로 낮추는 과정에서 수용액의 바나듐과 타 성분들의 농도 변화 거동을 고찰하였다. 그리고 수용액 pH를 9로 조절한 후, 상온에서 소듐바나데이트 수용액의 바나듐 함량 대비 3당량의 염화암모늄을 첨가하여 암모늄메타바나데이트를 침전시켜 회수하였다. 암모늄메타바나데이트 침전물은 수용액에서 용해도가 최소화되는 NaCl 3%, NH4Cl 2% 수용액9)으로 세척하였다. 또한 암모늄메타바나데이트를 550℃에서 2시간 열처리하여 오산화바나듐(V2O5)을 얻을 수 있었다. 암모늄메타바나데이트와 오산화바나듐의 결정과 수용액 pH 조절과정에서 형성되는 침전물의 종류를 알아보기 위하여 XRD(X-ray diffractometer, D8 ADVANCE, BRUKER)를 사용하였다. 수용액 pH 조절과정에서 침전되는 물질들은 결정형과 무정형이 혼합되어 있으므로 XRD를 통하여 정확한 결정구조를 알아보기는 어렵다. 그러나 침전물의 XRD 분석을 통하여 침전 가능한 물질 종류를 추적함으로서, 침전과정에서 수용액의 원소별 농도가 변하는 이유를 설명하고자 하였다.
그리고 수용액의 pH 조절 과정에서 금속 이온들의 함량은 침전물 여과 여액의 ICP-AES(inductively coupled plasma atomic emission spectroscopy, Optima 8300, PerkinElmer) 분석을 통하여 얻을 수 있었으며, 이를 통하여 바나듐 회수율 및 타 성분들의 제거율을 구할 수 있었다.
3. 결과 및 고찰
3.1. 황산 첨가에 의한 소듐바나데이트 수용액 거동 고찰
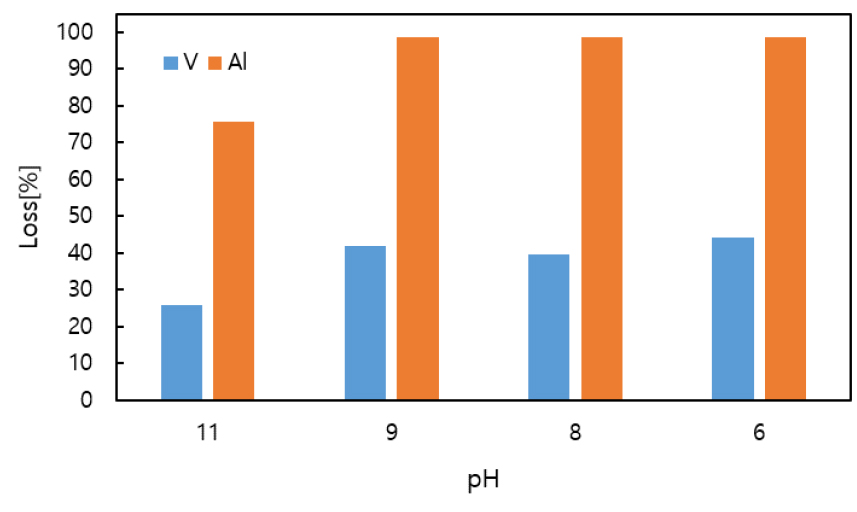
Table 1과 같은 소듐바나데이트 수용액으로부터 암모늄메타바나데이트를 침전회수 하기 위해서는 수용액 pH 13을 9 이하로 낮추어야 하는데, 이러한 이유는 강알칼리 조건에서는 침전체로 첨가되는 염화암모늄에서 암모늄 이온이 암모니아로 분해되어 증발되기 때문이다7). 그러므로 본 연구에서는 소듐바나데이트 수용액의 pH를 낮추기 위하여 황산을 첨가하였는데, 황산을 첨가하면서 수용액의 pH를 조절하는 과정에서 침전물이 형성되었다. Fig. 1은 황산을 사용하여 소듐바나데이트 수용액의 pH를 낮추는 과정에서 바나듐과 알루미늄이 침전물로 제거되는 손실률을 보여주고 있는데, 수용액의 pH가 낮아질수록 바나듐과 알루미늄의 손실률이 증가되는 것을 알 수 있다.
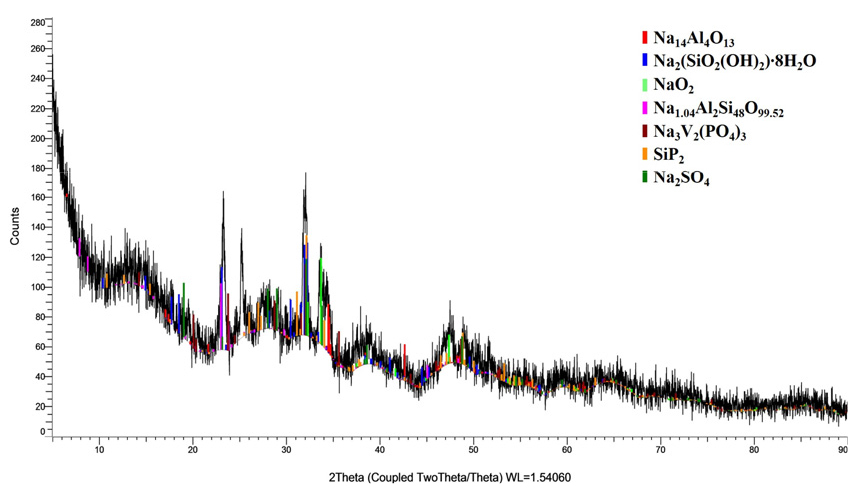
Fig. 2는 황산 첨가에 의하여 수용액의 pH를 11로 조절하는 과정에서 침전된 침전물의 XRD 분석결과를 보여주고 있는데, 앞에서 설명한 바와 같이 침전물을 여과, 건조하여 XRD 분석을 수행하였기 때문에 결정성은 좋지 않다. 그러나 침전물은 소듐-알루미늄-산화물, 소듐실리케이트, 소듐-알루미늄-실리케이트, 그리고 소듐-바나듐-포스페이트 등의 화합물 결정구조 특성을 보이는 것으로 판단된다. 그러므로 소듐바나데이트 수용액에 황산을 첨가하면 알루미늄수산화물 양이온{[Al(OH)h(OH2)6-h](3-h)+}과 황산기가 반응하여 침전되며10), 또한 황산 첨가에 의하여 수용액에 존재하는 수소 이온[H+]은 수용액에 존재하는 실리카 음이온과 반응하여 규산을 형성하고 연속하여 실리카로 침전이 일어난다11). 이 과정에서 바나듐과 인[P]도 공침이 일어나는 것으로 사료된다.
또한 황산첨가에 의한 소듐바나데이트 수용액 pH를 조절할 때, 수용액 pH 9 이하에서는 바나듐과 알루미늄 손실률이 일정해 지는 것을 볼 수 있다(Fig. 1 참조). 따라서 소듐바나데이트 수용액의 pH를 9로 조절할 때, 바나듐이 공침되어 약 40% 정도의 손실이 발생하는 것을 알 수 있다. Table 2는 소듐바나데이트 수용액의 pH 조절에 따른 바나듐과 알루미늄의 함량을 보여주고 있는데, pH 13의 수용액은 Table 1에 나타낸 원 시료와 동일한 출발 수용액이나, 바나듐 함량이 다르게 표기되어 있다. 이러한 이유는 ICP 분석 특성 상 같은 농도를 분석하여도 분석 당일에 따라 농도의 절대 값이 차이가 나기 때문이다. 그러므로 각 Table에 표기된 같은 조건에서의 원소 별 농도 값 차이는 이러한 이유에 기인한다.
Table 2에서 수용액 pH 8까지는 바나듐과 알루미늄 함량이 줄어드는데, 수용액 pH 2에서는 두 성분들의 함량이 다시 증가하는 것을 보이고 있다. 그러므로 수용액 pH가 2로 낮아지면서 강산 조건에서는 침전물이 재 용해되고, 따라서 바나듐과 알루미늄 함량이 증가하는 것으로 사료된다. Fig. 3은 수용액 pH에 따라 침전물이 여과된 수용액의 모습을 보여주고 있는데, 수용액 pH가 낮아지면서 수용액의 색은 점점 붉은 색을 띄며, 이러한 이유는 수용액 pH가 낮아지면서 NaVO3가 HVO3로 전환되어 붉은 색으로 변한다고 알려져 있다12).
Table 2.
Content of vanadium and aluminium with solution pH
| pH | V [mg/L] | Al [mg/L] |
| 13 | 18,020 | 10,050 |
| 11 | 13,360 | 2,463 |
| 9 | 10,490 | 147 |
| 8 | 10,910 | 144 |
| 2 | 15,190 | 8,554 |
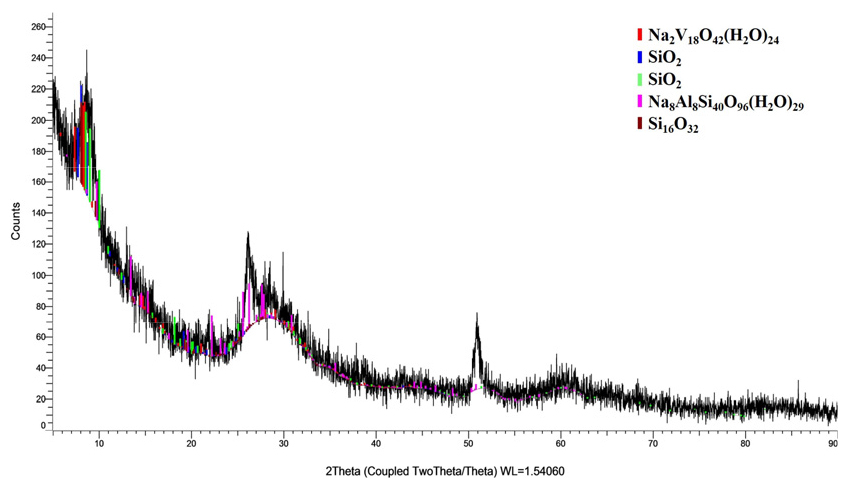
pH 2로 조절된 수용액은 소량의 검붉은 침전물이 형성되며, 침전물이 제거된 수용액을 방치하면 검붉은 침전물이 다시 생성된다. Fig. 4는 이러한 침전물의 XRD 분석결과를 보여주고 있는데, 침전물은 소듐알루미노실리케이트, 소듐바나데이트, 실리케이트 화합물 등으로 구성되어 있다. 그러므로 수용액 pH를 2로 낮추는 과정에서 공침이 일어난 바나듐과 알루미늄이 용해되지만 일부는 검붉은 침전물 형태로 남아있는 것을 알 수 있다.
그러므로 본 연구에서는 바나듐 손실을 고려하여, 바나데이트 수용액을 pH 2, 온도 90℃에서 염화암모늄을 3당량 첨가하여 암모늄폴리바나데이트를 침전시키고자 하였다10). pH 2로 조절된 바나데이트 수용액의 온도를 90℃로 올리면, 검붉은 고체가 침전되며, 여기에 염화암모늄을 3당량 첨가하면 암모늄폴리바나데이트 침전이 일어나지 않으며, 고체 침전물을 여과한 후에 염화암모늄 3당량을 2차로 첨가하면 암모늄폴리바나데이트가 침전되었다. 그러나 바나듐 회수율은 46% 정도에 지나지 않았다. 그러므로 수용액의 pH를 2로 조절한 바나데이트 수용액에서의 바나듐 회수는 회수율이 지나치게 낮다는 것을 알 수 있었다.
3.2. 바나듐 함유 수침출 수용액으로부터 암모늄메타바나데이트 회수공정 고찰
바나듐광 염배소산물 수침출 용액으로부터 암모늄메타바나데이트를 침전회수하기 위해서는 강알칼리성 수용액 pH 13을 9 이하로 낮추어야 한다. 그러나 앞에서 언급한 바와 같이 수용액 pH를 낮추기 위하여 첨가되는 황산으로 인하여 알루미늄과 바나듐이 공침되어 바나듐 회수율이 저하되기 때문에 수용액 pH 조절 전에 알루미늄을 먼저 제거하여야 한다.
일반적으로 수용액 pH 3 이하에서 알루미늄은 [Al(OH2)6]3+로 존재하며, 수용액 pH가 증가함에 따라 가수분해가 일어난다10).
그리고 알루미늄이 용해되어 있는 수용액에 실리케이트를 첨가하면, 다음과 같은 반응이 일어난다.
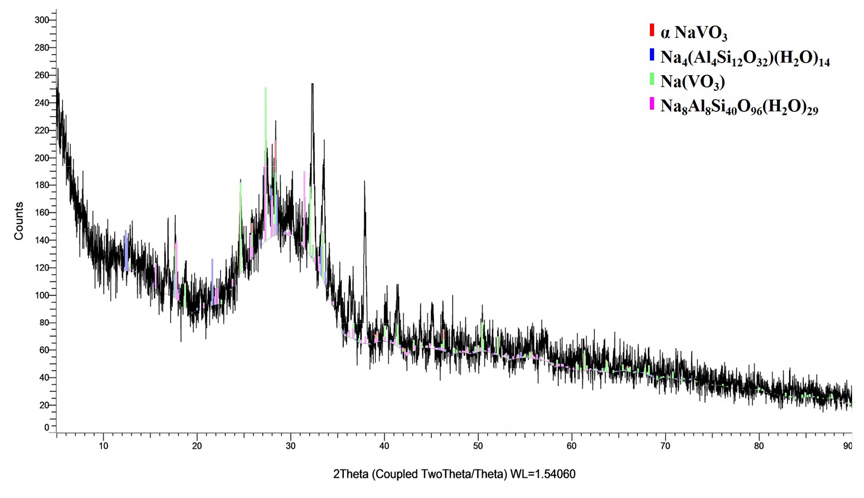
그러므로 본 연구에서는 수용액의 알루미늄을 제거하기 위하여 소듐실리케이트를 첨가하였다. Fig. 5는 소듐바나데이트 수용액에 소듐실리케이트를 첨가하여 얻은 침전물의 XRD 분석결과를 보여주고 있는데, 침전물은 주로 소듐-알루미늄-실리케이트 화합물이며 일부 소듐바나데이트 화합물이 존재하는 것으로 판단되었다.
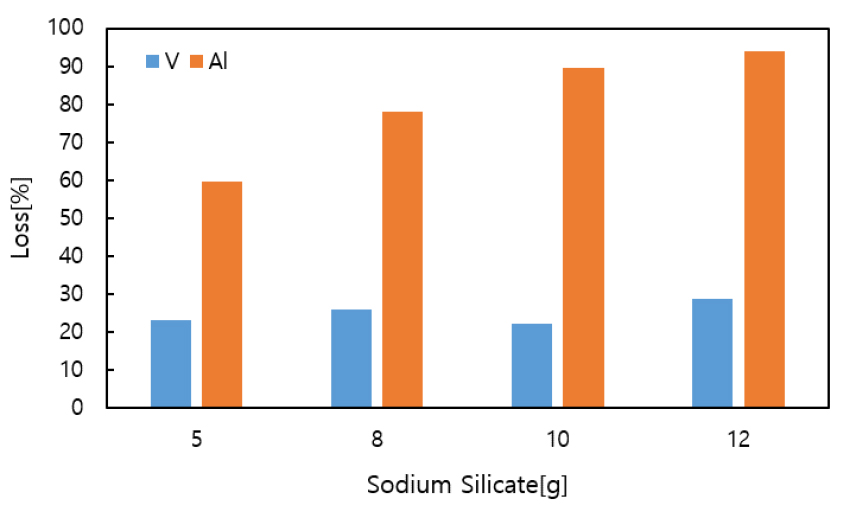
Fig. 6은 소듐바나데이트 수용액에 첨가되는 소듐실리케이트 양에 따른 알루미늄과 바나듐의 제거율을 보여주고 있는데, 소듐실리케이트 첨가량 증가에 따라 제거되는 알루미늄의 양이 증가하며, 수용액 알루미늄 함량 대비 4당량 정도 소듐실리케이트를 첨가하면 알루미노-실리케이트 화합물 침전으로 약 90% 정도 알루미늄이 제거되었다. 바나듐 손실률은 18~20% 정도로 소듐실리케이트 첨가량 변화에 큰 영향이 없는 것을 알 수 있다.
Table 3은 소듐바나데이트 수용액에 소듐실리케이트를 첨가하여 알루미늄-실리케이트를 침전시킨 후, 여과여액과 침전물을 물로 세척하여 얻은 세척수의 바나듐과 알루미늄의 함량을 보여주고 있다. 이 결과에 의하면, 소듐바나데이트 수용액에 소듐실리케이트 10g(알루미늄 대비 3.3당량)을 첨가하여 알루미늄-실리케이트 화합물을 침전시킨 후, 여과여액의 바나듐 함량을 분석한 결과 약 19.4% 정도의 바나듐 손실이 일어났다. 그러나 알루미늄-실리케이트 침전물을 세척하여 얻은 세척수에는 출발물질의 바나듐 함량 대비 약 10% 정도의 바나듐이 함유되어 있고, 따라서 세척공정을 통하여 약 10%의 바나듐을 회수할 수 있었다. 이러한 결과로부터 알루미늄-실리케이트 침전에 의하여 발생되는 20% 정도의 바나듐 손실률 중에 절반은 알루미늄-실리케이트 침전물 함유용액에 존재하는 것으로서 세척과정을 통하여 회수할 수 있었고, 나머지 절반은 침전물로 공침이 되는 것으로 사료된다. 그러므로 알루미늄 제거과정에서 약 10% 정도의 바나듐 손실이 발생하였다.
Table 3.
Loss and recovery of vanadium during the removal process of Al
| V [mg/L] | Al [mg/L] | Solution volume [L] | V [mg] | V loss [%] | V recovery [%] | |
| Raw | 16380 | 8855 | 0.2 | 3276 | - | - |
| Na2SiO3 10g | 17140 | 1523 | 0.154 | 2639.6 | 19.4 | - |
| Washing solution | 4425 | 0 | 0.08 | 354 | - | 10.8 |
알루미늄이 90% 제거된 소듐바나데이트 수용액으로부터 암모늄메타바나데이트를 침전시키기 위하여 황산 수용액을 첨가하여 수용액 pH를 9로 조절하였다. 이 과정에서도 침전물이 생성되는데, Fig. 7은 수용액 pH 조절과정에서 생성되는 침전물의 XRD 분석결과를 보여주고 있다. 이 결과에 의하면 침전물은 실리케이트 화합물이 주종을 이루는데, 식 (4)와 같이 황산이 첨가됨으로써 실리케이트 화합물이 형성되고 그 결과, 침전물은 무정형태를 보이고 있음을 알 수 있다12).
이러한 결과로부터, 알루미늄이 제거된 소듐바나데이트 수용액 pH 조절을 위하여 고농도 황산수용액을 첨가하면, 수용액 내 국부적으로 강산 분위기가 조성되면서 실리케이트 화합물 침전을 가속화 시키므로 이에 따른 바나듐 손실률도 증가할 것으로 사료된다. 따라서 본 연구에서는 황산 수용액의 농도 그리고 첨가속도를 변화시키면서 이들이 바나듐 손실에 미치는 영향을 알아보았으며, 이 결과를 Table 4에 나타내었다. 이 결과에 의하면 50% 황산수용액을 첨가하였을 때와 비교하여 25% 황산수용액을 천천히 첨가하였을 때 바나듐 손실률은 약 46%로 감소하였다. 그러므로 알루미늄이 제거된 소듐바나데이트 수용액의 pH 조절과정에서 황산의 농도 및 첨가속도가 바나듐 회수율에 큰 영향을 미치는 것을 확인하였다.
Table 4.
Loss of vanadium with sulfuric acid concentration and adding speed
| V loss [%] | Remark | |
| H2SO4 50%_fast | 13.08 | Relative to total vanadium content |
| H2SO4 25%_slow | 8.05 | Relative to total vanadium content |
Table 5는 수용액 pH 9로 조절된 소듐바나데이트 수용액과 소듐-알루미늄-실리케이트 침전물 세척액을 합친 수용액의 바나듐 함량으로부터 바나듐 총 손실률과 회수율을 보여주고 있다. 이 결과에 의하면, 바나듐광 염배소 산물의 수침출 공정을 거쳐 얻은 pH 13의 소듐바나데이트 수용액으로부터 알루미늄 제거 그리고 수용액 pH 조절과정을 거쳐 얻은 수용액의 바나듐 함량은 출발 물질 대비 약 82.6%로서, 초기 소듐바나데이트 수용액으로부터 황산을 이용하여 수용액 pH를 9로 조절한 경우와 비교하여 약 22% 이상의 바나듐 손실을 방지할 수 있었다.
Table 5.
Loss and recovery of vanadium during the processes of removal Al and controlling solution pH
| V [mg/L] | Al [mg/L] | Solution volume [L] | V [mg] | V loss [%] | V recovery [%] | |
| pH 9 | 17470 | 0 | 0.136 | 2375.9 | 27.4 | - |
| pH 9+washing sol’n | 12540 | 0 | 0.216 | 2708.64 | 17.3 | 82.6 |
이전의 연구결과에 의하면7),알칼리 조건하에서 암모늄메타바나데이트 침전은 35℃ 이하에서 침전반응을 수행하여도 침전률에 영향을 미치지 않으므로, Table 5의 알루미늄 제거 및 수용액 pH 조절이 진행된 소듐바나데이트 수용액과 알루미늄 함유 침전물 세척액을 혼합한 바나듐 함유 수용액에 바나듐 함량 대비 3당량의 염화암모늄을 첨가하여 25℃에서 암모늄메타바나데이트를 침전시켜 회수하였다.
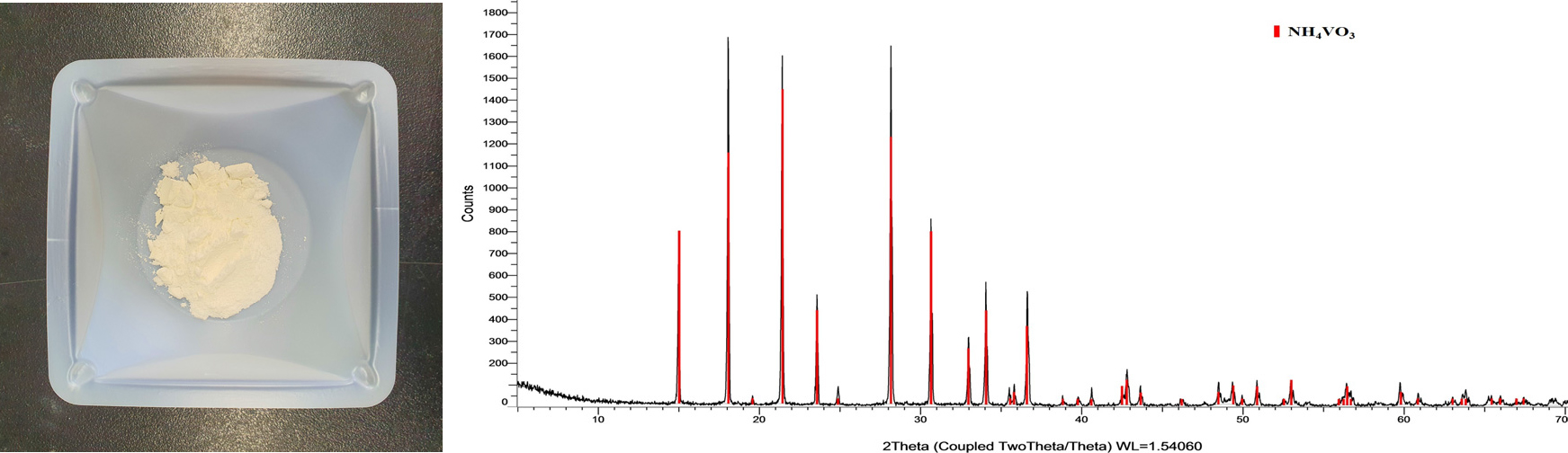
Fig. 8은 회수된 암모늄메타바나데이트 사진과 XRD 분석결과를 보여주고 있는데, 암모늄메타바나데이트는 엷은 미색을 띠고 있으며, 결정구조는 암모늄메타바나데이트 참고피크와 잘 일치되고 있음을 보여준다. 이 때 소듐바나데이트 수용액으로부터 암모늄메타바나데이트 침전률은 98.8%이었다.
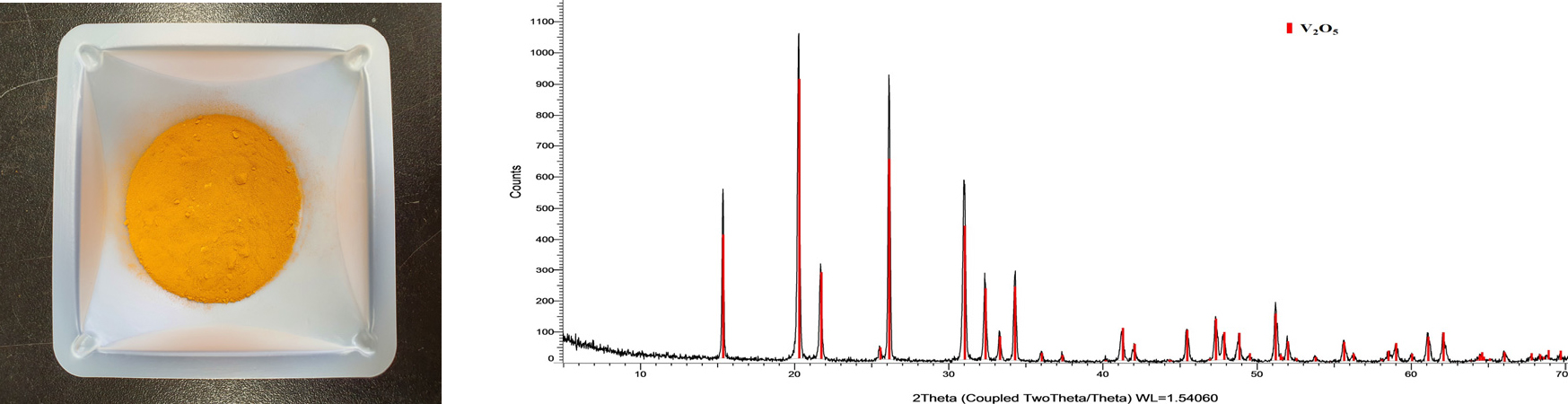
Fig. 9는 암모늄메타바나데이트를 550℃에서 2시간 열처리하여 얻은 오산화바나듐(V2O5) 사진과 XRD 분석결과를 보여주고 있는데, 오산화바나듐의 전형적인 진한 노란색을 띠고 있으며, 결정구조는 오산화바나듐 참고피크와 잘 일치하고 있는 것을 확인할 수 있다.
Table 6은 오산화바나듐의 ICP 순도분석 결과를 보여주고 있는데, 본 연구과정을 통하여 얻은 오산화바나듐의 순도는 98.9%이었다.
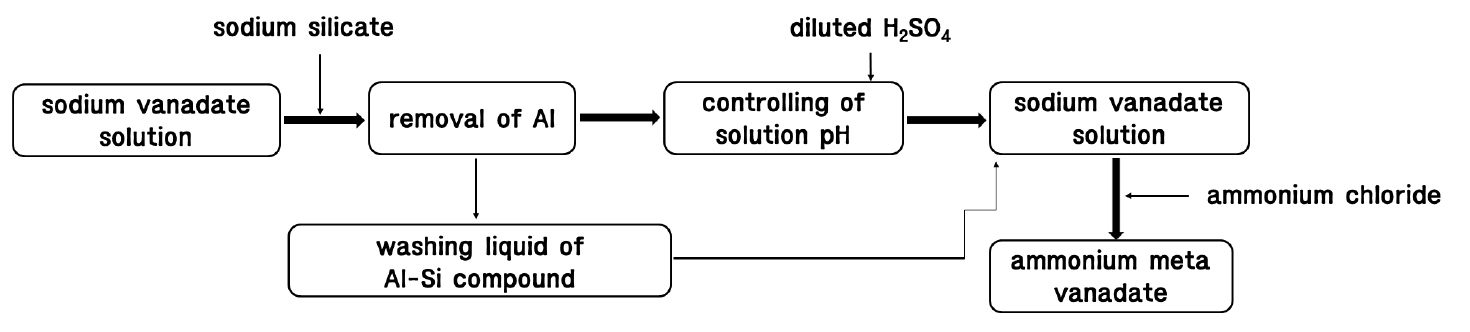
그러므로 바나듐광 염배소 산물의 수침출 수용액으로부터 바나듐을 회수하기 위하여 수행된 연구 결과로부터, 알루미늄이 다량 함유된 강알칼리성 소듐바나데이트 수용액으로부터 암모늄메타바나데이트를 침전회수하기 위해서는 알루미늄을 먼저 제거하여야 하며, 이후 수용액 pH를 9 이하로 조절하여 염화암모늄을 첨가하여 암모늄메타바나데이트를 침전시켜야 바나듐 손실을 줄일 수 있다. 또한 소듐실리케이트 첨가에 의한 알루미늄 제거공정에서 침전물을 세척하여 침전물에 함유된 용액으로부터 바나듐을 회수하여 바나듐 손실을 줄일 수 있다. Fig. 10은 본 연구에서 수행된 알루미늄이 다량 함유된 소듐바나데이트 수용액으로부터 암모늄메타바나데이트를 침전회수하는 일괄 공정도를 보여주고 있다.
4. 결 론
본 연구에서는 바나듐광의 염배소 산물을 수침출하여 얻은 소듐바나데이트 수용액으로부터 암모늄메타바나데이트를 침전 회수함에 있어서, 소듐바나데이트 수용액 특성이 바나듐 회수에 미치는 영향을 고찰하여 다음과 같은 결론을 얻었다.
1) 바나듐광 염배소-수침출 과정을 통하여 얻은 소듐바나데아트 수용액은 강알칼리성 수용액으로서 암모늄메타바나데이트를 침전시키기 위해서는 황산을 첨가하여 수용액 pH를 9 이하로 조절하여야 하며, 이 과정에서 수용액에 존재하는 알루미늄과 바나듐이 공침되어 40% 정도의 바나듐 손실이 발생한다.
2) 그러므로 수용액 pH를 조절하기 전에 알루미늄을 먼저 제거하여야 하며, 본 연구에서는 소듐실리케이트를 수용액의 알루미늄 함량 대비 약 3당량을 첨가하여 90% 이상의 알루미늄을 침전물로 제거할 수 있었다. 이 과정에서 약 20% 정도의 바나듐 손실이 발생하나, 알루미늄 침전물을 물로 세척하여 10% 정도의 바나듐을 회수할 수 있었다.
3) 알루미늄이 제거된 수용액에 황산을 첨가하여 수용액의 pH를 9로 조절함에 있어서, 황산 수용액의 농도 그리고 첨가속도가 실리케이트 화합물과 바나데이트 공침에 영향을 미치며, 이 과정에서 가급적 묽은 황산을 사용하여 천천히 첨가하여 수용액 pH를 조절하는 것이 바나듐 손실을 최소화 하는데 중요하다. 본 연구에서는 25%의 묽은 황산을 한 방울씩 첨가함으로서 수용액에 존재하는 바나듐의 공침률을 8% 대로 낮출 수 있었다.
4) 위와 같이 진행된 과정을 거쳐 출발물질 바나듐 함량 대비 약 81.5%의 바나듐을 암모늄메타바나데이트로 침전회수 할 수 있었으며, 이를 550℃에서 2시간의 열처리 과정을 거쳐 98.9% 품위를 갖는 오산화바나듐을 얻을 수 있었다.
5) 이러한 결과로부터 바나듐의 회수율을 높이기 위해서는 바나듐광의 염배소-수침출 과정에서 가급적 알루미늄이 최소로 용해될 수 있는 공정조건 확립이 가장 중요하다고 사료된다.