1. 서 론
2. 리튬의 생산량과 용도
3. 리튬의 제련
3.1. 리튬 자원
3.2. 리튬 제련의 화학
3.3. 염호로부터의 리튬 추출
3.4. 광석으로부터의 리튬 추출
3.5. 금속 리튬의 제조
4. 종 합
1. 서 론
리튬(lithium, Li)은 주기율표의 첫 번째 금속이면서, 가장 가벼운 금속으로 상온에서 밀도가 0.534 g/cm3이어서 물 위에 쉽게 떠다닐 수 있을 정도이다. 순수한 Li은 반응성이 매우 강하며, 자연에는 레피도라이트(lepidolite)나 페타라이트(petalite)와 같은 광물에만 존재한다. 브라질의 화학자인 실바(José Bonifácio de Andrada e Silva)가 1800년에 스웨덴의 우투섬(Utö)의 광산에서 Li이 함유된 광석인 페타라이트(LiAlSi4O10)와 스포듀민을 최초로 발견하였다. 페타라이트의 발견으로부터 17년 후인 1817년에 알파드슨(Johan August Arfvedson)이 엽장석을 분석하여 새로운 원소의 존재를 발견했다. 이 원소를 처음에는 ‘lithion’으로 부르다가 그리스어로 돌(stone)을 나타내는 ‘lithos’로부터 ‘lithium’으로 불리게 되었다1).
한편 1818년 데이비(Sir Humphry Davy)와 브랜드(William Thomas Brande)가 Li2O를 전기분해하여 극소량의 금속 Li을 얻었다. 그리고 1854년 분젠(Robert Bunsen)과 마티센(Augustus Matthiessen)이 염화리튬을 전기분해하여 상당한 양의 금속 Li을 제조하였다. 이 기술은 1923년에 독일 기업인 메탈게젤샤프트사(Metallgesellschaft AG)에서 염화리튬과 염화칼륨 혼합염을 전기분해시켜 금속리튬을 얻는 상업적 생산법이 되었다1,2).
Li은 은백색의 무른 금속이며, Li의 비열은 모든 고체 원소 중에서 가장 높다. 또 Li의 화학적 성질은 알칼리 토류 금속과 유사하며, 산화환원 전위는 모든 원소 중에서 가장 낮으며. Li의 융점(180.5 ℃)이나 끓는점(1,330 ℃)은 알칼리 금속 중에서 가장 높다. 한편 Li의 높은 이온화 경향에 따른 에너지 밀도를 활용하여 Li 이온 전지로 잘 알려져 전기 자동차나 휴대용 기기의 전원으로 필수 불가결한 존재가 되었다. Li은 공기 중에서 쉽게 산화되는 등 구조용 금속으로는 사용할 수 없으나 주로 경량 합금의 첨가 원소로 사용되고 있으며, 특히 알루미늄-리튬 합금은 항공기 구조재로서도 사용되고 있다. 그리고 금속 Li이나 화합물의 용도는 배터리 외에도 내열유리용 첨가제, 냉동기의 흡수제 등의 수요도 증대하였다3).
한편 최근 지구 온난화 방지를 위한 탄소중립이 중요한 이슈로 등장하면서 Li 이온 이차 전지를 동력원으로 사용하는 전기자동차의 보급이 가속화되면서 Li의 중요성이 더욱더 부각되고 있다. Li은 염호나 광석과 같은 천연자원으로부터 추출할 수 있으나, 폐전지 등의 지상자원으로부터 추출, 회수하는 것 또한 중요하다. 기존의 Li 리사이클링 기술의 대부분은 천연자원으로부터 리튬을 추출하는 기술을 응용한 것이므로 새로운 리튬 리사이클링 기술을 개발하기 위해서는 천연자원으로부터 Li 화합물이나 Li을 추출하는 기술의 이해가 필요하다. 따라서 본 논문에서는 이러한 Li의 자원, 생산량, 그리고 천연자원으로부터 Li 화합물과 금속을 추출하는 기술에 대하여 고찰하였다.
2. 리튬의 생산량과 용도
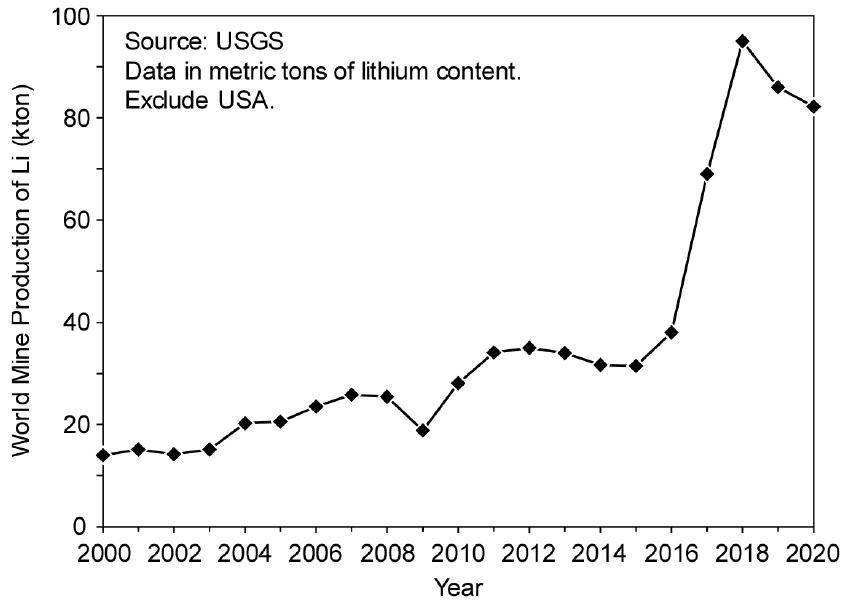
Fig. 1에는 2000년대 전 세계(미국 제외)의 Li 함유량 기준의 생산량 변화를 나타내었다4). 1990년대까지의 Li 생산량은 미미하였으나, 리튬 이온 배터리의 수요 증가에 힘입어 2000년대부터 생산량이 서서히 늘어났다. 2016년부터는 전기 자동차의 보급 확대에 따라 Li 생산량이 급증한 것을 알 수 있으며, 최근에 약간 감소하는 경향을 보이고 있으나, 향후 Li의 수요는 더욱더 증가할 것으로 예상된다.
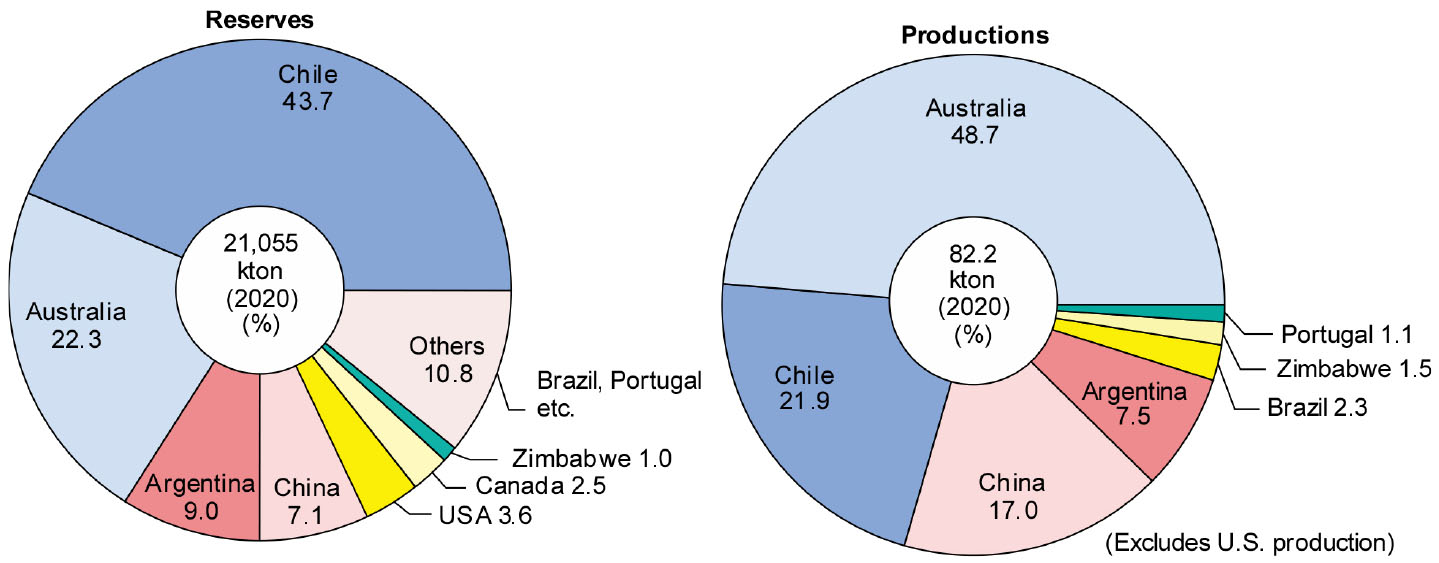
Fig. 2에는 2020년 기준의 나라별 Li 자원의 매장량과 Li의 생산량 비율을 나타내었다5). Li 자원의 매장량은 칠레, 호주, 아르헨티나, 중국 등의 순으로 많으나, 생산량은 호주, 칠레, 중국, 아르헨티나 순으로 많다. 특히 Li의 지각중 원소 존재도는 35위에 불과하며 지역적 편재가 심하므로 Li의 안정적인 수급을 위해서 폐자원으로부터 리사이클링하는 것이 필요할 것이다.
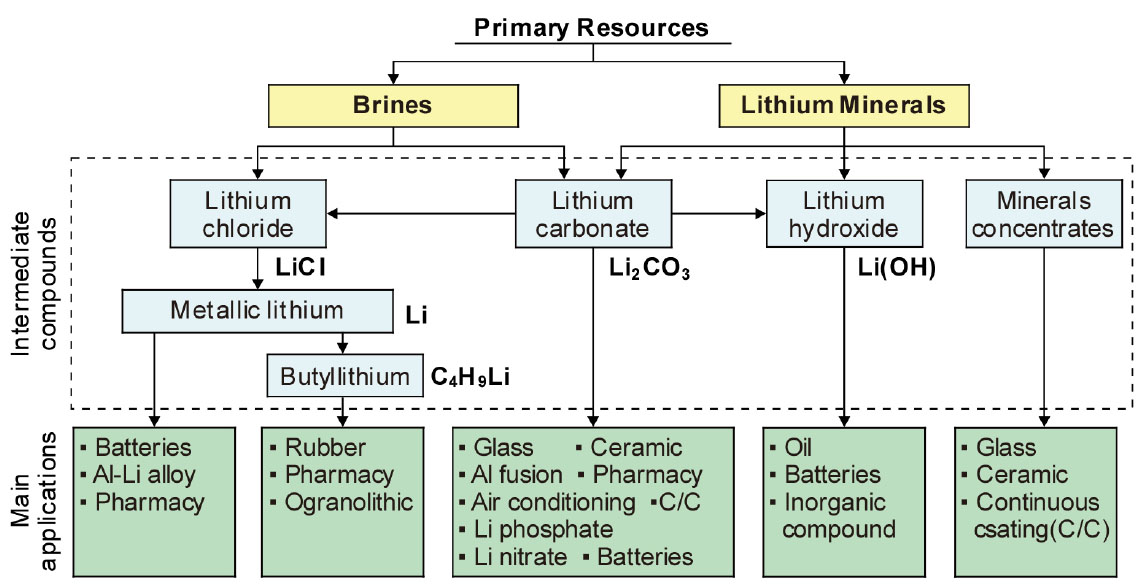
Fig. 3에는 Li 1차 자원으로부터의 중간제품(화합물)과 최종용도를 재구성하여 나타내었다6). Li 자원은 크게 염수(brines)와 광물로 구분할 수 있으며, 자원의 종류에 따라 금속 Li은 물론 LiCl, Li2CO3, Li(OH), C4H9Li 등 다양한 화합물을 만들고 있다. 이러한 금속 Li 및 화합물들은 합금 원소, 배터리 외에도 다양한 용도로 사용되고 있다. 그리고 광석을 전처리한 정광은 유리, 세라믹 첨가제 그리고 철강에서 연속 주조시의 몰드 파우더용으로 사용되고 있다.
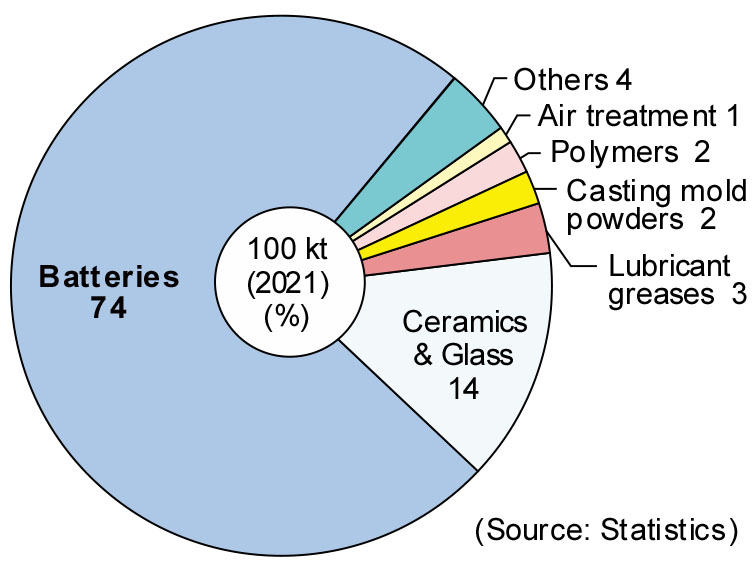
Fig. 4에는 2021년 기준 Li의 최종 용도별 비율을 나타내었다7). 상기한 바와같이 리튬은 배터리를 비롯하여 세라믹, 그리스 등에 사용되고 있다. 2008년에는 배터리용으로 사용된 Li의 비율이 23 %에 불과하였으나8), 2021년 배터리에 사용된 Li의 비율은 급증하여 약 74 %에 달한다. 이러한 추세는 전기 자동차 보급이 활성화되면서 더욱더 증가할 것으로 생각된다.
3. 리튬의 제련
3.1. 리튬 자원
리튬의 자원은 크게 염수(brines)와 광물인 페그마타이트(pegmatites), 퇴적암(Sedimentary rocks)의 세 가지로 나뉜다. 이러한 원료로부터 Li(OH), Li2CO3, LiCl, C4H9Li 등의 중간 화합물이나 금속 Li을 만들어 다양한 용도로 사용하고 있다. 리튬 자원 중 첫 번째 공급원은 염수(brines)이며, 전 세계적으로 확인된 매장량의 60 % 이상을 차지한다. 염수 중 건조 염호인 Salars에는 리튬 염수의 78 %가 매장돼 있다6).
두 번째 공급원은 페그마타이트(pegmatites)이며, 확인된 추정 리튬 매장량의 23~30 %를 차지한다. 세계적인 리튬의 주요 공급원인 리튬 함량이 많은 페그마타이트는 전체 페그마타이트의 0.1 % 미만을 차지하여 매우 희소한 자원이다. Table 1에 Li 함유 광석과 Li 함유량을 나타내었다9).
Table 1.
Principal commercial lithium minerals with composition
세 번째 공급원은 퇴적암(Sedimentary rocks)인 헥토라이트(hectorite)와 자다라이트로 전 세계 리튬 자원의 3 % 미만을 차지하고 있다. 헥토라이트에는 0.3~0.6 %의 리튬을 함유하고 있다. 자다라이트는 비교적 최근인 2006년에 발견된 것으로 B이 함유되어 있으며10), 이론적인 Li 함량은 3.39 %이지만, 일반적으로 0.1 % 미만이 함유되어 있다.
3.2. 리튬 제련의 화학
3.2.1. 간수나 염수 중 Li 추출
간수나 염수 중의 Li 회수는 태양열을 이용한 자연 증발과 치환반응을 이용한 불순물의 석출 제거를 이용한다. 간수 중에서 제거해야 할 불순물로는 Mg, K, Na 등이 있으며, 첫 단계에서는 수분의 자연 증발에 따른 불순물 이온의 용해도 차이를 이용한다. 수용액 중의 용해도는 용해도곱(solubility product constant, )으로 평가하며, (s)의 는 다음과 같다.
Table 2에는 몇 가지 염들의 용해도곱을 나타내었다11,12). 수분의 자연 증발에 의해 불순물 이온들이 과포화 상태가 되어 용해도곱보다 많게 되면 석출하게 된다.
수분의 자연 증발에 의해 NaCl, KCl, MgCl2 등의 일부를 석출시켜 제거한 후, 잔류하는 불순물은 CaO나 Na(OH), Na2CO3 등을 첨가하여 치환반응으로 제거할 수 있다. 특히 CaO는 물과 반응하여 Ca(OH)2를 생성하므로 생석회(CaO)나 NaOH 등을 첨가하여 치환반응으로 많은 양이 용해되어 있는 Mg2+를 제거하고, 잔류하는 Mg2+는 Na(OH)를 첨가하여 다음식과 같이 제거한다.
그리고 Table 2에 나타낸 것처럼 CaCO3의 가 매우 낮아 쉽게 석출되므로 용해된 Ca2+는 Na2CO3나 Li2CO3를 첨가하여 제거한다.
Table 2.
The solubility product () of brine salt product at 25℃
한편 Mg(OH)2가 침전될 때 pH를 조정(8.5~10.5)하면 B을 흡착시켜 제거할 수도 있다. 그리고 리튬을 탄산염이나 인산염13)으로 회수하는 반응은 다음과 같다.
Li2CO3나 Li3PO4로부터 LiOH를 만드는 반응은 다음과 같다13).
3.2.2. 광석 중의 Li 추출
광석 중의 Li을 추출하는 것은 일반적인 습식제련과 동일하며, 대표적으로 산처리법과 알칼리 처리법이 있으며, LiCl을 만들기 위한 염화법도 실시하고 있다. 광석 종류에 따라 하소나 배소를 한 후 산이나 알칼리로 침출한다. 리튬 광석 중 가장 풍부한 스포듀민 중에서 α-spodumene(monoclinic)은 산에 잘 용해되지 않으므로 열처리를 통하여 β-spodumene(LiAlSi5O12, tetragonal)으로 상변화를 시킨 후 황산과 혼합하여 약 250 ℃에서 황산화 배소를 한다. 이때 황산은 Na이나 K을 처리하기 위해 화학양론적인 양보다 최소 30 % 이상 과잉으로 첨가하여야 하며 반응식은 다음과 같다6).
황산화 배소를 한 후, Li2SO4(s)를 수침출하고, 고체상태의 Li2SO4로 석출시키거나 Li2CO3, LiCl 등으로 만든다. Li2CO3는 Na2CO3를 이용하여 다음식과 같이 제조한다.
한편 스포듀민의 알칼리 처리법은 정광을 석회석(CaCO3)과 혼합하여 배소(825~1,050 ℃)하며, 반응식은 다음과 같다14).
배소광을 CaO를 첨가하여 수침출하면 다음식과 같이 LiOH가 생성된다.
레피도라이트(LiF·KF·Al2O3·3SiO2)는 약 860 ℃의 수증기 분위기에서 다음식과 같이 배소하여 F 성분을 제거한 후, 약 150 ℃의 오트클레이브에서 고압 침출을 한다.
한편 β-spodumene은 탄산나트륨을 이용하여 약 225 ℃에서 가압침출하여 Li2CO3를 추출한다15).
생성된 슬러지는 수용액 중에 CO2를 취입하면서 용해시켜 다음식과 같이 순수한 Li2CO3로 회수한다.
한편 α-spodumene을 전처리하지 않고 Na2CO3와 혼합하여 850 ℃에서 용융한 후, 황산으로 침출하여 약 99.98 %의 Li을 회수하기도 하였으며, 용융 반응은 다음과 같다16).
3.3. 염호로부터의 리튬 추출
여러 가지 리튬 화합물들은 처리비용이 저렴하여 0.06~0.15 % Li을 함유한 염호나 바닷물로부터 생산되고 있다. 염호의 간수로부터 리튬을 추출하는 방법은 간수의 조성이 다르고 입지 조건의 제약 등으로부터 여러 가지 방법이 실용화되어 있다. Table 3에는 천일 증발부터 최근까지 개발되어있는 몇 가지 기술들을 종합하여 나타내었다17).
Table 3.
Technologies for Li extraction from brine17)
Fig. 5에는 염호나 바닷물에서 Li 화합물과 기타 부산물(주로 KCl)을 생산하는 일반적인 공정도를 나타내었으며18), 일부는 아직 실험 단계에 있는 것도 포함되어 있다. 특히 리튬 배터리 산업의 확대에 따라 중국의 탄산리튬 생산량이 급격하게 증가하면서 전통적인 증발-석출법은 물론이고 이온교환, 용매 추출법, 흡착법, 멤브레인법 등에 대해서도 많은 연구가 이루어지고 있다.
간수로부터의 리튬 회수는 태양열에 의한 자연 증발에 의해 단계별로 염수 중의 NaCl, KCl, NaCl·KCl 및 기타 염류를 순서대로 침전시켜 Li을 농축시키는 공정이다. 따라서 간수 종류에 따라 단계별 석출염의 형태가 다소 다른 점을 제외하면 유사한 공정에 의해 Li을 회수한다. 이러한 방법으로 Li을 99.5~99.99 %의 Li2CO3로 회수할 수 있다18). 다만 태양열을 이용하여 리튬을 농축하므로 광석으로부터의 Li 회수보다 에너지 비용은 낮으나, 염호가 주로 고지대에 있으므로 Li을 농축하는데 1~2년의 기간이 소요된다.
Mg이 많이 함유된 염수의 경우 ~4.4 % Li까지 농축되면 침전이 시작된다. 또 태양열에 의한 증발에 의해 5.5~6.5 % Li까지 농축되면 Li2CO3나 LiCl을 제조한다. 특히 고순도의 Li2CO3나 LiCl을 제조하기 위해서는 Mg을 별도로 제거하는 것이 필요하다. 일반적으로 염수 중의 Mg 등은 Li을 회수하는 공정에서 함께 침전되므로 염수 중 Mg/Li 비가 높을수록 Li 회수에 불리한 것으로 알려져 있다19). 그리고 황산 간수는 SO4 이온의 농도가 높아 천일 증발에서는 Li을 6,000 ppm 이상으로 농축하는 것이 곤란하다. 특히 황산 간수는 Mg/Li 비율(중량비)이 높으므로 정제하기 전에 Mg/Li 비율을 0.5(Mg 2 %, Li 4 %) 이하로 할 필요가 있다. 따라서 이송된 리튬 용액에 생석회(CaO)나 가성소다를 첨가하여 식 (2), (3)과 같이 Mg을 제거한다20). 이어서 용액 중의 칼슘은 식 (4), (5)와 같이 소다회나 탄산리튬을 첨가하여 제거한다. 그리고 전기분해에 의해 금속 Li을 생산하기 위한 LiCl에서는 B을 제거하여야 한다. 용액 중의 B은 용매추출을 이용하여 제거하기도 하며, 포스코에서는 Li함유 용액에 NaOH를 첨가하여 Mg을 Mg(OH)2로 제거하고, pH를 8.5~10.5로 조정하여 B을 Mg(OH)2로에 흡착시켜 제거하는 것으로 알려져 있다21).
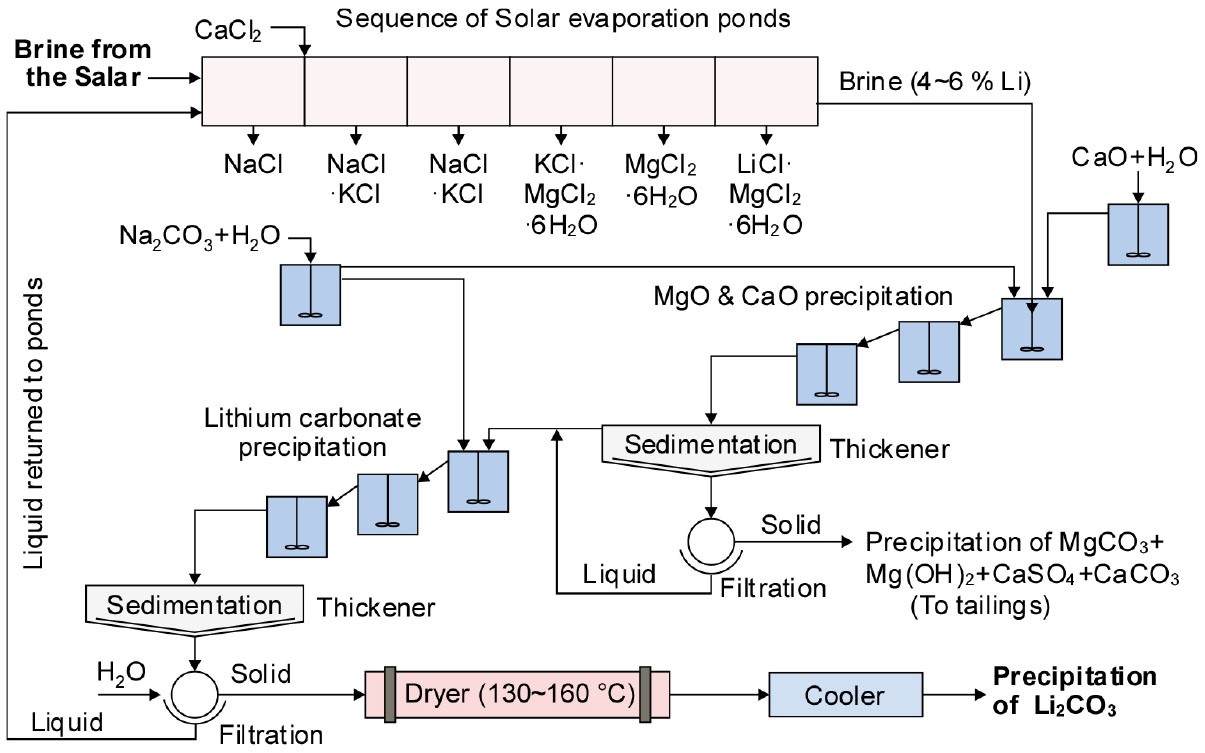
한편, Fig. 6에는 Salar 염호로부터 Li을 추출하는 Atacama방식의 공정도를 나타내었다22). 단계별로 염을 석출시킨 후의 최종 염수에는 4~6 %의 Li을 함유하며, Li2CO3를 회수하기 위한 공정으로 이송된다. 생석회나 소다회 등으로 Mg, Ca 등을 침전·제거한 후 93 ℃로 가열하고, 다시 소다회와 반응시키고 고액분리하여 고체는 건조 과정을 거쳐서 Li2CO3로 회수한다. 그리고 리튬을 회수하기 전에 이온교환으로 잔류하는 Mg, Ca 등을 제거하기도 한다.
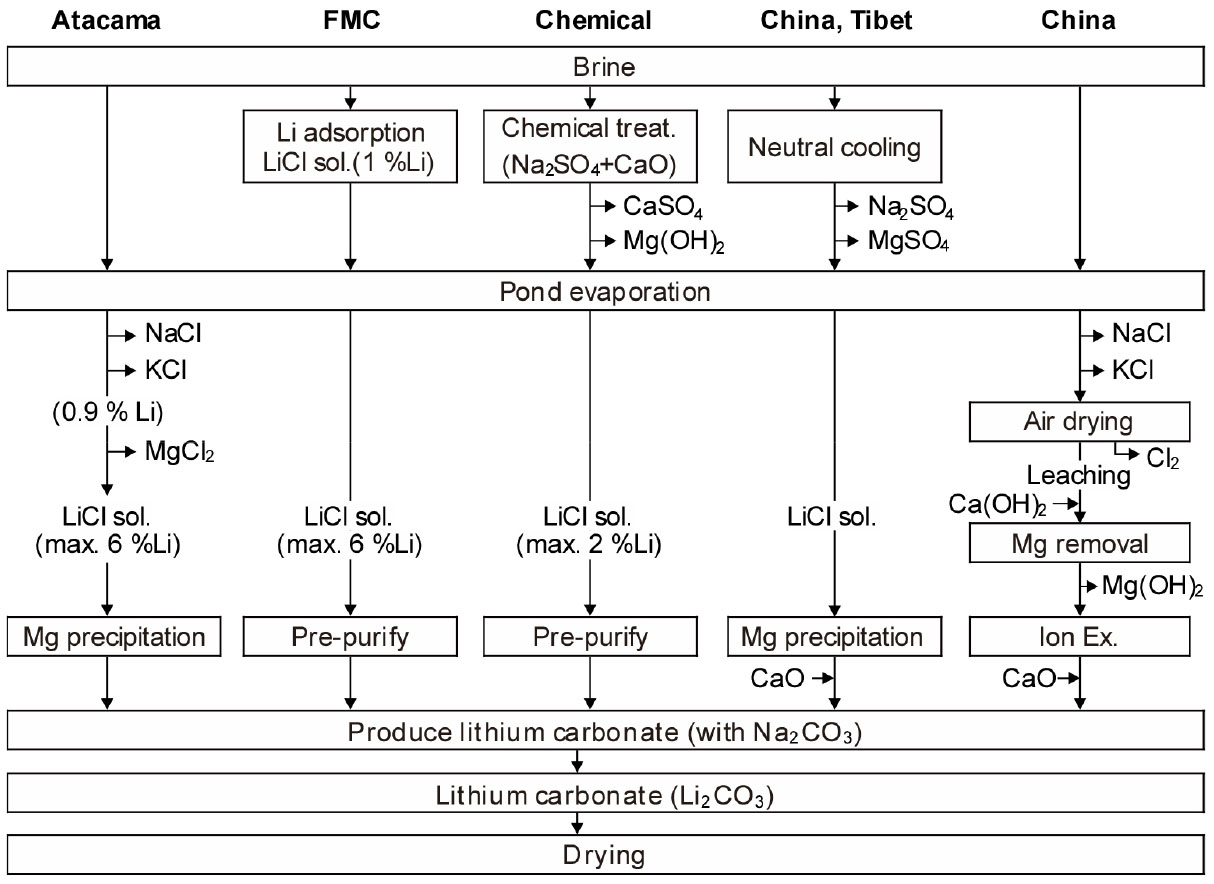
Fig. 7에는 Atacama, FMC 그리고 중국 등에서의 처리방식을 재구성하여 나타내었다23). 아르헨티나의 Hombre Muerto 염호에서는 FMC 방식을 사용하고 있으며, 온도와 pH를 조정하여 알루미나계 흡착제(선택적으로 Li을 흡착하는 것)로 Li을 1 % 정도까지 농축하고, 태양광 증발에 의해 Li을 더욱더 농축시킨다. 그 이후의 공정은 Atacama 방식과 거의 동일하다. 아르헨티나의 Olaroz 염호의 Olaroz 방식은 간수에 CaO를 첨가하여 Mg을 제거한 간수를 태양열 증발에 의해 Li을 약 1 %까지 농축시킨 간수에 소다회를 첨가하여 조탄산리튬을 생성시킨다. 그 후 CO2를 취입하면서 재용해한다. 이어서 용액을 여과한 다음 LiHCO3 용액으로부터 이온교환에 의해 Mg, Ca, B 등의 잔류 불순물을 제거하고 가열, 결정화시켜 정제된 탄산리튬을 얻는다.
한편 전해법으로 Li을 선택적으로 회수하는 방법도 연구되고 있다. 전해법은 음이온 선택 멤브레인을 사용하여 LiFePO4 전극에서 간접적으로 Li을 이동시켜 FePO4로 석출시키는 방법이다24). Fig. 8과 같이 전해 셀은 음이온 교환막에 의해 두 개의 슬롯으로 구분되어 있다. 한 슬롯에는 염수로 채워져 있고, 다른 슬롯에는 Mg2+가 없는 전해질로 채워져 있다. FePO4 양극은 염수에 장착되어 있으며, LiFePO4 음극은 Mg2+가 없는 전해질에 장착되어 있다. 외부 전위에 의해 염수 중의 Li+는 FePO4의 중간으로 들어가 LiFePO4를 생성한다. LiFePO4 음극에서는 Li+가 멤브레인 전해에 의해 Mg2+가 없는 전해질로 방출되어 FePO4를 생성하며, 반응식은 다음과 같다25).
즉, 염수 중의 FePO4는 Li+와 반응하여 LiFePO4를 생성하고, Mg2+가 없는 전해질 중의 LiFePO4는 Li+와 FePO4로 분해된다. 동시에 양이온은 음이온 교환막을 통과할 수 없으므로 전하의 균형을 유지하기 위해 음이온은 염수에서 Mg2+ 무첨가 전해질로 전달된다. 따라서 Mg2+가 없는 염수 용액에서 Li+를 선택적으로 추출할 수 있다. 이 방법으로 Mg/Li의 질량비를 493에서 0.3으로 줄일 수 있어 염수에서 마그네슘과 리튬을 효율적으로 분리할 수 있다.
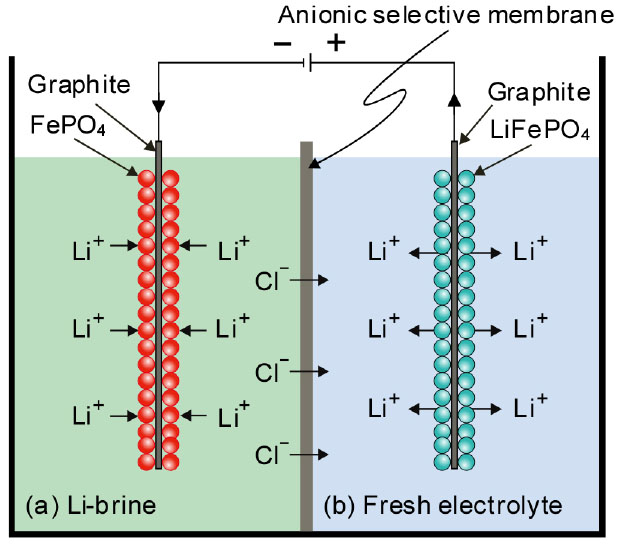
Fig. 8.
Schematic diagram of an electrolytic cell for recovery of lithium from Li-brine using LiFeO4 and FePO4 as electrodes24).
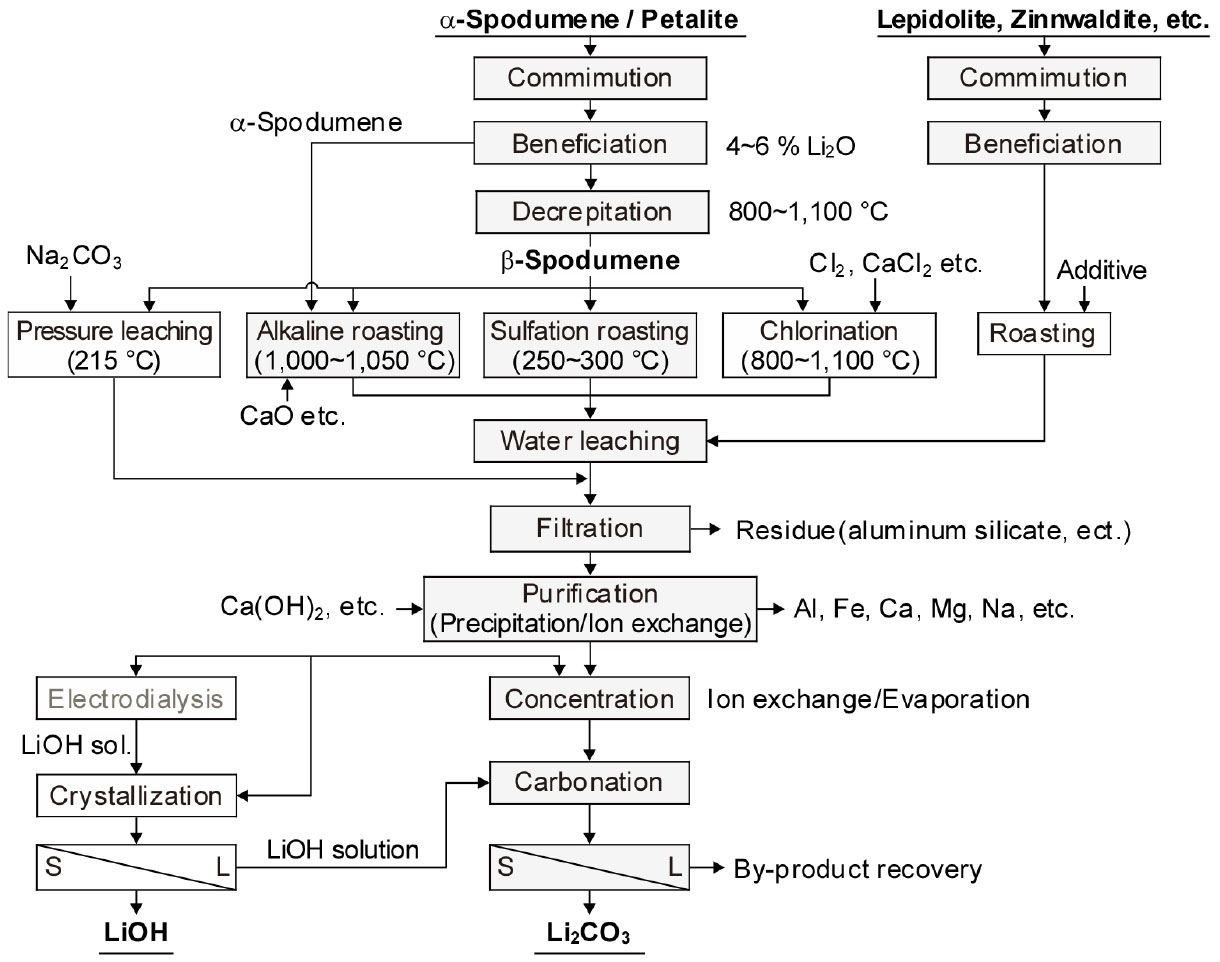
3.4. 광석으로부터의 리튬 추출
리튬 광석 중 가장 풍부한 것은 스포듀민으로 Li이 약 3.73 %(8.03 % Li2O)까지 함유되어 있으며, 그 외에도 Table 1과 같이 많은 광석들이 알려져 있다. Fig. 9에는 이러한 Li 함유 광석으로부터 Li 화합물을 제조하는 일반적인 공정도19,26)를 재구성하여 나타내었다.
광석으로부터 리튬을 추출하는 방법에는 산 처리법27)과 알칼리 처리법, 염화법 등이 알려져 있다20).
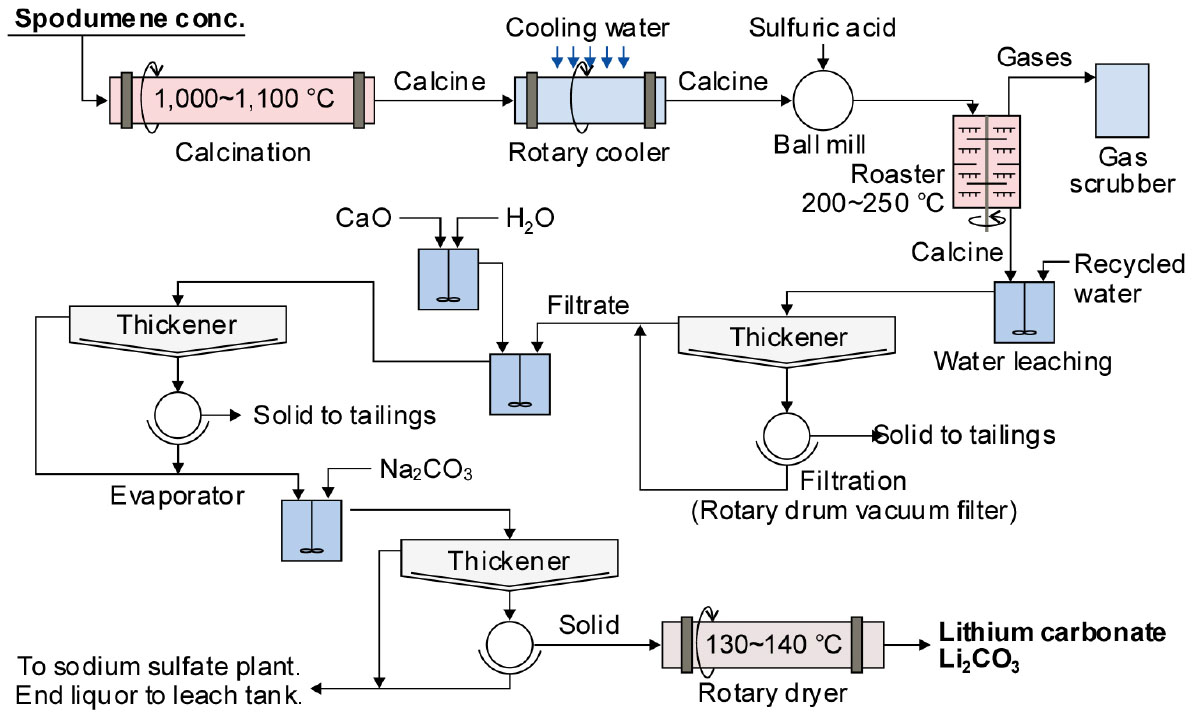
3.4.1. 산 처리법(acid process)
Fig. 10에는 스포듀민으로부터 산 처리에 의해 Li2CO3를 제조하는 공정도를 모식적으로 나타내었다28). 스포듀민의 고품위 광석은 1.35~3.56 % Li(2.9~7.7 % Li2O)이 함유되어 있으며, 선광공정을 통해 4~6 % Li2O의 정광을 만든다. Li 정광(α-spodumene)을 1,000~1,100 ℃에서 하소하여 산에 잘 용해되는 β-spodumene으로 상변화를 시키며29), 이 과정에서 표면적이 약 30 % 증가한다. 이어서 소광을 황산(93 %)과 혼합하여 200~250 ℃에서 황산화 배소를 한다. 황산화 배소를 한 후, Li2SO4(s)를 수침출하고, Li2SO4(l)는 식 (12)와 같이 Na2CO3를 첨가하여 Li2CO3로 회수한다.
3.4.2. 알칼리 처리법(alkali process)
알칼리 처리법에서는 β상의 스포듀민을 석회석이나 소다회와 함께 배소하여 식 (13), (14), (17)과 같이 리튬실리케이트를 수용성으로 변환시키고, 식 (18)과 같이 수용액 중에 CO2를 불어넣어 lithium bicarbonate로 만든다. 그리고 고액 분리한 후 소다회를 투입하고 약 90 ℃에서 수분을 증발시켜 Li2CO3를 생성시키거나, 석회석으로 중화하여 LiOH·H2O로 회수하기도 한다.
한편 중국에 있는 Galaxy Resources에서는 β상의 스포듀민을 소다회 용액과 함께 고압침출하고, 식 (18)과 같이 침출액 중에 CO2를 불어넣어 Li2CO3를 LiHCO3로 만든 후 90 ℃로 가열하여 99.5 % 이상의 Li2CO3를 얻고 있다. 이때 생성되는 CO2는 침출액을 LiHCO3로 만들 때 재사용하고 있다20).
3.4.3. 염화법(chlorination process)
공업적인 금속 Li 제조는 LiCl을 LiCl-KCl 혼합염 중에서 용융염 전해하여 만들고 있다. 따라서 염화법은 광석으로부터 이러한 금속 Li 제조를 위한 LiCl을 제조하는 것이다. Li 광석 종류에 따라 800~1,100 ℃에서 HCl, NaCl, CaCl2, Cl2(g) 등과 반응시켜 염화시켜 Li을 수용성의 LiCl로 만든다20). 레피도라이트와 NaCl 및 CaCl2의 반응은 다음과 같다(M: Li, K, Rb, Cs).
LiCl을 함유한 수용액은 산처리법과 유사한 방법으로 처리하고 있다.
3.5. 금속 리튬의 제조
금속 리튬은 Li2O, LiCl, LiOH, Li2CO3 등으로부터 전해법이나 열화학 반응으로 만들 수 있다. 공업적으로는 공정 조성을 갖는 LiCl+KCl(42 mol%, 350 ℃)의 혼합염에서 LiCl을 용융염 전해를 하여 고순도 Li을 제조하고 있다30). 400 ℃에서는 LiCl+KCl의 액상 범위가 확대(35~45 mol% KCl)되므로 400~450 ℃ 정도에서 조업하고 있다. 전해에서 각 전극에서의 반응은 다음과 같다31).
음극으로는 연강을 사용하며 액상의 Li이 석출되고, 양극으로는 흑연을 양극으로 사용하며 염소 가스가 발생한다. 이때의 전류밀도는 2 A/cm2이며, 에너지 소비량은 35 kWh/kg-Li이다.
이러한 LiCl+KCl 혼합 용융염 전해에 의한 Li 제조는 약 100년 동안 금속 Li의 공업적 제조법으로 자리매김하고 있으나, 많은 에너지를 소비하고 유독성의 염소가스가 발생하는 문제점을 가지고 있다. 따라서 이러한 문제점을 개선할 수 있는 새로운 금속 Li 제조법에 대해서도 많은 연구들이 이루어지고 있다32). Kruesi와 Fray는 Li2CO3를 공정조성의 LiCl-KCl 용융염 중에서 전해하여 염소가스 발생없이 금속 Li을 제조하였다33). Takeda 등은 LiCl-KCl이나 LiCl-KCl-CsCl의 공정조성에서 LiOH를 용융염 전해하여 금속 Li을 제조하였다34). 그 외 새로운 용융염 전해법으로는 공정조성의 LiI-CsI35), LiCl-AlCl336), LiOH-LiCl37) 등을 사용하기도 하였다.
한편 다양한 Li 화합물로부터 환원제로 C, Si, Al, Mg 등을 이용한 열화학 반응이나 열분해, 간수의 직접 전해38) 등으로 금속 Li을 제조할 수 있으며 반응식은 Table 4와 같다32).
Table 4.
Reactions for the production of lithium by thermochemical reduction, pyrolysis and electrolysis32)
4. 종 합
리튬은 전 세계 연간 생산량이 10만 톤이 되지 않으나 생산량의 약 70 % 이상이 리튬이온 배터리의 양극재로 사용되는 매우 중요한 금속이다. 특히 리튬은 호주, 남미, 중국 등 매장량이나 생산량이 지역적으로 편재되어 있는 대표적인 희소금속이다. 리튬의 약 60 % 염호에서, 나머지는 광물로부터 다양한 방법으로 만들어지고 있다. 염호 중의 리튬은 대부분 천일 증발을 이용하여 추출하고 있으나, 최근에는 이온교환, 용매추출 등 다양한 방법들에 대해 많은 연구들이 이루어져 있다. 광석으로부터의 리튬 추출은 산 용해법이나 알칼리 용해법을 이용하고 있다. 그리고 순수한 금속 리튬은 공정 조성인 LiCl-KCl의 혼합 용융염 중에서 LiCl을 용융염 전해하여 얻고 있다. 최근에는 다양한 원료로부터 열환원법이나 전해법 등으로 금속 Li을 추출하기 위한 연구들이 수행되고 있으나, 향후에는 보다 친환경적인 리튬 추출법에 대해 많은 연구들이 이루어질 것으로 생각된다. 이러한 리튬의 제련법은 리튬 2차 자원의 리사이클링 기술에 응용되고 있으므로, 리튬 제련법을 이해하여 응용한다면 새로운 리사이클링 기술 개발에 기여할 수 있을 것으로 기대된다.