1. 서 론
2. 시료 및 실험방법
2.1. 시료 및 장비
2.2. 실험방법
3. 결과 및 고찰
3.1. 바나듐-텅스텐 함유 수용액의 pH 특성 고찰
3.2. 연속식 이온교환칼럼을 이용한 바나듐/텅스텐 흡-탈착 특성 고찰
4. 결 론
1. 서 론
질소산화물 저감 기술인 선택적 촉매환원법(Selective Catalytic Reduction : SCR)은 암모니아(NH3)를 환원제로 이용하여 질소산화물을 N2와 H2O로 분해함으로써 이를 제거하는 방법으로 80~90%의 높은 탈질 효율을 나타낸다1). 2~5년의 수명을 갖는 SCR 탈질촉매는 수명이 끝난 후 매립되는데, 이 때문에 토양 오염이 발생하며 희유금속 자원이 폐기되는 문제가 발생한다. 다양한 종류의 SCR 촉매 중 상용화 촉매로서 널리 이용되고 있는 V2O5- WO3/TiO2 촉매는 V2O5와 WO3를 활성성분으로 사용하며 일반적으로 80~85%의 TiO2, 0.7~1.5% V2O5, 5~7%의 WO3를 함유하고 있다2).
바나듐은 우수한 물리화학적 특성으로 인해 철강, 화학, 항공우주, 의약, 촉매등 다양한 산업 분야에서 널리 사용된다. 특히, 재생 에너지를 효율적으로 구현하기 위한 에너지 저장 시스템(Energy Storage System, ESS)으로 RFB(Redox Flow Battery) ESS에 대한 관심이 증가하고 있는데, 이 중 VRFB(Vanadium Redox Flow Battery)는 Zn-Br, Fe-Cr과 같은 다른 원소로 이루어진 RFB와 달리 교차 오염 문제가 없다는 장점을 지니며 상업적으로 이용 가능한 배터리로써 각광받고 있다. 그러므로 바나듐은 21세기의 가장 중요한 전략적 소재 중 하나로 볼 수 있다3,4,5).
SCR 촉매의 대부분을 차지하고 있는 TiO2와 분리하여 바나듐과 텅스텐을 추출하기 위하여 소다 배소-수침출 공정이 사용되며, 주로 NaOH, Na2CO3와 NaCl을 배소제로 사용하여 바나듐과 텅스텐을 수용성인 NaVO3, Na2WO4 형태로 전환해 침출한다. 침출액으로부터 희유금속을 분리/회수하기 위하여 침전법, 용매추출법, 이온교환법 등이 사용되는데, 본 연구에서 수용액의 바나듐과 텅스텐을 분리하기 위해 사용한 이온교환법은 용액 내 금속 이온의 극성에 따라 이온교환수지의 선택이 용이하고, 금속 이온의 특성에 따라 용액 내 미량인 금속 이온의 선택적 분리가 가능하며, 특히 비슷한 화학적 특성을 가져 분리가 어려운 금속원소의 분리가 가능하다는 장점을 지닌다6). Yang 등은 SCR 탈질폐촉매 침출액에서 약염기성 음이온 교환수지 DEX-V를 사용하여 강염기 조건에서 바나듐과 텅스텐을 동시에 흡착 후 탈착시킨 용액으로부터 바나듐을 암모늄메타바나데이트((NH4)2VO3, ammonium metavanadate)로 선택적 침전시켰으며, 바나듐이 제거된 용액으로부터 텅스텐을 APT로 회수하여 분리하는 연구를 보고하였다2). 또한 Wu 등은 강염기성 음이온 교환수지 Amberlite IRA900을 사용하여 SCR 탈질폐촉매 침출액으로부터 강염기 조건에서 텅스텐을 선택적으로 흡착함으로써 바나듐과 분리하여 98% 순도의 텅스텐 수용액으로 회수하는 연구를 수행하였다7). 이처럼, SCR 탈질폐촉매 침출액에서 침전법으로 바나듐과 텅스텐을 분리하는 연구와 이온교환법으로 텅스텐을 흡착함으로써 바나듐과 분리하는 연구는 선행되어왔지만, 바나듐과 텅스텐 각 이온들의 흡/탈착 거동 특성에 대한 연구보다는 선택적 분리에 대한 연구가 주된 내용들이었다. 그러므로 이온교환법을 이용하여 바나듐과 텅스텐을 선택적으로 분리할 때, 각 원소들의 흡/탈착 거동 특성에 대한 많은 연구는 이루어지지 않았다.
본 연구진은 이전 연구 결과에서 회분식 흡착반응기를 사용하여 강염기성 음이온 교환수지인 MP 600을 통해 바나듐과 텅스텐의 흡착 특성을 알아보았으며, 수용액 pH 8.5에서 바나듐을 선택적으로 흡착함으로써 텅스텐과 분리할 수 있었다. 또한 HCl과 NaOH의 농도에 따른 탈착률을 확인한 결과, NaOH 탈착용액에서는 바나듐과 텅스텐이 모두 탈착되었으나, HCl 탈착용액에서는 바나듐만 선택적으로 탈착됨을 확인하였다8). 그러나 회분식 반응기는 주로 흡착제-흡착물 계의 타당성을 분석하기 위하여 사용되며, 미량의 흡착물을 지닌 소량의 수용액을 처리하는데 사용되므로 실제 산업에서 거의 사용되지 않는다. 반면 연속식 반응기는 다량의 흡착물을 지닌 많은 양의 수용액을 처리하는데 사용되기 때문에 산업적 목적으로 폭넓게 적용될 수 있다9). 그러므로 본 연구에서는 이전의 회분식 연구 결과를 바탕으로, 연속식 이온교환칼럼(Ion-exchange column)을 사용하여 수용액 pH 8.5에서의 바나듐과 텅스텐의 흡·탈착 거동을 알아보고, 바나듐과 텅스텐의 분리를 위한 연속식 이온교환칼럼 운전조건을 제시하고자 하였다.
2. 시료 및 실험방법
2.1. 시료 및 장비
본 연구에서 바나듐/텅스텐 분리거동을 고찰하는데 기준물질로 선정한 SCR 탈질폐촉매는 화력발전소에서 발생한 허니컴 형태의 폐촉매로서, 그 조성은 Table 1과 같다. 이와 같은 폐촉매를 100 μm 미만으로 분쇄하여 NaOH를 배소제로 800°C에서 6시간 동안 배소한 후, 증류수로 침출하면 바나듐과 텅스텐을 함유한 침출액을 얻을 수 있다. 이렇게 얻은 침출액의 바나듐 함량은 1,000~1,100 mg/L, 그리고 텅스텐 함량은 10,000~11,000 mg/L이며, 바나듐과 텅스텐 이온의 농도비는 약 1 : 10 정도가 된다8). 그러므로 본 연구에서는 바나듐 1,000 mg/L, 텅스텐 10,000 mg/L 함량을 갖는 모의용액을 제조하여 바나듐과 텅스텐의 분리거동 실험을 수행하였다.
Table 1.
Elemental composition of spent SCR catalyst
| Component | Al2O3 | WO3 | V2O5 | TiO2 | CaO | MgO | MoO3 | Fe2O3 |
| wt. % | 3.36 | 6.74 | 1.19 | 69.7 | 3.08 | 0.33 | 0.14 | 0.37 |
바나듐/텅스텐 흡·탈착 실험에 사용한 이온교환수지는 Lanxess사에서 제조된 다공성의 강염기성 음이온교환수지 Lewatit monoplus MP 600이며 해당 이온교환수지의 특징을 Table 2에 나타내었다. 이온교환수지를 통한 바나듐과 텅스텐의 분리를 위하여 sodium metavanadate (NaVO3, ALDRICH, 99.9%)와 sodium tungstate dehydrate (Na2WO4·H2O, SAMCHUN, ≥98.0%)를 증류수에 용해시켜 각 실험에 따른 농도로 모의 용액을 제조하여 흡착실험에 사용하였으며, 염산(HCl, SAMCHUN, 35.0~37.0%)을 2M 농도로 제조하여 탈착실험에 사용하였다. 탈착 후 용액에서 바나듐을 회수하기 위하여 ammmonium chloride (NH4Cl, Junsei)를 침전제로 사용하였다.
Table 2.
Typical chemical and physical characteristics of MP 600
모의용액과 흡·탈착 후 유출액(effluent)의 바나듐과 텅스텐 농도는 ICP-AES(inductively coupled plasma atomic emission spectroscopy, Optima 8300, PerkinElmer)를 통해 분석하였으며 흡착 전, 후의 이온교환수지의 구조변화를 FTIR spectrometer(Fourier transform infrared, Cary 63, Agilent Technologies)를 통하여 분석하였다. 또한 침전하여 회수한 바나듐의 성분 구조를 XRD(X-ray diffractometer, Rigaku)로 분석하였다.
2.2. 실험방법
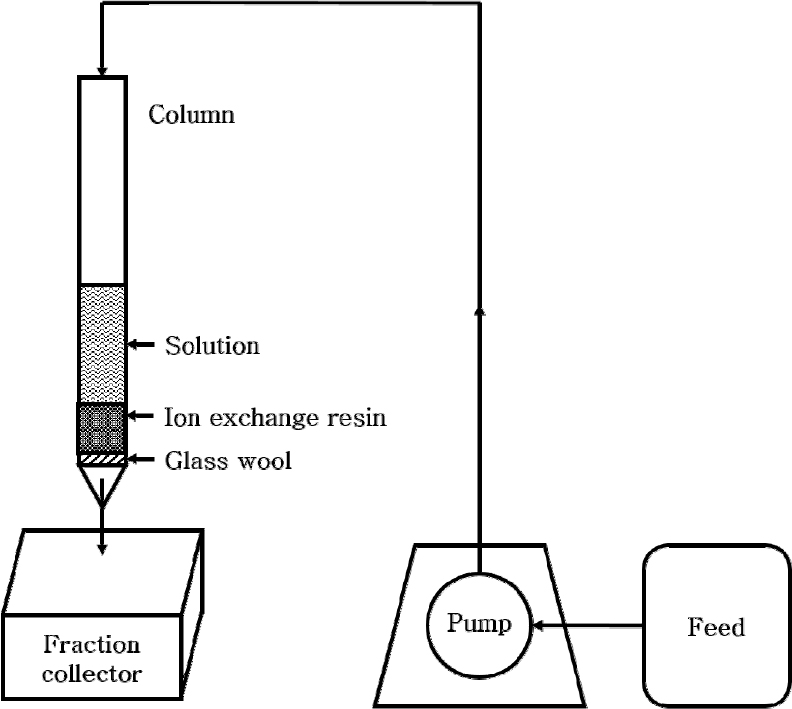
반응기 형태에 따른 바나듐과 텅스텐의 흡착특성을 알아보기 위하여, 회분식과 연속식 흡착반응기를 사용하였다. 회분식 반응기에서 수용액 pH에 따른 바나듐과 텅스텐의 흡착특성을 평가하기 위해 250 mL Pyrex를 반응기로 사용하여 항온진탕기(Shaking incubator, SI-600R, JEIO TECH)에 25°C의 등온조건에서 200 rpm의 교반속도로 24시간동안 흡착실험을 수행하였다. 연속식 반응기에서 바나듐과 텅스텐의 흡·탈착특성을 평가하기 위하여 내경 1.5 cm, 외경 4 cm, 길이 35 cm인 칼럼 형 반응기에 이전 연구의 회분식 실험 결과에 따라 이온교환수지 5 mL를 채워 용액을 공급하였다. 용액을 일정한 속도로 공급하기 위하여 튜빙펌프(Tubing pump, Masterflex L/S, Cole- Parmer)를 사용하였으며, 일정 간격으로 유출액을 채취하기 위하여 자동분획기(Fraction collector, RetrieverⓇ500, Teledyne ISCO)를 사용하였다. 흡착실험에 사용한 바나듐, 텅스텐 함유 수용액은 H2SO4와 NaOH로 pH를 조절하여 안정화가 된 후 사용하였다. 칼럼 반응기에서 흡착실험을 수행할 때 용액이 공급되는 속도가 너무 빠르다면 이온교환수지와 반응이 일어날 시간이 충분하지 않아 흡착을 저해한다8). 그러므로 공급 속도 변화에 따른 이온교환반응을 알아본 결과, 15 mL/h의 속도로 용액을 공급할 경우 이온교환반응이 일어나기에 충분하였으며, 이보다 낮은 속도로 공급하는 경우에도 동일한 거동을 보였기 때문에, 해당 속도로 용액을 공급하여 흡착실험을 수행하였다. 흡착 후 채취한 유출액에서 바나듐의 농도가 공급액의 농도와 동일해질 때 흡착실험을 종료하였고, 흡착 실험 후 증류수로 이온교환수지를 세척하여 2M HCl을 15 mL/h의 속도로 공급하여 바나듐을 탈착하였다. 탈착용액의 공급 속도 또한 흡착 속도와 같이 15 mL/h 보다 낮은 속도에서도 동일한 탈착 거동을 보이는 것을 확인하였다. 그 후, 탈착 용액으로부터 바나듐을 회수하기 위하여 암모니아수를 첨가하여 pH를 조절한 후 NH4Cl을 2당량 첨가하여 바나듐을 침전하였다. 해당 연속식 실험 시스템을 Fig. 1에 나타내었다.
3. 결과 및 고찰
3.1. 바나듐-텅스텐 함유 수용액의 pH 특성 고찰
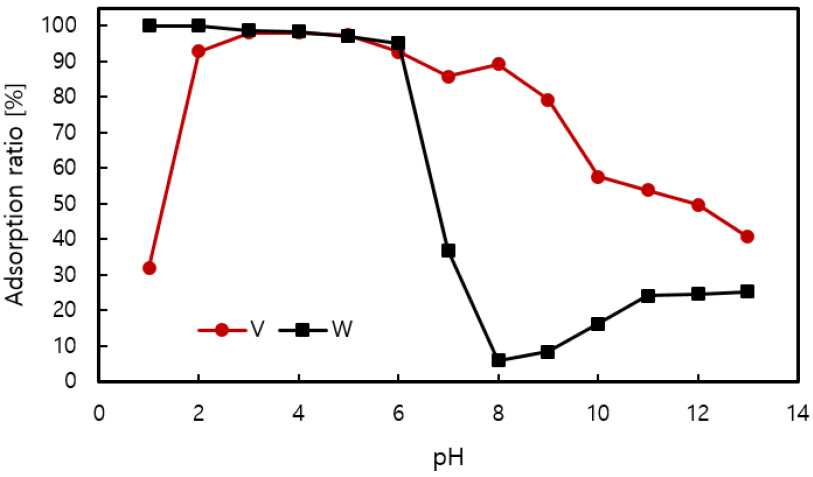
바나듐과 텅스텐 함유 수용액의 초기 pH는 이온교환수지에 의한 바나듐과 텅스텐의 흡착거동에 많은 영향을 미친다. 이전 연구 결과에서 나타내었듯이8), 바나듐과 텅스텐은 용액의 초기 pH에 따라 용액 내 이온의 형태가 달라지므로, 수용액 pH는 흡착 성능에 영향을 미치는 중요한 변수로 작용한다. Fig. 2에 나타낸 바나듐과 텅스텐이 동일 농도일 때 용액의 pH에 따른 바나듐과 텅스텐 혼합용액에서의 흡착률에 따르면, 수용액 pH 8 부근에서 텅스텐은 현저히 낮은 흡착률을 보였으므로 수용액 pH 8 전후에서는 MP 600으로 바나듐을 선택적으로 흡착할 수 있었다8).
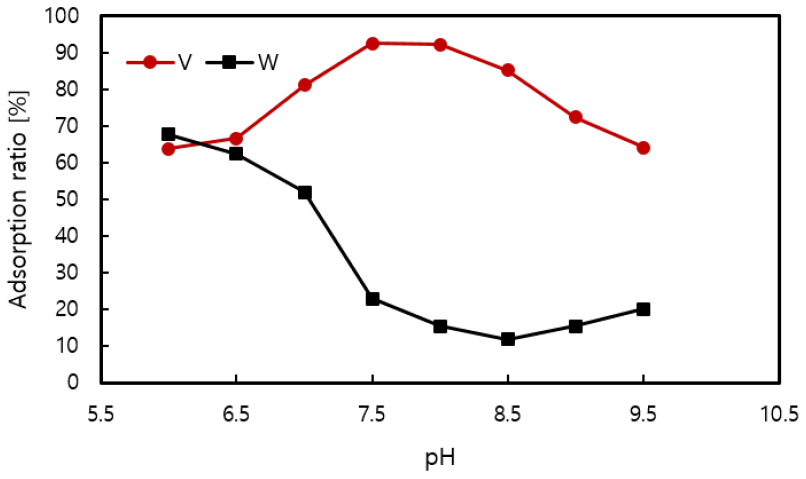
또한 바나듐과 텅스텐의 농도비가 1:10인 수용액에서 수용액 pH 변화에 따른 바나듐과 텅스텐의 흡착거동(Fig. 3 참조)도 Fig. 2와 비슷한 거동을 보여주고 있다. 따라서 바나듐과 텅스텐의 농도비가 1:10 정도 되는 폐촉매 배소산물의 수침출 용액에서도 수용액 pH를 조절함으로써 바나듐의 선택적 흡착이 가능함을 재확인할 수 있었다8). 그러므로 이러한 결과들로부터 텅스텐의 흡착을 가장 억제할 수 있는 수용액 pH 8.5에서 칼럼 반응기를 통해 바나듐과 텅스텐을 분리하는 연구를 수행하였다.
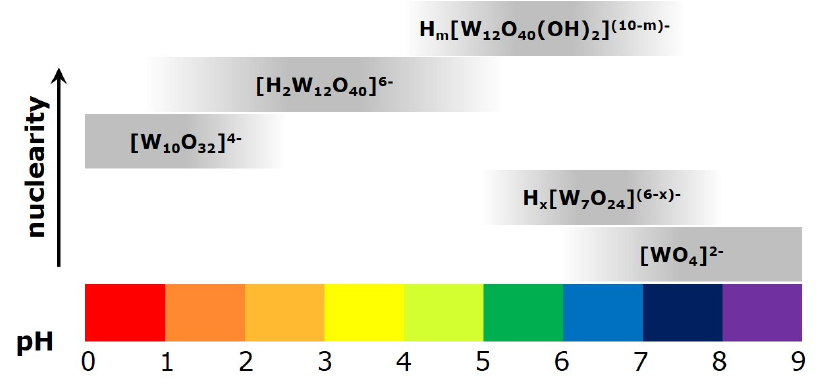
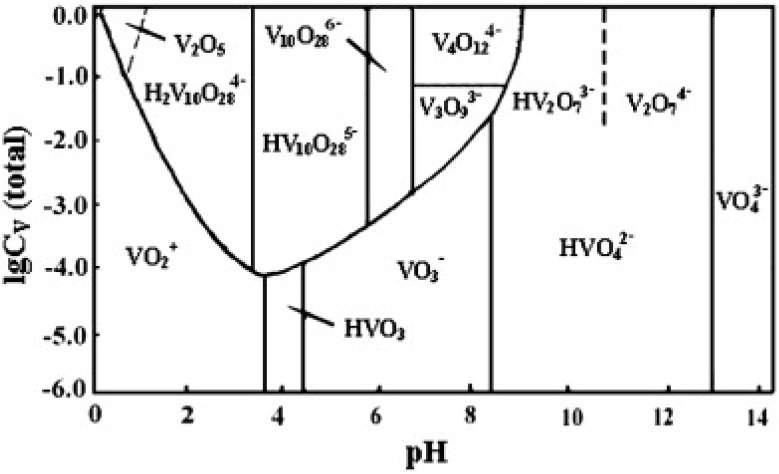
이처럼 수용액 pH 7 이상에서 텅스텐의 흡착률이 감소하는 것은 수용액 pH가 6에서 7로 증가하면서 텅스텐의 이온 형태가 변하기 때문이다. Fig. 4에 나타낸 수용액 pH에 따른 텅스텐 폴리옥소메탈레이트(polyoxometalate) 이온 형태를 보면, 텅스텐은 pH 7 이상에서 WO42-형태로 존재한다. 반면 Fig. 5에 나타낸 수용액 pH에 따른 바나듐 이온 형태에 따르면, 흡착 실험에 사용한 용액의 바나듐 농도 범위에서(log CV(total) = -2 ~ -1.7)는 pH 7~9일 때 V3O93-형태로 존재하며 이후의 pH에서도 바나듐 이온은 3가 이상의 전하로 존재한다. 따라서 pH 7 이상에서 바나듐 이온의 전하가 텅스텐 이온보다 크기 때문에 MP 600에 대한 바나듐의 친화도(affinity)가 텅스텐보다 커지며, 따라서 바나듐과 텅스텐의 흡착률 차이가 발생하였다고 결론을 내린 바 있다8). 그러므로 회분식 연구결과로부터 수용액 pH 8.5에서 바나듐과 텅스텐의 친화도 차이로 인해 텅스텐의 흡착이 저해되는 특성을 이용하면, 연속식 반응기에서 바나듐을 선택적으로 흡착함으로써 텅스텐과 분리할 수 있다.
3.2. 연속식 이온교환칼럼을 이용한 바나듐/텅스텐 흡-탈착 특성 고찰
3.2.1. 흡착 특성
파과곡선(breakthrough curves)은 주어진 조건에서 칼럼에 대한 파과용량(breakthrough capacity)을 결정하는데 중요한 자료를 제공하기 때문에 일반적으로 이온교환칼럼 공정을 설명하는데 많이 이용되고 있다. 파과곡선에서 흡착 거동은 공급되는 용액 내 흡착이온의 농도(C0)와 흡착 후 유출액 내 흡착이온의 농도(C)비인 C/C0로 표현되며 해당 값이 1에 도달하였을 때를 흡착 평형에 도달하였다고 한다. 또한 공급 용액에 대한 흡착 농도 그래프를 적분함으로써 얻은 파과곡선의 아래 영역을 통해 총 흡착된 이온의 양(최대 칼럼 용량)을 구할 수 있으며 이는 식 (1)과 같이 표현된다. 이 때 q0는 흡착 용량[mg/(g of resin)]이고 VT는 시간 t에서 유출액의 부피[mL], m은 이온교환수지의 양[g]이다10).
회분식 반응기를 이용한 이온교환수지에 대한 금속이온 흡착은 흡착 중 연속적인 샘플 채취가 어려워 정확한 흡착 거동을 알 수 없다. 그러므로 본 연구에서는 연속식 이온교환칼럼을 이용하여 흡착시간에 따른 바나듐과 텅스텐의 흡착거동을 고찰함으로서, 바나듐과 텅스텐 대한 MP 600 이온수지의 정확한 흡착 용량과 바나듐, 텅스텐의 흡/탈착 과정을 알아보고자 하였다.
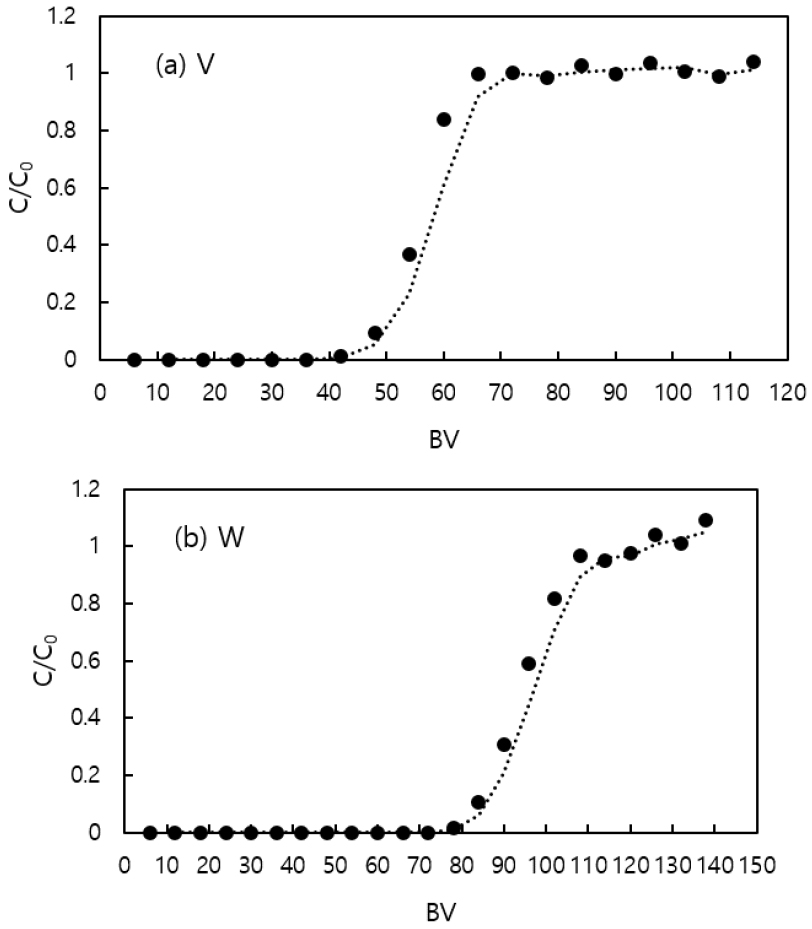
이온교환칼럼에서 수용액 pH 8.5일 때 바나듐과 텅스텐 단일 이온 용액의 흡착 거동을 알아보기 위하여 이온교환수지 5 mL를 채운 칼럼에 각각 이온의 농도가 1000 mg/L이고 pH 8.5로 조절한 바나듐과 텅스텐 단일 이온 용액을 15 mL/h의 속도로 공급하여 얻은 파과곡선을 Fig. 6에 나타내었다. 이 때, BV(Bed Volumne)은 칼럼에 충진된 이온교환수지와 동일한 수용액 부피를 의미하므로 본 실험에서 1BV은 5 mL와 같다. Fig. 6과 같이 단일 이온 용액으로 흡착실험을 수행하는 경우, 회분식 실험의 결과와 같이8) 수용액 pH8.5에서 바나듐과 텅스텐 모두 MP 600에 흡착되었다. Fig. 6에 나타낸 바나듐과 텅스텐의 파과 곡선에 따르면 바나듐은 42 BV, 텅스텐은 78 BV부터 파과가 시작되어, 각각 66 BV와 126 BV에서 C/C0가 1이 되며 평형에 도달하였다. MP 600에 대한 바나듐과 텅스텐의 흡착용량은 각각 44.75 mg/(g of resin)과 64.92 mg/(g of resin)으로 바나듐보다 텅스텐의 흡착 용량이 크게 나타났다. 이는 3.1 절에서 설명한 바와 같이, 수용액 pH 8.5에서 바나듐과 텅스텐 이온은 각각 3가와 2가로 존재하며, 따라서 하나의 금속 이온과 교환되는 Cl- 이온의 수가 각각 3개와 2개로 차이가 나기 때문에 동일한 이온교환수지 양에 대하여 바나듐이 흡착되는 양이 더 적은 것으로 사료된다.
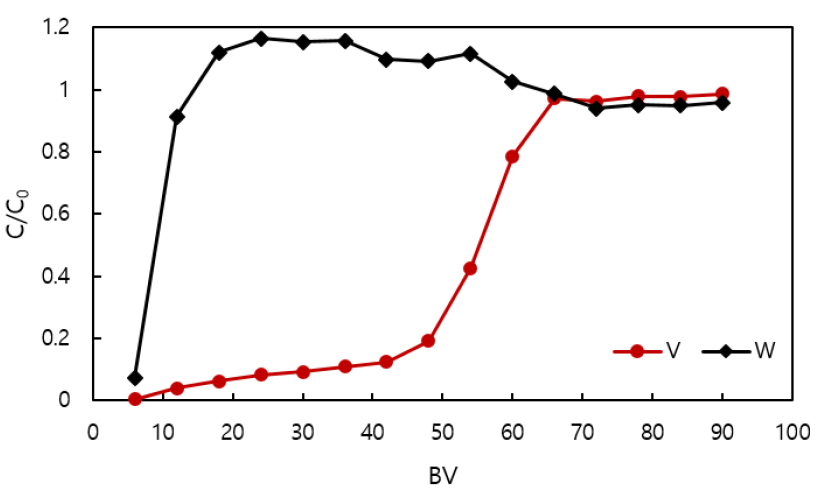
이온교환칼럼에서 수용액 pH 8.5일 때 MP 600에 대하여 바나듐이 텅스텐에 비해 친화도(affinity)가 높음을 재확인하기 위하여, 텅스텐 농도 1,000 mg/L 단일 이온 용액을 이온교환칼럼에 통과시키면서 텅스텐을 흡착시킨 이온교환수지 5 mL에 바나듐 단일 이온 용액 1,000 mg/L를 15 mL/h 속도로 공급하여 얻은 파과 곡선을 Fig. 7에 나타내었다. Fig. 7과 같이 바나듐은 36 BV부터 파과가 시작되어 66 BV에서 평형에 도달하였으며, 이는 Fig. 6 (a)에 나타낸 바나듐의 흡착 거동과 거의 유사하다. 반면 텅스텐의 경우 바나듐이 공급됨에 따라 탈착되는 거동을 보였으며, 바나듐이 파과가 시작되는 시점부터 탈착양이 감소하다 평형에 도달하는 66 BV부터는 탈착량이 0에 근접하였다. 이는 바나듐이 공급됨에 따라 이온교환수지에 흡착된 텅스텐이 친화도가 큰 바나듐과 교환되기 때문이며, 이로부터 수용액 pH 8.5에서 MP 600에 대하여 텅스텐 보다 친화도가 큰 바나듐이 우선 흡착됨을 알 수 있다.
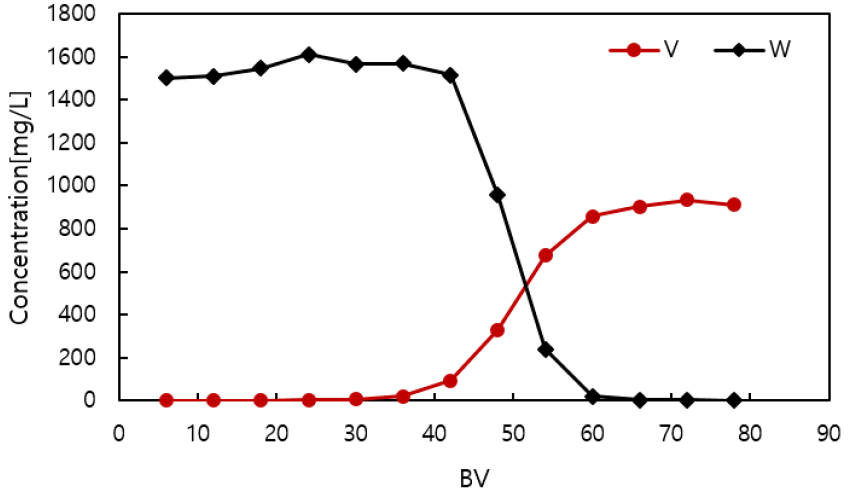
SCR 탈질 폐촉매 침출액과 동일한 농도로 제조한 수용액 pH 8.5의 바나듐 농도 1,000 mg/L, 텅스텐 농도 10,000 mg/L 혼합용액을 MP 600 5 mL를 채운 이온교환칼럼에 15 mL/h 속도로 공급하여 얻은 파과 곡선을 Fig. 8에 나타내었다. Fig. 8과 같이 텅스텐은 빠르게 파과가 진행되어 18 BV에서 평형에 도달하였고, 바나듐은 흡착 시작 후 10 BV부터 용출 양이 서서 증가하다 50 BV 이후에서 급격히 용출되면서 66 BV에서 평형에 도달하였다. 바나듐의 전체적인 흡착거동은 Fig. 6의 단일 용액에서의 결과와 비슷하였지만 42 BV까지 0에 가까운 값을 보이다 파과가 시작된 것과 달리 혼합용액에서는 이보다 빠른 12 BV에서 48 BV까지 용출이 서서히 증가하다가 그 이후로 급격히 파과가 진행되는 거동을 보였다. 텅스텐의 경우 평형에 도달한 후인 18 BV에서 60 BV까지는 C/C0가 1이 넘는 값을 보이는데 이는 Fig. 7과 같이 평형에 도달하기까지 바나듐과 동시에 흡착되었던 텅스텐이 연속하여 공급되는 바나듐과 교환되며 탈착되어 공급되는 텅스텐과 합쳐져서 떨어져 나오기 때문이라고 사료된다. 이 때 바나듐의 흡착 용량은 48.72 mg/(g of resin)으로 단일 용액에서의 흡착 용량과 비슷한 값을 나타내었으며 흡착평형까지 80%의 흡착률을 보였다. 반면 텅스텐의 경우 이온교환수지에 흡착된 양이 거의 0에 근접하였다. 이로부터 수용액 pH 8.5에서 바나듐이 이온교환수지에 우선 흡착되고 이 과정에서 이온교환수지에 흡착된 텅스텐과 교환이 일어나며 텅스텐을 탈착하는 두 현상에 의해 바나듐과 텅스텐의 분리가 이루어진다고 사료된다.
3.2.2. FTIR
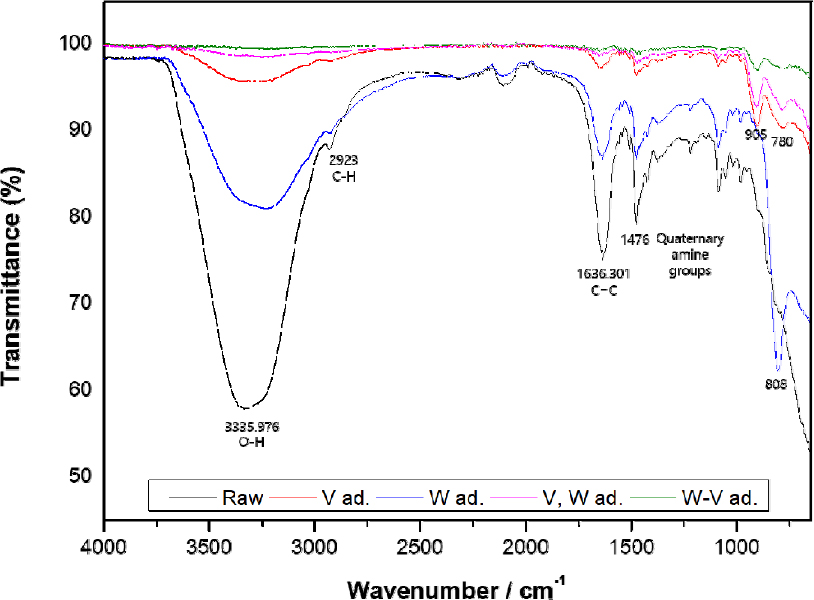
MP 600에 대한 바나듐과 텅스텐의 흡착을 확인하기 위하여, Figs. 6,7,8에 나타낸 흡착 실험 후 세척하여 건조한 이온교환수지를 FTIR로 분석하여 Fig. 9에 나타내었다. 흡착 전 이온교환수지에 나타난 3335 cm-1의 넓은 피크는 물을 흡착하며 생긴 O-H 결합이며 1464 cm-1에서 1482 cm-1까지의 피크는 이온교환수지 작용기인 quaternary amine groups이다. 또한 1636 cm-1에 나타낸 피크는 이온교환 수지의 벤젠 고리의 aromatic C=C 결합이고 2923 cm-1에 나타낸 피크는 이온교환수지의 polystyrene 구조의 C-H 결합이다13,14). 단일용액에서 흡착 전후의 이온교환수지를 비교하였을 때, 바나듐을 흡착한 경우 905 cm-1와 780 cm-1에 피크가 생성되었으며 텅스텐을 흡착한 경우 808 cm-1에 피크가 생성되었다. 이로부터 각각의 피크가 바나듐과 텅스텐이 이온수지와 결합된 것임을 알 수 있다. 텅스텐을 흡착시킨 이온교환수지에 바나듐을 흘려준 경우와 혼합용액으로 흡착실험을 수행한 결과 모두 바나듐 단일용액의 결과와 같은 spectra를 보이며 텅스텐 흡착 시 나타난 808 cm-1 피크를 나타내지 않았는데, 이는 Fig. 8의 파과곡선으로부터 계산한 텅스텐의 흡착 용량이 0과 근사하는 것과 부합한다. 이로부터 pH 8.5에서 MP 600으로 바나듐과 텅스텐을 분리할 수 있음을 확인하였다.
3.2.3. 탈착
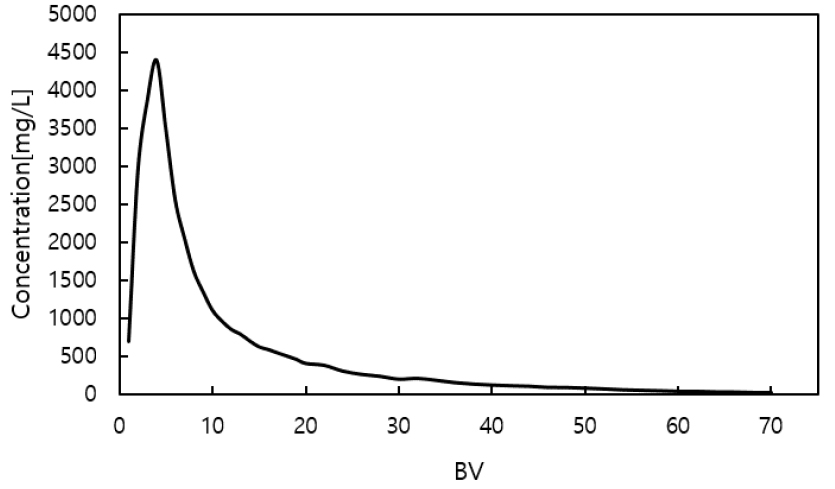
이전 연구의 HCl의 농도에 따른 탈착률을 비교한 결과로부터 바나듐 탈착률이 가장 높았던 2M HCl로 탈착을 수행하였다8). 흡착 후 증류수로 세척한 이온교환수지에 15 mL/h 속도로 HCl을 공급하여 탈착 실험을 수행한 결과를 Fig. 10에 나타내었다. Fig. 10과 같이 바나듐의 농도는 빠르게 증가하다 4 BV에서 약 4400 mg/L로 최고점에 도달한 후 서서히 감소하는 거동을 보이다 45 BV부터 100 mg/L이하로 감소하였으며 70 BV까지 흡착된 바나듐의 약 97.7%가 99%의 순도로 탈착되었다.
3.2.4. 침전에 의한 바나듐의 회수
이온교환수지를 통해 바나듐을 흡착한 후 HCl로 탈착한 용액에서 바나듐을 회수하기 위해 탈착용액에 염화암모늄을 첨가하여 바나듐을 침전시켰다. 염화암모늄으로 바나듐을 침전하는 경우 pH 9~10의 알칼리 영역에서는 암모늄메타바나데이트(ammonium metavanadate, NH4VO3) 형태로 침전이 일어나지만 pH 2~8의 산성영역에서는 80°C 이상의 고온에서 식 (2),(3),(4)와 같이 연속적인 반응경로를 따르는 수열반응(hydrothermal reaction)에 의하여 암모늄폴리바나데이트[ammonium polyvanadate, (NH4)2V6O16· 1.5H2O]로 침전된다15).
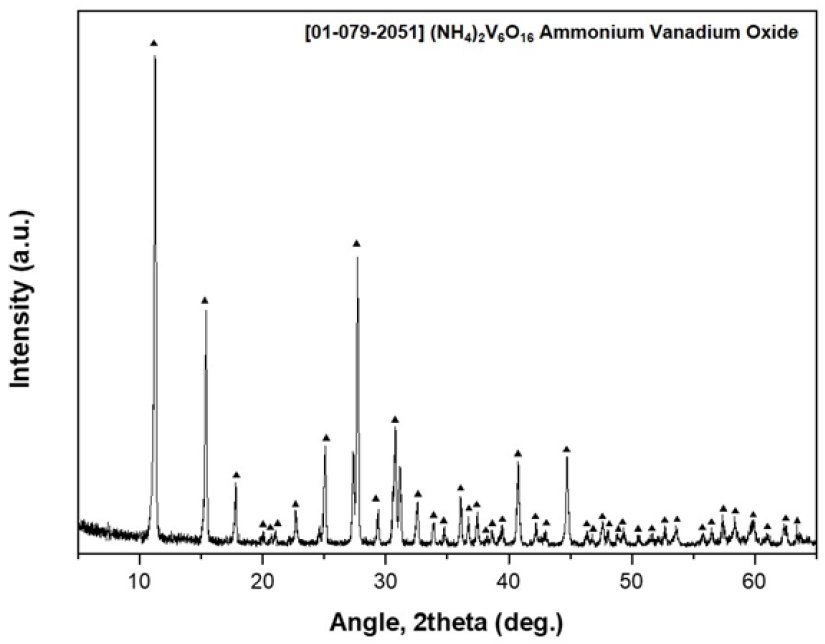
이온교환수지로부터 2M HCl로 바나듐을 탈착한 용액의 pH는 –0.3으로 Fig. 5에 따라 바나듐이 양이온으로 존재하기 때문에 침전이 발생하지 않았다. 또한 해당 그래프에 따르면, 3.2.3 절에서 얻은 탈착용액의 바나듐 농도는 약 700 mg/L로 해당 농도에서 바나듐이 침전반응을 시작하는 [H2V10O23]2- 이온으로 존재하기 위해서는 수용액의 pH가 1.5 이상이여야 함을 알 수 있다. 그러므로 암모니아수(NH4OH)를 첨가하여 바나듐이 [H2V10O23]2- 이온형태로 존재하도록 수용액 pH를 2로 조절하였고, 연속하여 염화암모늄 2당량을 첨가하여 90°C에서 2시간 동안 반응한 결과 93%의 침전률을 갖는 바나듐 침전물을 얻을 수 있었다. Fig. 11과 Fig. 12는 침전하여 회수된 바나듐 침전물과 XRD 분석결과를 나타내고 있는데, 바나듐 침전물은 주황색을 띠고 있으며, XRD 분석결과 침전물은 암모늄폴리바나데이트[(NH4)3V6O16]결정 구조를 가지고 있으며, 따라서 본 연구조건에서는 암모늄폴리바나데이트 형태로 바나듐이 회수되었음을 확인하였다.
이로써, 이온교환수지를 통한 바나듐과 텅스텐의 분리와 침전법으로 바나듐을 회수하는 공정을 통하여 SCR 폐촉매로부터 얻은 침출액 모의용액으로부터 약 73%의 바나듐을 회수할 수 있었다.
4. 결 론
연속식 이온교환칼럼 반응기에서 강염기성 음이온 교환수지 MP 600으로 바나듐과 텅스텐의 흡/탈착 거동과 바나듐 회수를 위한 침전 연구를 통하여 다음과 같은 결론을 얻을 수 있었다.
1. 칼럼 반응기에서 수용액 pH 8.5인 바나듐과 텅스텐 단일 이온 용액을 15 mL/h의 속도로 공급하여 흡착실험을 수행한 결과, 바나듐과 텅스텐 모두 흡착이 이루어졌으며 흡착용량은 바나듐 44.75 mg/(g of resin)과 텅스텐 64.92 mg/(g of resin)으로 바나듐보다 텅스텐의 흡착용량이 크게 나타났다.
2. 수용액 pH 8.5일 때 MP 600에 대하여 바나듐이 텅스텐보다 친화도(affinity)가 높으며, 따라서 텅스텐이 흡착된 이온교환수지에 바나듐 함유 수용액이 공급됨에 따라 이온교환수지에 흡착되었던 텅스텐이 바나듐과 교환되며 탈착되는 거동을 보였다.
3. SCR 탈질 폐촉매 침출액과 동일한 농도로 제조한 바나듐과 텅스텐 혼합용액으로 연속식 실험을 수행한 결과, 바나듐의 흡착 용량은 48.72 mg/(g of resin)으로 공급량의 80%가 흡착된 반면 텅스텐의 경우 이온교환수지에 흡착된 양이 거의 0에 근접하며 바나듐과 텅스텐의 분리가 효과적으로 이루어졌다.
4. 2M HCl을 15 mL/h 속도로 공급하여 탈착실험을 수행한 결과, 약 97.7%의 바나듐이 탈착되었으며 이때 순도는 99%이었다. 해당 탈착 용액의 pH를 암모니아수로 조절한 후 염화암모늄을 침전제로 90°C에서 암모늄폴리바나데이트 형태로 침전시켜 93%의 바나듐을 회수하였다.
5. SCR 폐촉매로부터 얻은 침출액의 바나듐과 텅스텐과 같은 농도의 수용액으로부터 이온교환수지를 사용하여 바나듐과 텅스텐을 분리하고 침전시키는 공정을 통해 약 73%의 바나듐을 회수할 수 있었다.