1. 서 론
2. 기존 습식 재활용 연구 동향
2.1. 강산(무기산) 활용 LFP로부터 리튬 침출 연구동향 분석
2.2. 약산(유기산) 활용 LFP로부터 리튬 침출 연구동향 분석
2.3. 강산화제 활용 LFP로부터 리튬 침출 연구동향 분석
2.4. 염 활용 LFP로부터 리튬 침출 연구동향 분석
3. 결 론
4. 제 언
1. 서 론
리튬계 이차전지(Li-ion 배터리)는 1991년에 상용화된 이래로 다양한 전자제품에 빠지지 않고 사용되고 있으며, 최근의 탄소중립이라는 화두로 친환경 에너지 사용이 강조되면서 더욱더 핵심 부품으로 주목받기 시작하였다. 최근 주요 선진국을 필두로 하여 탄소 배출량 및 연비 등 내연기관 자동차에 대한 국제적 환경규제가 심화되고 있으며, 이에 따라 전기자동차 보급 확대 정책과 연계되어 관련 시장이 성장하고 있다. 특히 친환경 산업의 주축으로 리튬계 이차전지의 전기자동차 도입은 세계 경제 패권을 다투는 경쟁 산업이 될 만큼 전략산업으로 자리를 잡아가고 있다.
이차전지 전문 시장조사 기관인 SNE리서치에 따르면, 2017년 전체 자동차판매 규모 대비 전기자동차의 비중은 약 1%에서 2022년 약 13%까지 상승하였다고 보고하였다. 이에 따라 전기자동차용 이차전지 수요는 2020년 약 143 GWh에서 2030년 약 3,257 GWh까지 크게 성장할 것으로 전망되고 있다1). Fig. 1에 전 세계 시장의 배터리 용도별 출하량 전망을 나타내었다2).
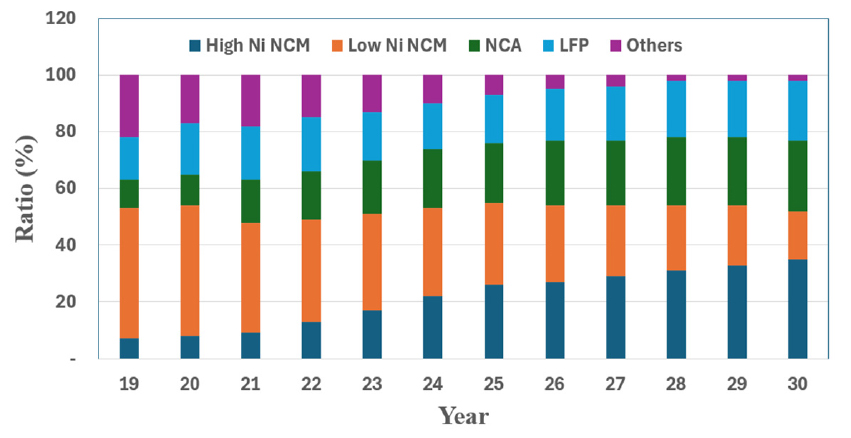
현재 사용되는 리튬 이온 배터리는 배터리의 용량, 에너지 밀도, 출력, 안정성 등 주요 성능이 양극재 종류에 따라 상이하게 나타나며, 양극재 종류는 LCO(LiCoO2), NCA(Li[Ni, Co, Al]O2), NCM(Li[Ni, Co, Mn]O2) 및 LFP(LiFePO4) 등으로 구분된다. Table 1에 양극재 종류에 따른 주요 특성을 나타내었다. 이러한 양극재는 전기자동차 제조사 및 차종에 따라 각기 다르게 채택되어 사용되고 있다. 폭스바겐과 테슬라 등 고급형 차량에는 고니켈계 NCM을 적용하고 있으며, 향후 보급형 차량에는 LFP 소재를 적용할 계획이다. NCM 및 NCA는 에너지 밀도가 높으며, LFP는 가격 및 수명을 장점으로 하여 2020년 기준으로 약 65% 및 약 18%의 시장을 차지하고 있으며, 향후에도 병행하여 사용될 것으로 판단된다. Fig. 2에 사용되는 양극재 종류별 사용 전망에 대하여 나타내었다2).
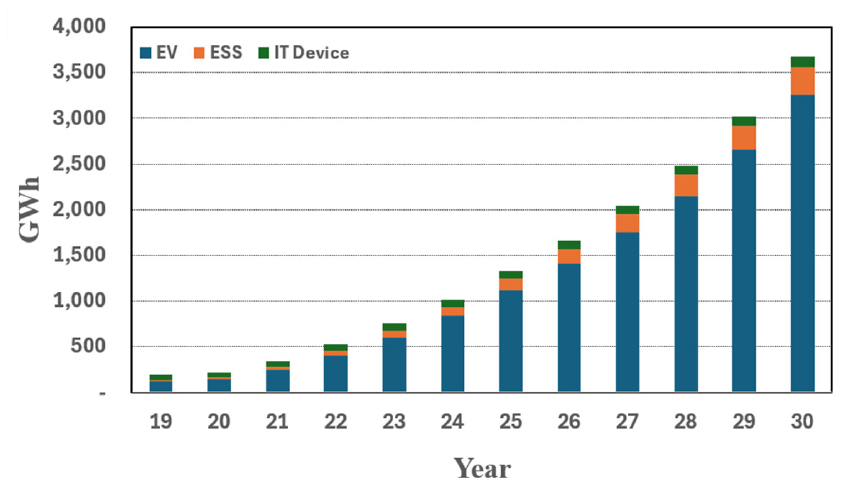
Fig. 1.
Forecast of secondary battery shipments by application (Reconstructed based on SNE report2)).
Table 1.
Characteristics according to cathode material type
상기 배터리 용도별 및 양극재 종류별 사용량을 근거로 리튬철인산염(LFP) 배터리의 소비량을 계산하여 보면, 2030년 전기자동차용 배터리 수요를 기준으로 3,257 GWh에 LFP 사용 전망을 약 25%라 가정하면 814 GWh가 사용될 것으로 추측된다. 향후에 배터리의 수명이 다함에 따라 배터리의 양도 급격하게 증가할 것으로 예상되며, 이에 따라 LFP 배터리의 재활용도 본격적으로 시행될 것으로 사료된다.
현재 LFP 배터리의 재사용 및 재활용 방법으로는 단계적 활용, 재생, 재활용 세 가지가 있다. LFP 배터리는 케이스, 양극 및 음극 소재, 분리막, 전해질로 구성되어 있으며, 리튬(Li), 구리(Cu), 알루미늄(Al), 흑연(C), 철(Fe) 등의 유가 금속과 폴리머, 유기 전해질, 플루오린(F) 등의 유해 물질을 포함하고 있습니다. 따라서 LFP 배터리의 재활용은 환경 문제를 해결하고 귀중한 자원을 회수하기 위한 필연적인 사회적 요구이다. 특히 LFP 배터리의 양극재에는 약 4%의 리튬이 포함되어 있으며, 이를 효과적으로 회수하는 기술이 필수적이다. 최근 연구에서 강산, 약산, 과황산계 산화제와 같은 다양한 침출제를 사용하여 LFP 배터리에서 리튬을 선택적으로 회수하는 방법을 제시하고 있다3,4,5). 본 리뷰 논문에서는 LFP 배터리의 습식 재활용에 관한 최신 연구 동향과 기술을 분석하고, 본 연구자들이 수행한 다양한 연구들을 소개하고자 한다. 이를 통해 LFP 배터리의 재활용 기술 발전과 실용화에 기여하고, 지속 가능한 자원 순환 경제를 구축하는 데 있어 중요한 참고 자료로써 활용되기를 희망한다.
2. 기존 습식 재활용 연구 동향
LFP 배터리로부터 유가 금속을 회수하는 습식․화학적 공정은 현재 주류 공정으로, 이러한 공정은 침출, 농축, 분리, 정제, 재합성 등의 단계를 포함한다. 특히 침출 단계는 양극 물질에서 유가 금속을 용액으로 전환하는 과정으로 후속 분리 및 정제의 기초 물성을 형성하기 때문에 가장 중요한 단계이다. 특히, 산 침출은 높은 침출 효율 및 다양한 침출제 등의 장점이 있어 많은 연구자가 다양한 방법으로 연구를 수행하고 있다6). 기존 문헌에 따르면, 주로 연구된 침출제는 무기산(H2SO4, HCl, HNO3, H3PO4), 유기산(HCOOH, H2C2O4, CH3COOH, C6H8O7 등), 그리고 다양한 산화제(H2O2, Na2S2O3, NaClO3, NaClO 등) 등이 사용되고 있다. 또한, 양극 물질로부터 유가 금속이 더 쉽게 침출될 수 있도록 기계화학적 반응을 통해 초기 원료의 물성을 변환시키는 반응이 사용되고 있다.
2.1. 강산(무기산) 활용 LFP로부터 리튬 침출 연구동향 분석
전통적으로 리튬계 이자전지 습식 재활용 시 사용되는 침출제는 염산(HCl), 질산(HNO3), 인산(H3PO4) 및 황산(H2SO4)과 같은 강산인 무기산을 사용하며, 강한 산에 의한 높은 효율의 침출 효과와 경제성의 이유로 이러한 강산인 무기산을 이용하여 유가 금속을 회수하는 공정이 사용되고 있다. Table 2에 무기산을 침출제로 이용하여 LFP 배터리로부터 리튬을 침출하는 연구 동향에 관하여 나타내었다6,7,8,9,10,11,12,13,14).
Table 2.
Research trends on lithium leaching from LFP using strong(inorganic) acids
| Leaching agents | Experimental conditions | Products | Results | Ref. | |
|
Inorganic acid |
Sulfuric acid |
- 0.6 M H2SO4 - H2SO4/Li molar ratio 0.525 - 1.3 MPa O2 - Temp. 120℃, time 90min. |
- FePO4 - Fe5(PO4)4 (OH)3 ․2H2O - Li3PO4 |
- L.R. Li > 97% - L.R. Fe < 1% - R.R. Li > 95.74% | Wu et al. [14] |
|
Sulfuric acid |
- 2 M H2SO4 - S/L=20, temp. 70℃, time 120min. |
- Flake-like LFP - Hydrothermal regeneration |
- L.R. Li > 97.7% - L.R. Fe > 93.3% | Song et al. [12] | |
|
Sulfuric acid |
- 98% H2SO4 Acid/LFP=0.35:1 - S/L=5, temp. 20℃, time 90min. - High Al content 6.7% powder | - |
- L.R. Li 92.19% - L.R. Fe 91.53% - L.R. P 91.01% - L.R. Al 15.98% | Lou et al. [13] | |
|
Sulfuric acid |
- 0.3 M H2SO4 - H2SO4/Li molar ratio 0.57 - H2O2/Li molar ratio 2.07 - Temp. 60℃, time 120min. |
- FePO4 - Li3PO4 (95.6%) |
- L.R. Li 96.85% - L.R. Fe 0.027% - L.R. P 1.95% | Li et al. [9] | |
|
Sulfuric acid |
- 2.5 M H2SO4 - Pulp density 100 g/L - Temp. 60℃, time 240min. |
- FePO4․2H2O - Li2CO3 |
- L.R. Li > 98% - L.R. Fe > 97% | Zheng et al. [10] | |
|
Sulfuric acid | - Completely dissolved using H2SO4 and H2O2 |
- FePO4․2H2O - Fe(OH)3 - Li3PO4 | Not mentioned | Cai et al. [11] | |
|
Phosphoric acid |
- LFP+EDTA-2Na=3:1 (Mechanochemical) - 0.6 M H3PO4 leaching - Pulp density 50 g/L (20min.) |
- FePO4․2H2O - Li3PO4 |
- L.R. Li 94.29% - L.R. Fe 97.67% - R.R. Li 82.55% - R.R. Fe 93.05% | Yang et al. [8] | |
|
Phosphoric acid |
- 0.5 M H3PO4 - Pulp density 25 g/L - Room Temp., time 60min. |
- FePO4․2H2O - LiH2PO4 |
- CM L.R. > 95% - R.R. Li > 75% | Bian et al. [7] | |
|
Hydrochloric acid |
- LFP 700℃, 10hr annealing - 6 M HCl - Pulp density 50 g/L - Temp. 120℃, time 6hr | - FePO4․2H2O | - | Shin et al. [6] | |
Shin et al.은 염산을 이용하여 LFP 양극재를 재활용하였으며, LiFePO4 분말을 700℃에서 열처리하여 함유되어 있던 카본은 이산화탄소로 분해되고 철 성분은 산화되었다. 열처리 후 회수된 붉은색 분말을 6 M 농도의 염산 용액에 투입 후 6.25% NH4OH 용액으로 pH를 조절하여 FePO4․xH2O분말을 회수하는 실험을 하였다6). 또한, Bian et al.과 Yang et al.은 인산을 이용하여 LFP 양극재 분말로부터 금속을 침출하였으며7,8), 특히 Yang et al.은 LFP 양극재 분말 대비 EDTA-2Na 3:1로 2시간 동안 기계화학적 반응을 통해 회수된 분말을 0.6 M 농도의 인산 용액 및 광액농도 50 g/L 조건에서 리튬을 약 94.3% 그리고 철을 약 97.7% 회수하였다고 보고하였다8).
Li et al., Zheng et al. 및 Cai et al.은 황산을 LFP 양극재의 재활용을 위한 침출제로 사용하였다9,10,11). 산업적으로 주로 사용되는 황산과 같은 무기산을 이용하여 LFP를 침출하는 경우, 식 (1) 및 식 (2)와 같은 반응으로 진행된다. 두 반응의 가장 큰 차이점은 리튬의 선택적 회수에 관한 차이로서 식 (1)의 경우에는 양극 물질을 비선택적으로 침출시키는 공정이고, 식 (2)의 경우 침출 용액으로 리튬을 선택적으로 회수하고 나머지 고상은 침출잔사인 FePO4 형태로 분리하는 공정이다. 전체 반응에서 과산화수소수와 철 이온이 반응하여 Fe3+로 산화되는 것을 식 (3)에 나타내었으며, 이에 FePO4로 침전되는 것을 반응식으로 확인할 수 있었다.
고농도의 황산을 이용하여 LFP에 함유되어 있는 모든 성분을 침출하는 연구를 많은 연구진이 수행하였으며, 침출 조건에 따라 리튬, 철, 그리고 인 성분의 침출율은 최소 90% 이상 달성되었다고 보고하였다10,11,12,13). 반면에 리튬을 선택적으로 회수하는 연구 중에서 Li et al.은 화학양론적 계산을 통하여 0.3 M의 황산과 H2O2/Li 몰 비 2.07, H2SO4/Li 몰 비 0.57, 반응온도 60℃ 그리고 반응시간 120분의 조건에서 리튬 침출율 약 96.85%, 철 침출율 약 0.03% 및 인 침출율 약 1.95%를 달성하였다. 그리고 식 (4)과 같이 생성된 가용성 물질인 황산리튬 용액은 인산나트륨과 반응하여 인산리튬으로 침전시켜 얻을 수 있다고 보고하였다9). 또한 Wu et al.은 0.6 M의 황산과 H2SO4/Li 몰 비 0.525, 반응온도 120℃ 그리고 반응시간 90분의 조건에서 산소를 산화제로 이용하여 리튬 침출율 약 97%와 철 침출율 약 1% 미만의 결과를 보고하였다. 여기서 특이한 점은 산화제로 산소를 사용함으로써 Fe2+에서 Fe3+로 산화시켜 PO43-와의 반응을 통하여 FePO4로 침전시킴으로 리튬의 침출율이 증가하였다고 보고하였으며, 반응 온도에 따라 1.3 MPa 산소의 조건에서 80℃ 이하의 침출온도에서는 FePO4로 120℃ 이상의 침출 조건에서는 Fe5(PO4)4(OH)3․2H2O의 결정상이 생성되었다고 보고하였다14).
Li et al.이 침출제로서 황산을 이용한 LFP 재활용 연구는 리튬을 타 성분과 분리하여 선택적으로 침출하였다는데 그 의미가 크다고 할 수 있다. 그러나 침출효율을 나타내기 위해서는 LFP 분말량과 침출용액량의 관계인 광액농도가 매우 중요한데 Li et al.의 연구에서는 침출의 중요 요소인 광액농도가 제시되지 않아 최적 조건을 확인할 수 없었다9). 이에 본 논문의 저자 그룹인 Kim et al.의 연구에서 Li et al.이 사용한 저농도의 황산용액(0.3 M 농도) 조건으로 pH 및 광액농도에 따른 2-스텝 침출공정을 적용하여 최적의 조건을 탐색하는 연구를 수행하였다15).
Kim et al.의 연구에서 사용한 LFP 양극재 분말은 L사에서 공급된 LFP 양극재 스크랩을 분쇄 공정 후 약 150 µm 이하로 분급한 분말을 사용하였다. 분급된 분말에는 리튬이 약 5.2% 그리고 양극 집전체의 주성분인 알루미늄이 약 0.2% 혼합되어 있었다. LFP 양극재 분말의 주요 성분에 관한 화학조성 및 기존의 연구진들이 사용한 LFP 양극재 분말의 주요 성분을 포함하여 Table 3에 나타내었다. 그리고 사용한 LFP 양극재 분말은 LiFePO4(ICDD #01- 080-6251) 결정상으로 확인되었다.
Table 3.
Chemical composition of LiFePO4 cathode powders used various studies (%)
| Li | Fe | P | Al | etc | Ref. |
| 5.2 | 34.5 | 24.0 | 0.2 | 12.4 | Kim et al. [15] |
| 4.4 | 32.5 | 18.1 | - | - | Mahandra et al. [16] |
| 3.9 | 29.0 | 16.1 | 11.3 | 7.7 | Peng et al. [17] |
| 4.6 | 33.7 | 19.5 | - | 0.2 | Zhang et al. [18] |
| 3.5 | 26.5 | 15.9 | 16.9 | - | Yang et al. [19] |
| 4.1 | 31.3 | 18.9 | 0.2 | - | Yang et al. [8] |
LFP 양극재 분말로부터 고농도 리튬 용액을 회수하기 위한 침출 조건을 탐색하기 위하여 광액농도를 50 g/L, 100 g/L 및 200 g/L로 조절하여 광액농도에 따른 침출율을 비교하였으며, 침출제는 황산 용액 농도를 0.3M로 하여 고정하여 실험을 수행하였다. 광액농도가 증가함에 따라 리튬, 철 및 인의 침출율은 모두 감소하는 경향을 나타내었으며, 1차 침출의 경우 50 g/L의 광액농도 조건에서는 리튬의 약 99.2%로 거의 침출되었지만, 철 및 인 성분도 약 42.2% 및 47.2%로 비교적 높은 농도로 침출되는 결과를 나타내었다. 200 g/L의 광액농도 조건에서 철 및 인 성분은 거의 침출되지 않은 반면, 리튬의 침출율은 약 50%로 침출효율이 상당히 저하되는 결과를 얻었다. 종합적으로 광액농도는 리튬, 철 및 인 성분의 침출효율에 영향을 미치는 것으로 판단되며, 이는 Li et al.의 연구와 상이한 결과로 확인되었다. 이러한 결과의 원인으로는 침출효율에 영향이 있는 H2O2 사용과 이에 따른 최종 pH가 달라졌기 때문이라고 판단된다.
고농도 및 고순도 리튬 용액을 얻기 위한 효율을 비교한 결과, 리튬의 침출율은 광액농도가 증가함에 따라 감소하였으나 효율의 관점에서 보면 50 g/L 광액농도 조건의 침출율 대비 100 g/L 및 200 g/L 광액농도 조건의 침출효율은 약 1.6배 및 2.0배로 향상되었다. 1+2차 침출 공정의 200 g/L 광액농도 조건에서 리튬의 침출율은 약 90%로 확인되었고, 철 및 인 성분과의 분리효율은 타 광액농도에 비해 약 200배 이상 월등히 높은 것으로 확인되었으며, 이는 Table 4에 나타내었다. 분리효율에 대한 정의는 Kim et al.의 연구에서 확인할 수 있다15).
Table 4.
Leaching rate according to the pulp density from LiFePO4 cathode powder
2.2. 약산(유기산) 활용 LFP로부터 리튬 침출 연구동향 분석
무기산을 침출제로 사용할 경우, 무기산에 함유된 Cl2, NOx, 및 SOx와 같은 성분으로 인해 이차전지 재활용 시 독성가스 배출 가능성과 산성 침출용액으로 인하여 액 처리 시 알칼리에 의한 중화 공정으로 인하여 다량의 폐기물 및 폐수가 발생할 우려가 높다. 최근 이차전지 재활용에 있어서 기존 무기산에 의한 환경 부하를 감소시키기 위하여 약산인 유기산(아세트산, 포름산, 시트러스산, 씨트릭산 및 옥살산 등)을 사용하는 연구가 LFP 배터리 재활용에 있어서도 활발하게 진행되고 있다. 이에 관한 결과를 Table 5에 정리하여 나타내었다. 유기산인 옥살산(oxalic acid), 아세트산(acetic acid), 시트르산(citric acid, 구연산) 및 포름산(formic acid)을 사용하였을 경우 진행되는 반응식을 하기 식 (5)에서 식 (8)까지 나타내었다. 무기산 반응과 마찬가지로 리튬은 용액 상태로 침출되며, 나머지 성분은 철 화합물 형태로 침전됨을 알 수 있다.
Fan et al.은 직접 옥살산 침출법과 LFP 분말과 옥살산 1:1로 혼합하여 기계화학적 반응을 이용한 침출법에 대하여 비교 실험을 하였다. 직접 옥살산 침출법에 의해 리튬은 약 53%의 침출효율을 나타냈지만, 기계화학적 반응을 이용한 침출법을 통하여 리튬 침출효율 99.34% 및 철 침출효율 약 7.13%를 달성하였다. 그리고 고상으로 분리된 잔사는 철 옥살레이트(Iron Oxalate, FeC2O4․2H2O) 형태로 회수된다고 보고하였다20).
Table 5.
Research trends on lithium leaching from LFP using weak (organic) acids
| Leaching agents | Experimental conditions | Product | Results | Ref. | |
|
Organic Acid |
Formic acid |
- HCOOH with 10%(v/v) H2O2 - HCOOH/Li molar ratio 3.23 - Pulp density 10% (w/v) - Temp. 30℃, time 30min. |
- FePO4/C - Li3PO4 (99%) |
- R.R. Li > 99.5% - L.E. Li 99.98% - L.E. Fe&P < 0.5% | Mahandra et al. [16] |
|
Citrus fruit juice acid |
- 100% H3Cit with 6%(v/v) H2O2 - Pulp density 67 g/L - Room Temp., time 90min. |
- FePO4 (96%) - Li2CO3 (99.2%) |
- L.E. Li 94.83% - L.E. Fe 4.05% - L.E. P 0.84% | Kumar et al. [22] | |
|
Citric acid |
- H3Cit with H2O2 - Mechnochemical: 400rpm, 2hr |
- Fe(OH)3 - Li2CO3 |
- L.E. Li 99.35% - L.E. Fe 3.86% | Li et al. [21] | |
|
Acetic acid |
- 0.8 M CH3COOH with 6%(v/v) H2O2 - Pulp density 120 g/L - Temp. 50℃, time 30min. |
- FePO4 - Li2CO3 (99.95%) |
- R.R. Li 95.05% - L.S. Li 94.08% - L.E. Li 94.57% - L.E. Fe < 1% | Yang et al. [19] | |
|
Oxalic acid |
- LFP temp. 700℃, time 5hr calcination - LFP with H2C2O4 (1:1) - Mechnochemical: 500rpm, time 2hr - Water leaching |
- FeC2O4․2H2O - Li3PO4 |
- R.R. Li 99% - R.R. Fe 94% - L.E. Li 99.34% - L.E. Fe 7.13% | Fan et al. [20] | |
Yang et al.은 아세트산을 이용하여 LFP 분말 내 리튬의 선택적 침출에 대하여 실험을 수행하였다. 0.8 M 농도의 아세트산 용액, 6 vol.% H2O2, S/L=120 g/L, 그리고 침출온도 50℃ 및 침출시간 30분의 조건에서 약 99.34%의 리튬 침출효율 및 약 1% 미만의 철 침출효율을 나타내었다. 여기서 H2O2 유무에 따라 약 10%에서 약 94%로 리튬의 침출효율이 변화하였다고 보고하였다19). Li et al.은 구연산이라 불리는 시트르산을 이용하여 기계화학적 반응을 이용하여 리튬 침출효율 약 99.35%, 철 침출효율 약 3.86%을 달성하였다. 특이한 점은 H2O2 유무에 따라 리튬의 침출효율은 거의 변화가 없는 반면에 철 침출효율이 약 95.62%로 증가되었다고 보고하였다21). Kumar et al.은 다양한 시트르산(사과, 오렌지, 레몬)을 이용하여 LFP 내 존재하는 원소인 리튬, 철, 인, 구리 및 알루미늄에 대하여 침출효율을 분석하였다. 최적의 침출효율을 나타내고 있는 레몬계 시트르산의 경우, 6 vol% H2O2, 광액비 67 g/L, 실온 및 90분의 침출조건에서 리튬 약 94.83%, 철 약 4.05%, 인 약 0.84%, 구리 약 96.92% 및 알루미늄 약 47.24%의 침출효과를 나타나는 것으로 보고하였다. 시트르산의 종류에 따라 리튬의 침출율만을 비교하여 보면, 사과(약 59.39%) < 오렌지(약 66.03%) < 레몬(약 94.8%) 순으로 침출효율이 증가하였다. 이는 pH의 변화량 사과(pH 4.33) < 오렌지(pH 4.11) < 레몬(pH 3.51)과 관계있다고 하였다. 또한, H2O2 유무에 따라 리튬의 침출효율이 약 66.02%에서 약 94.83%로 약 143% 증가하였다22). 그리고 Mahandra 및 Ghahreman은 포름산과 과산화수소를 이용하여 광액농도 10%, 10 vol.% H2O2, HCOOH/Li=3.25 몰 비, 침출온도 30℃ 및 침출시간 30분의 조건에서 리튬 약 99.98% 및 철/인 약 0.5% 미만의 침출효율을 보고하였다16).
본 논문의 저자 그룹인 Kim et al.의 연구에서는 메탄술폰산(Methane sulfonic acid, MSA, CH3SO3H)이라는 유기산을 이용하여 LFP 구성성분에 대한 침출효율에 대하여 보고하였다23). 메탄술폰산은 상기 언급한 유기산들과는 달리 산도 면에서 큰 차이를 나타내고 있다. Yadav et al.은 고농도 메탄술폰산을 이용하여 LFP 블랙매스로부터 리튬을 약 95% 침출하였지만, 철 성분 또한 약 95% 침출되어 철을 침전시켜 분리하는 공정이 추가되었다24). Kim et al.은 메탄술폰산의 농도 및 광액농도를 변수로 하여 LFP 양극재 분말로부터 리튬을 선추출하는 실험을 통하여 최적조건을 도출하였다. Table 6에 각각의 실험 조건을 통하여 각 성분의 침출효율을 나타내었다. 메탄술폰산을 이용한 반응식은 식 (9)에 나타내었다.
동일한 광액농도 조건에서 메탄술폰산의 농도가 증가할수록 리튬의 침출효율은 증가하는 것으로 나타났으며, 철 및 인의 침출효율은 침출용액의 pH에 따라 달라지는 경향을 보였다. 광액농도 50 g/L 및 메타술폰산 0.15 M 농도 조건에서 리튬의 침출효율은 약 61%였으며, 메탄술폰산의 농도가 증가함에 따라 리튬의 침출효율은 거의 100%로 급격히 증가하는 경향을 보였다.
Table 6.
Leaching rate of reaction according to the pulp density and the MSA concentration from LFP cathode powders
그리고 철 및 인의 침출효율을 살펴보면, 메탄술폰산 0.62 M 농도에서는 철 침출효율 약 57.8% 및 인 침출효율 약 62.2%로 리튬에 대한 선택적 침출이 되지 않았다. 반면 메탄술폰산 0.31 M 농도에서는 리튬은약 100% 침출되었으며, 철 및 인 성분은 거의 침출되지 않은 결과를 보였다. 이와 같은 원인으로는 기존 Kim et al.의 연구에서 pH가 낮을수록 리튬의 침출효율은 증가하지만, 철 및 인 성분도 함께 침출되므로 적절한 pH 영역에서 침출하여야 리튬을 선택적으로 침출 및 회수하는 것이 가능하다고 보고하였다15). 또한, 메탄술폰산을 이용하여 침출 후 액상과 잔사인 고상을 분리한 후 고상의 결정상을 확인한 결과 식 (9)와 같이 FePO4로 확인되었다.
2.3. 강산화제 활용 LFP로부터 리튬 침출 연구동향 분석
최근 친환경적이며 높은 침출 효과로 인하여 산화 침출(oxidative extraction)에 대한 LFP 재활용 연구가 활발하게 진행되고 있다. 이에 관한 연구동향을 Table 7에 나타내었다. 주로 과황산계 산화제를 이용하였으며, 이에 대한 반응식은 식 (10), 식 (11), 그리고 식 (12)에 나타내었다.
Table 7.
Research trends on lithium leaching from LFP using strong oxidant acids
| Leaching agents | Experimental conditions | Products | Results | Ref. | |
| Oxidant |
Na2S2O8 K2S2O8 (NH4)2S2O8 |
- 3 kinds persulfate-based oxidants - Mole ratio=1.1, 250rpm, 3hr - S/L=50, 100, 200 g/L | - FePO4 | - L.R. Li > 92% | Kim et al. [29] |
| Na2S2O8 |
- Mechanochemical solid phase oxidation - (Zr ball, high energy planetary ball milling) - Mole ratio=1.0 - 600 rpm, time 5min. |
- FePO4 - Precipitation (Na2PO4→Li2PO4) | - L.R. Li 99.7% | Liu et al. [26] | |
| Na2S2O8 |
- Mole ratio=1.4, S/L=50 g/L - Temp. 25℃, time 30min. |
- Slow release fertilizer NaFeS2 - Phosphorus slow release fertilizer |
- L.R. Li≒100% - L.R. Fe&P≤1% | Yue et al. [27] | |
| Na2S2O8 |
- Mole ratio=1.05, S/L=300 g/L - Temp. 25℃, time 20min., pH 3.5 |
- FePO4 - Precipitation (Na2CO3→Li2CO3) |
- L.R. Li > 99.9% - L.R. Fe < 0.048% - L.R. P < 0.587% | Zhang et al. [25] | |
| (NH4)2S2O8 |
- Mole ratio=1.4, S/L=50 g/L - Temp. 30℃, time 30min., pH 2.97-4.08 |
- FePO4 - Precipitation (Na2CO3→Li2CO3) |
- L.R. Li > 98.1% - L.R. Fe < 0.02% - L.R. Al < 0.06% | Peng et al. [28] | |
| K2S2O8 |
- Leaching under microwave - Mole ratio=1.0 - Microwave conditions 250 W for 15min. |
- LiFePO4 - NaFePO4 | - | Gangaja et al. [30] | |
| NaClO |
- 0.54 M NaClO, S/L=1 g/L - 60min., temp. 60℃, |
- Fe(OH)3 - Li2HPO4 | - L.R. Li 99.8% | Liu et al. [31] | |
| NaClO | - LFP + H2O adding HCl & NaClO |
- Precipitation (Na2CO3→Li2CO3) | - L.R. Li 99% | Yan et al. [32] | |
Zhang et al.은 과황산나트륨(sodium persulfate, Na2S2O8)을 이용하여 몰 비 1.05, 광액농도 S/L=300 g/L, 실온 및 침출 반응 20분의 조건에서 리튬 약 99.9%, 철 약 0.05%, 인 약 0.59% 그리고 알루미늄 약 0.58%로 침출되었다고 보고하였다25). Liu et al.은 LFP 분말과 과황산나트륨의 기계화학적 반응을 통하여 리튬 약 99% 이상 침출하였다고 보고하였다26). Yue et al.은 LFP 대비 1.4 몰 비를 이용하여 거의 100%의 리튬을 침출하였고, 철 및 인 성분은 약 1% 미만의 침출을 통하여 선택적인 리튬 침출이 가능하다고 하였다. 그리고 잔사로 남은 FePO4는 Na2S와의 반응을 통하여 NaFeS2․2H2O를 제조하여 비료(fertilizer)로서의 효과에 대하여 보고하였다27). 이에 대한 반응은 식 (13)에 나타내었다.
또한, Peng et al.은 과황산계 산화제 종류인 과황산암모늄(ammonium persulfate, (NH4)2S2O8)을 LFP 대비 1.4 몰 비, 광액농도 S/L=50 g/L, 침출온도 30℃ 및 침출 시간 30분의 조건에서 약 98% 이상 리튬이 침출된다고 보고하였다28). 본 논문의 저자 그룹인 Kim et al.은 과황산계 산화제의 종류에 따른 비교 및 검토를 위하여 3종류의 과황산계 산화제(Na2S2O8, K2S2O8, (NH4)2S2O8)를 사용하여 동일한 침출조건에서 실험을 진행하였으며, 열역학적 계산에 대한 고찰과 전체적인 침출효율 및 리튬에 대한 선택적 침출효과에 대하여 보고하였다29). 열역학적 계산 결과 LFP와 3종류의 과황산계 산화제 반응 모두 유사한 자발적인 반응이 일어남을 확인하였으며, 같은 조건의 침출효율에 있어서도 거의 유사한 결과를 얻을 수 있었다. 3종류의 과황산계 산화제 중에서 과황산칼륨이 다른 산화제인 과황산나트튬 및 과황산암모늄에 비해 광액농도가 증가함에 따라 리튬의 침출효율이 가장 감소하였다. 그 이유로는 과황산칼륨의 물에 대한 용해도가 현저하게 낮아 광액농도 증가에 따라 용액의 포화도로 인해 침출 반응에 영향이 미치지 못한 것으로 판단된다. 그러나 분리효율 측면에서는 50 g/L 조건에서 과황산칼륨이 다른 과황산계 산화제에 비하여 약 1.6배 높았으나, 광액농도가 증가함에 따라 분리효율이 감소하는 결과를 얻었다. 3종류의 과황산계 산화제에 대한 광액농도에 따른 리튬 침출효율 및 분리효율에 대한 값을 Table 8에 나타내었다.
Table 8.
Leaching rate and separation efficiency of reaction according to the pulp density using oxidant agents from LiFePO4 cathode powder (pulp density=50 g/L, 100 g/L, 200 g/L)
2.4. 염 활용 LFP로부터 리튬 침출 연구동향 분석
친환경 재활용 공법 중 하나로 LFP 배터리를 재활용하기 위하여 동형 치환반응(Isomorphic Substitution)이 제시되었다. 이에 대한 최근의 연구 동향에 대하여 Table 9에 나타내었다. Liu et al.은 LFP와 NaCl을 기계화학적 방법을 통하여 Na+와 Li+ 사이의 동형 치환반응을 이용해 식 (14)와 같이 NaFePO4와 LiCl을 얻을 수 있었다고 하였다33). 또한, LiCl은 식 (15)와 같이 탄산나트륨과의 반응을 통하여 탄산리튬의 형태로 회수하였다. Dai et al.은 LFP 배터리의 침출에 Fe2(SO4)3 및 H2O2 이용하였으며, 이에 대한 반응식을 식 (16)과 같이 나타내었다. Fe3+가 LFP의 Fe2+를 동형 치환하여 Li+을 방출하였고, 이에 리튬을 약 96% 이상 추출할 수 있다고 하였다. 또한, 다양한 비산화성 무기염 화합물(CuSO4, NiSO4, MgSO4)과 비교 실험을 통한 리튬 침출효율은 CuSO4 약 87%, NiSO4 약 42% 그리고 MgSO4 약 6% 순으로 나타났다34). Zhang et al.은 NaOH와 Na2CO3를 600℃와 1000℃ 사이에서 LFP 분말과 탄열성 반응을 통하여 리튬을 회수하는 연구를 수행하였으며, 이에 대한 반응은 식 (17) 및 식 (18)과 같다. Na2CO3를 이용한 반응을 통해 철(Fe)과 가용성 리튬화합물인 NaLi2PO4 및 LiNa5(PO4)2이 생성되어 자력 분급을 통하여 리튬 회수율 약 99.2%를 달성하였고, NaOH를 이용한 반응을 통해 철 산화물(Fe3O4)와 가용성 리튬화합물이 생성되어 마찬가지로 자력 분급을 통하여 리튬 회수율 약 92.7%를 달성하였다고 보고하였다35). Niu et al.은 시약급 FeCl3․6H2O 및 H2O2 이용하여 Fe3+가 LFP와 동형 치환반응을 발생시켰으며, 이후 용매추출법을 이용하여 리튬을 회수하는 연구를 수행하였다36). 산의 소모를 줄이고 빠른 반응을 통한 리튬의 선택적 침출을 수행하였으나 위와 같은 Fe3+에 의한 리튬의 침출 및 회수에 관한 연구에서는 철 제거에 있어 비교적 공정비용이 비싼 용매추출을 이용하였으며, 시약급 FeCl3․6H2O를 침출제로 사용하였기 때문에 산화력이 부족하여 H2O2를 첨가하였다. 상기 동형 치환반응에 대한 화학적 반응식은 식 (19)에 나타내었다.
Table 9.
Research trends on lithium leaching from LFP using salts
| Leaching agents | Experimental Conditions | Results | Ref. | |
| Salts |
FeCl3․6H2O FeCl3 |
- LFP+FeCl3+2H2O→Li++Cl-+FePO4+FeCl2․2H2O - Mechanochemical activation with Zr ball - FeCl3/LFP=1.2, 600rpm, 30min. - Synthesize LiFe5O8 (magnetic material) |
- L.R. Li > 97% - Li2CO3 99.9% - Precipitation Fe(OH)3 with NaOH+O2 | Wu et al. [14] |
|
Na2CO3 NaOH |
- Carbothermic reduction with Na2CO3 : LFP/Na2CO3=1, LFP/C=0.5, temp. 900℃ : magnetic separation - NaOH roasting : LFP/NaOH=0.5, temp. 600℃, time 2hr |
- Fe, NaLi2PO4, LiNa5(PO4)2 - Fe2O3, NaLi2PO4, LiNa5(PO4)2 - Li3PO4, Li2CO3 - R.R. Li 99.2% (with Na2CO3) - R.R. Li 99.7% (with NaOH) | Zhang et al. [35] | |
| FeCl3․6H2O |
- LFP+FeCl3→LiCl+FeCl2+FePO4 - FeCl3/LFP=1.3, temp. 25℃, time 30min., S/L=200 g/L - Solvent extraction TBP |
- L.R. Li 99% - L.R. FePO4 98% - R.R. Li > 99% | Niu et al. [36] | |
| Fe2(SO4)3 |
- 2LFP+Fe2(SO4)3=2FeSO4+Li2SO4+2FePO4 - I) Fe2(SO4)3:LFP=1:2, S/L=500 g/L, temp. 28℃, time 30min. - II) Fe2(SO4)3:LFP=1:6, S/L=400 g/L, temp. 60℃, time 30min. with 0.6 mL/g H2O2 - Other salts FeCl3, MSO4 (M=Fe, Cu, Ni, Mg) |
- I) L.E. Li 97.07% - II) L.E. Li 96.48% (with H2O2) - Precipitation Fe(OH)3 with NaOH+O2 | Dai et al. [34] | |
| NaCl |
- LiFePO4+NaCl=NaFePO4+LiCl - Mechanochemical method with Zr ball - NaCl/LFP=2, 500 rpm, time 6hr |
- NaFePO4 and LiCl - Li2CO3 precipitation with Na2CO3 - L.R. Li 96.03% | Liu et al. [33] | |
본 논문의 저자 그룹인 Kim et al.은 기존의 시약급 FeCl3․6H2O 대신에 염화철 에칭액을 활용하였다. 기존의 Fe3+가 포함된 침출제에서는 동형치환 과정에서 부족한 산화력을 보완하기 위하여 H2O2와 같은 추가적인 첨가제를 투입하였으나, Kim et al.의 연구에서는 추가적인 첨가제 없이 염화철 에칭액만을 이용하여 리튬의 선택적 침출을 진행하였다. 최종적으로 리튬의 침출효율 및 분리효율을 비교하였으며, 리튬의 선택적 침출 및 회수에 관하여 동형치환 반응의 가능성을 확인하였다37). 염화철 에칭액의 농도를 변수로 하여 리튬을 침출하였고, 침출 잔사의 결정상은 Fe(PO4) 결정구조로 분석되었으며, 0.7M 농도에서는 원료인 LFP 피크가 남아있었으나 1.0M 농도 이상에서는 모두 제거되었다. 침출액의 ICP 분석 결과, 염화철 에칭액의 농도가 1.3M일 경우 리튬의 침출효율이 약 98%로 가장 높았으며 XRD 분석 결과와 같이 0.7M 농도에서는 약 68%로 매우 낮은 리튬 침출효율을 보였다. 또한, 리튬과 인의 분리 효율은 1.0M 농도에서 가장 높았으며, 그 결과를 Table 10에 나타내었다.
3. 결 론
전기자동차와 에너지저장 장치의 급격한 성장으로 인해 LiFePO4 배터리의 수요가 급증하고 있으며, 이에 따라 배터리 재활용 문제는 사회적으로 중요한 과제로 부상하고 있다. 다양한 재활용 공법이 개발되고 있는 가운데, 본 논문에서는 LFP 배터리의 재활용을 위한 다양한 습식 공정에 관한 최신 연구 동향을 종합적으로 검토하였다. 그리고 리튬을 선택적으로 회수하는 여러 화학적 침출 방법을 중심으로 각 방법의 효율성과 최적의 조건을 분석하였으며, 이를 통해 강산 및 약산, 강산화제, 염을 활용한 다양한 리튬 회수 기술의 장단점을 비교하였다. 이러한 기술들은 경제적, 환경적 그리고 효율적으로 운영되어야 하며, 기존 논문 및 본 논문 저자들이 수행한 다양한 실험의 핵심 내용을 요약하였다.
주요 실험 결과
(1) 침출용액의 농도 : 저농도 황산 용액을 사용한 실험에서 침출용액의 농도는 리튬의 선택적 침출효율에 큰 영향을 미쳤다.
(2) 과산화수소의 영향 : 강산화제인 과산화수소의 첨가는 리튬 선택적 침출효율을 높이는 데 중요한 인자임을 알 수 있었다.
(3) 광액농도 : 광액농도는 리튬 선택적 침출효율에 중요한 요소로 작용하였다.
(4) 최종 침출용액의 pH : 침출효율에 가장 중요한 요소는 최종 침출용액의 pH 범위로, 적절한 pH 조건을 유지하는 것이 필수적이었다.
(5) 기타 조건 : 침출온도와 침출 시간은 리튬 침출 효율에 미미한 영향을 미쳤다.
4. 제 언
LFP 배터리의 재활용을 위해서는 최신 재활용 기술에 관한 지속적인 연구가 필요하다. 이러한 기술들은 물질 수지 및 공정 분석을 통해 경제성과 연관지어 종합적으로 평가되고 산업적으로 활용되어야한다. 결국, LFP 배터리 재활용 기술의 경제적, 환경적 그리고 효율성을 극대화하는 것이 중요하며, 이는 지속 가능한 발전과 자원 순환에 크게 기여할 것이라 판단된다.
LFP 재활용 연구는 단순히 기술 개발에 그치지 않고, 물질 흐름과 공정 효율성에 대한 종합적인 분석을 포함해야 하고, 이를 통해 경제성과 환경적 영향을 동시에 고려한 평가가 이루어져야 한다. LFP 배터리의 재활용은 단순히 자원의 회수 차원을 넘어, 전반적인 자원 순환과 지속 가능한 발전에 중요한 역할을 할 수 있다. 이를 위해서는 재활용 공정의 경제적 효율성을 극대화하면서도, 환경적 부담을 최소화하는 전략이 필수적으로서 예를 들어, 공정 중 발생할 수 있는 폐기물과 에너지 소비를 최소화하는 방안을 모색하는 한편, 회수된 자원의 품질을 높여 재사용 가능성을 극대화해야 한다. LFP 배터리 재활용 기술의 발전은 전기자동차 및 에너지저장 장치의 확산에 따른 배터리 문제를 해결할 뿐만 아니라, 전반적인 자원 순환 체계를 강화하고, 궁극적으로는 지속 가능한 발전을 촉진하는 데 큰 기여를 할 것으로 기대된다.