1. 서 론
2. 재료 및 실험방법
2.1. 재료
2.2. 실험방법
3. 결과 및 고찰
3.1. 수침출 조건에 따른 염배소 산물 침출 거동 분석
3.2. 다단침출에 따른 염배소 산물 침출 거동 분석
4. 결 론
1. 서 론
바나듐(Vanadium, V)은 원자번호 23번의 5족 원소로서 연성과 전성이 뛰어나다. 대부분의 금속보다 단단하고 잘 부식되지 않으며 미량만 첨가해도 고강도 강철을 제조할 수 있어 주로 철강 산업에서 합금 원료로 사용되고 있다1,2). 최근에는 에너지 저장장치(Energy storage system, ESS)에 사용되면서 리튬이온배터리를 대체할 바나듐레독스흐름전지(Vanadium redox flow battery, VRFB)가 주목받고 있다. VRFB는 리튬 기반 배터리보다 상대적으로 화재나 폭발 위험이 없고 에너지 공급 효율이 높아 앞으로 수요가 더욱 확대될 것으로 예상 된다3). 따라서 제조 원료인 바나듐을 안정적으로 공급하기 위한 효율적인 회수 기술 개발 연구가 다양하게 수행되고 있다4,5,6).
바나듐은 독립적인 광물로는 거의 존재하지 않고 철(Fe), 티타늄(Ti), 우라늄(U), 알루미늄(Al)과 같은 금속광물이나 탄소질 광물과 결합한 형태로 미량 존재하며 광물 격자 내에서 다양한 이온(Fe3+, Al3+, Ti4+. P5+)을 치환할 수 있다7,8). 주로 고철질 암석 내 존재하는 경우가 많으며 대표적인 바나듐 공급원으로는 자철석과 티탄철석이 주로 이루어진 함바나듐 티탄철광(Vanadium-bearing titaniferous magnetite, VTM)이 잘 알려져 있다9,10). VTM에 포함된 바나듐은 오산화바나듐(V2O5)기준 0.1~1.0% 함유되어 있는 것으로 확인되고 일부 광산에서는 1.9%까지 보고되었다11,12,13,14,15). 부존된 광물 내 오산화바나듐 품위가 1% 이상일 경우 바나듐의 직접 회수가 가능하고 1%보다 낮을 경우 품위를 향상시키기 위해 부유 선별, 자력 선별 등의 공정이 요구 된다16). 대표적으로 중국, 러시아, 남아프리카 공화국 등에서 개발되고 있으며 국내의 경우 경기 연천 지역의 VTM 내 자철광에 바나듐이 부존되어 있는 것으로 보고되어 연구가 진행되고 있다17,18).
VTM 광상에 함유된 바나듐은 +3가의 형태로 주로 자철석의 +3가 철이온을 치환하여 존재하고 물에 잘 용해되지 않는다19). 따라서 주로 염화나트륨(NaCl), 탄산나트륨(Na2CO3), 황산나트륨(Na2SO4)등의 Na계 염과 고온 염배소하여 소듐바나데이트(NaVO3)로 전환하고 수침출 공정을 통해 회수한다. 소듐바나데이트는 수용액 내 HVO42- 또는 H2VO4-형태로 존재할 수 있으며 별도의 산화제 없이 수상에서 침출 가능하다20). 또한 수상에서는 VTM 광상의 대부분을 차지하는 자철석과 티탄철석이 침출되지 않기 때문에 미량 존재하는 바나듐을 선택적으로 회수할 수 있다. 이와 같이 탄산나트륨을 이용한 VTM 광석의 염배소와 바나듐의 수침출 공정을 화학식으로 나타내면 각각 식 (1), (2)와 같다.
[바나듐 염배소]
[바나듐 수침출]
염배소-수침출 공정으로 회수한 소듐바나데이트 침출 용액에서 고순도 바나듐 산물을 얻기 위해서는 일반적으로 pH 및 용해도 차이를 이용하여 불순물 원소를 먼저 제거하고 바나듐을 침전시킨다. 바나듐 침전물은 AMV(Ammonium metavanadate) 침전법에 따라 과량의 암모늄염을 투입하여 암모늄 메타바나데이트(NH4VO3)로 침전시키고21), 침전된 암모늄 메타바나데이트는 암모늄 제거 과정을 거친 후 오산화바나듐으로 회수한다.
본 연구에서는 국내 부존되어있는 VTM 정광 내 바나듐을 회수하기 위해 탄산나트륨을 사용한 염배소 산물의 수침출 거동을 분석하였다. 바나듐 회수 공정에서 침전물로 제조되는 암모늄 메타바나데이트는 고농도에서 침전 반응이 더 빠르게 유도되기 때문에22) 수침출 공정에서 고농도의 소듐바나데이트 침출 용액을 제조하는 것이 바나듐의 회수율을 높이는 데 효과적이다. 따라서 본 연구에서는 조건 변수에 의한 바나듐의 침출 거동을 파악하고 고농도 바나듐 침출액을 제조하고자 하였다.
2. 재료 및 실험방법
2.1. 재료
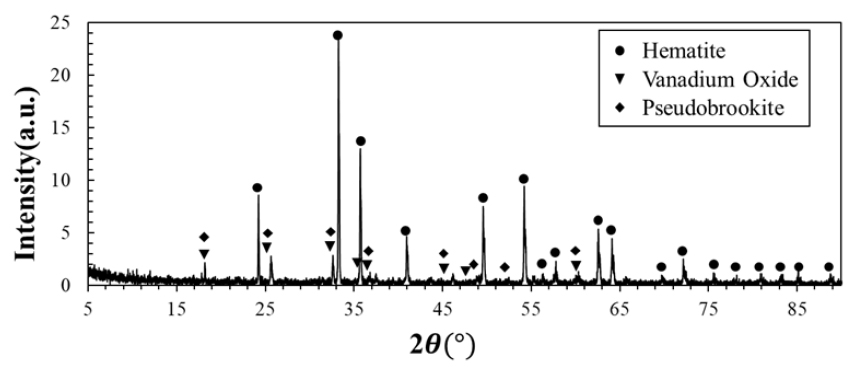
본 연구에서 출발 물질로 사용된 VTM 정광 염배소 산물은 자력선별-염배소 공정을 통해 제조되었으며 화학적 조성과 함량은 X-선 형광분석기(XRF, X-ray fluorescence)로 분석한 결과 Table 1과 같다. 정광에 포함된 바나듐을 수침출에 용이한 형태로 전환하고자 Na2CO3를 첨가하여 염배소 하였으며 염배소 조건은 선행 연구결과를 따라 알루미나 도가니에 시료와 Na2CO3를 질량비 4:1로 혼합해 장입하고 박스형 전기로를 이용하여 1,050°C에서 공기를 유량 2 L/min으로 주입하며 3시간 동안 배소하였다20). 염배소된 시료는 X-선 회절분석기(XRD, D8 ADVANCE, BRUKER)로 분석한 결과 Fig. 1과 같이 적철석, 티탄철석, 산화바나듐 등을 함유한 것으로 분석되었다.
Table 1.
Chemical composition of VTM concentrate
| Element | TiO2 |
FeO (Fe2O3) | SiO2 | Al2O3 | CaO | MnO | V2O5 |
| concentration(wt%) | 7.3 |
70.4 (78.2) | 0.8 | 2.4 | 0.2 | 0.1 | 1.0 |
2.2. 실험방법
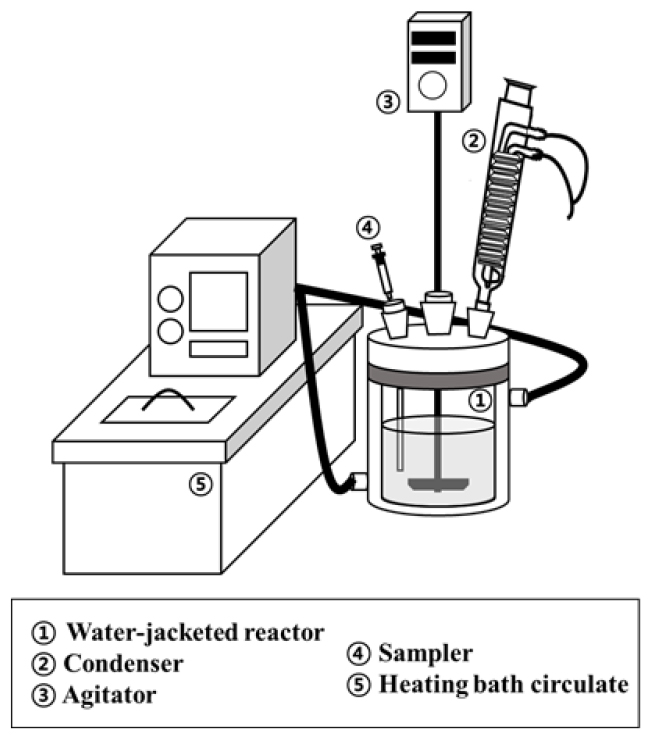
실험은 Fig. 2와 같이 250 ml 이중 자켓 반응조를 사용하여 수행하였으며 온도 조절을 위해 항온 순환 수조(CW-10G, JEIO TECH Co. Lte)를 이용하였다. 바나듐의 수침출 최적 조건을 파악하고자 침출 온도(25~85 °C)와 광액 농도(10~100 w/v%)를 변수로 선정하였고 교반 속도는 300 rpm으로 고정하였다. 침출 반응은 초기에 빠르게 일어나며 1시간 이후 바나듐의 침출율 변화가 없었으므로 침출 시간은 1시간으로 정하였다. 침출율은 식 (3)과 같이 침출 후 잔사 내 목적 금속의 절대량을 침출 전 시료 내 목적 금속의 절대량으로 나누어 계산하였다(MT,F : feed 내 목적 금속의 절대량(g), MT,R : residue 내 목적 금속의 절대량(g)). 계산을 위해 침출 전 시료와 침출 후 잔사를 왕수(HCl:HNO3 = 3:1 v/v)로 모두 녹이고 유도결합 플라즈마 발광 분석기(ICP-OES, OPTIMA 8300, Perkin Elmer)를 사용하여 농도 분석하였다.
3. 결과 및 고찰
3.1. 수침출 조건에 따른 염배소 산물 침출 거동 분석
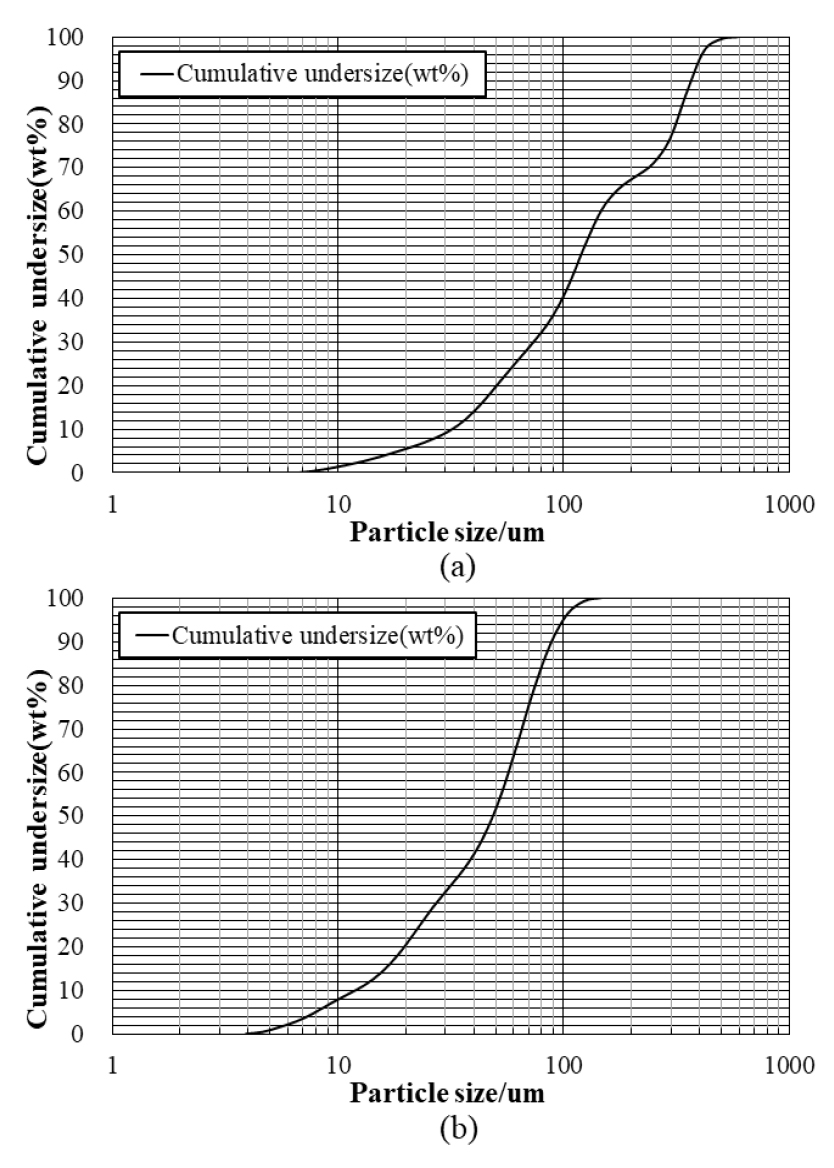
선행 연구 결과에 따라 VTM 정광 내 바나듐을 용이한 형태로 침출하기 위해 자력선별 된 정광과 Na2CO3를 질량비 4:1로 혼합한 후 1050 °C의 조건에서 3시간 동안 염배소를 실시하였다. 염배소 후 산물은 매우 단단하므로 침출율을 높이고자 로드밀을 사용하여 배소 산물 1 kg 당 30분 동안 분쇄하였고 이에 따라 입도(D50)는 119.70 µm에서 48.79 µm까지 감소하였다(Fig. 3)20). 염배소 후 산물에 대한 수침출 최적 조건을 도출하기 위해 침출 온도, 광액 농도를 영향인자로 선정하여 침출 거동을 파악하고 도출된 조건을 바탕으로 고농도 바나듐 침출용액을 제조하고자 하였다.
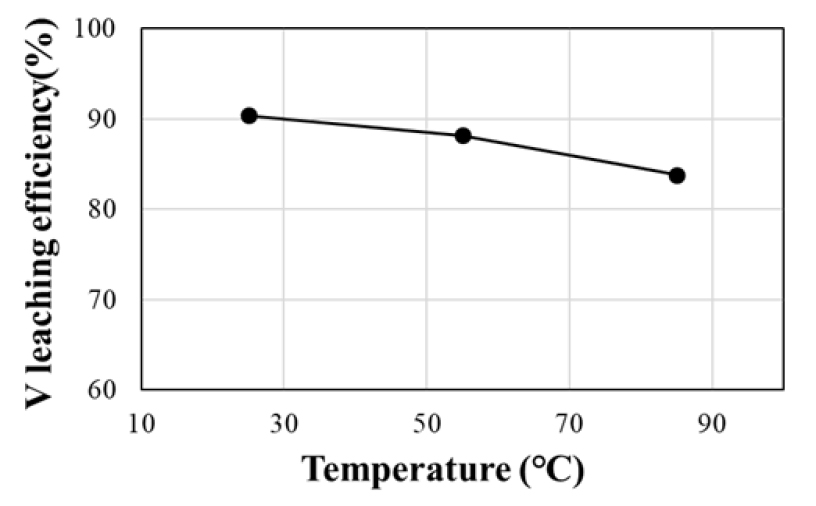
분쇄된 염배소 산물에 대해 온도를 변화시키면서 300 rpm, 10 w/v% 광액 농도의 조건에서 1시간 동안 침출한 결과, 바나듐의 침출율은 Fig. 4에 나타낸 바와 같이 침출 온도가 25, 55, 85 °C로 증가함에 따라 90.4, 88.2, 83.8%로 감소하였다. 침출 용액에는 바나듐 이외 알루미늄과 실리콘 등이 존재하며 XRF 분석으로 확인되는 철, 티타늄, 망간 등은 침출액에서 분석되지 않았다. 이는 VTM 광석 내 맥석광물이 염배소 공정을 통해 수상에서 용해 가능한 형태인 소듐알루미네이트(NaAlO2), 소듐실리케이트(Na2SiO3) 등으로 전환되어 바나듐과 함께 침출된 것으로 추정 된다23). 침출 용액에서 분석된 맥석광물에 대한 염배소-수침출 과정을 화학식으로 나타내면 식 (4), (5), (6), (7)과 같다.
[염배소]
[수침출]
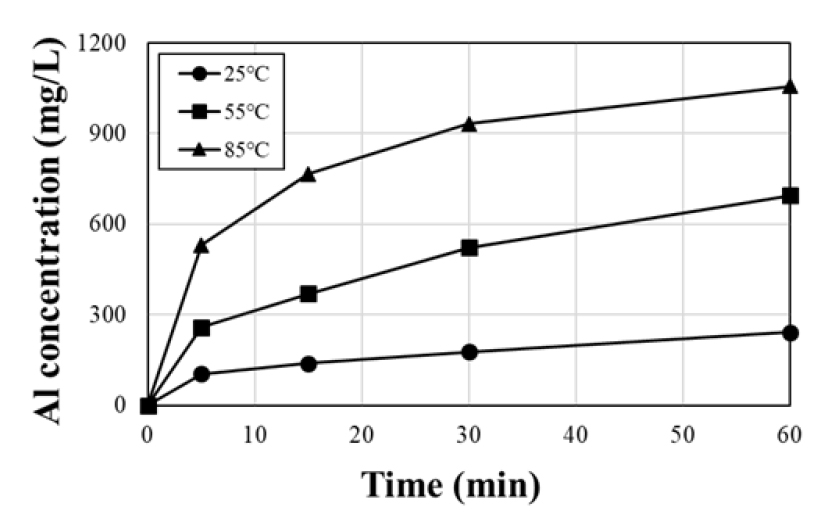
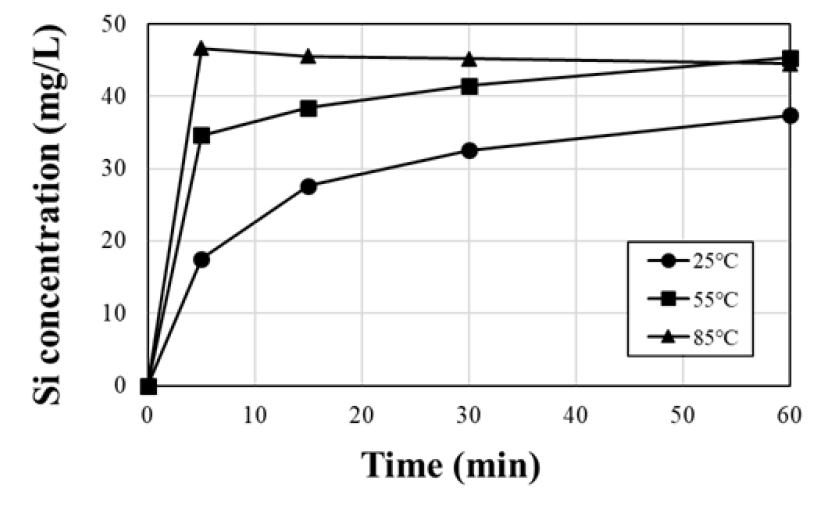
침출 결과, Fig. 5와 Fig. 6과 같이 시간 변화에 따른 알루미늄과 실리콘의 침출 농도가 온도 상승에 따라 증가하는 것으로 확인되었으며 특히 알루미늄의 경우 1시간 경과 시 25 °C, 241.2 mg/L에서 85 °C, 1056 mg/L로 크게 증가하였다. Xiaobo Zhu 등(2016)의 바나듐 침출액으로부터 바나듐 회수에 대한 불순물 영향 연구에 따르면, 바나듐 침출액 내 알루미늄 농도가 증가함에 따라 알루미늄바나데이트(AlVO4)의 생성되어 바나듐의 회수율은 감소하였을 것으로 보고되었다24). 본 연구에서도 고온에서 침출된 알루미늄, 실리콘 등의 고농도 불순물이 바나듐 침출을 저해한 것으로 사료된다. 따라서 불순물의 영향을 줄이고 바나듐의 침출율을 높이기 위해 이후 실험의 침출 온도는 25 °C로 설정하였다.
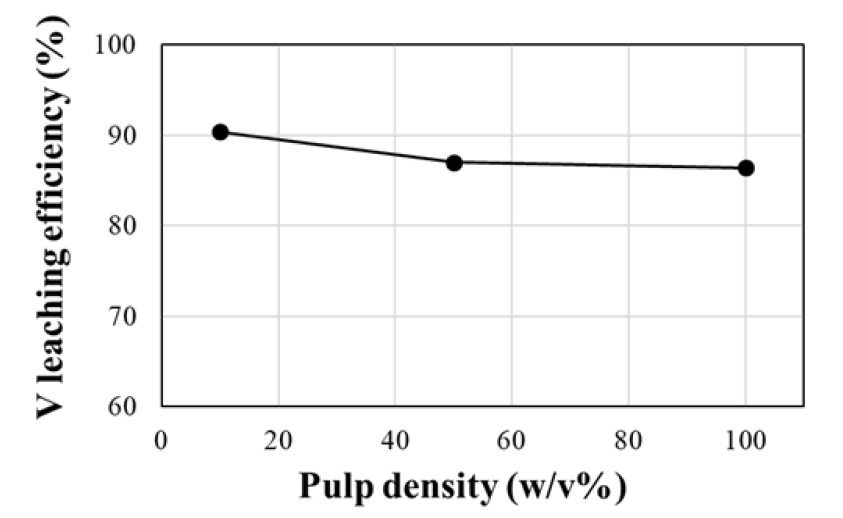
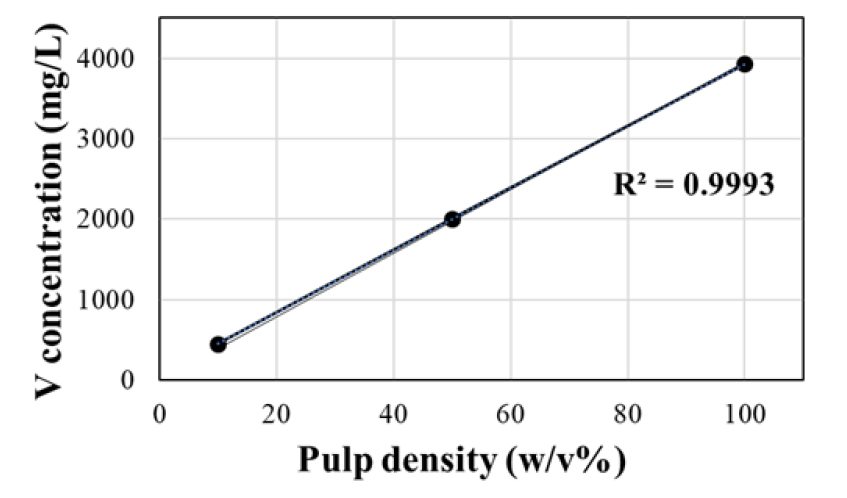
온도 조건에 대한 침출 실험에 이어 분쇄된 염배소 산물에 대해 광액 농도를 변화시키면서 25 °C, 300 rpm 조건에서 1시간 동안 침출하였다. 바나듐의 침출율은 Fig. 7에 나타낸 바와 같이 광액농도가 10, 50, 100 w/v% 등으로 높아질수록 다소 감소하는 것으로 나타났으나 90.4, 87.0, 87.0%로 변화폭이 크지 않은 것으로 분석되었다. Fig. 8은 광액 농도 증가에 따른 바나듐 침출 농도를 나타낸 것으로서 바나듐 농도가 광액 농도 증가에 따라 선형적으로 증가함(R2=0.9993)을 확인하였다. 따라서 1회 침출 시 더 많은 양의 바나듐을 회수할 수 있는 100 w/v%의 광액 농도가 효율적인 것으로 판단하였다. 수침출 영향인자에 대한 실험 결과, 염배소 산물로부터 바나듐 회수를 위한 최적의 침출 조건은 온도 25 °C, 광액 농도 100 w/v%이다.
3.2. 다단침출에 따른 염배소 산물 침출 거동 분석
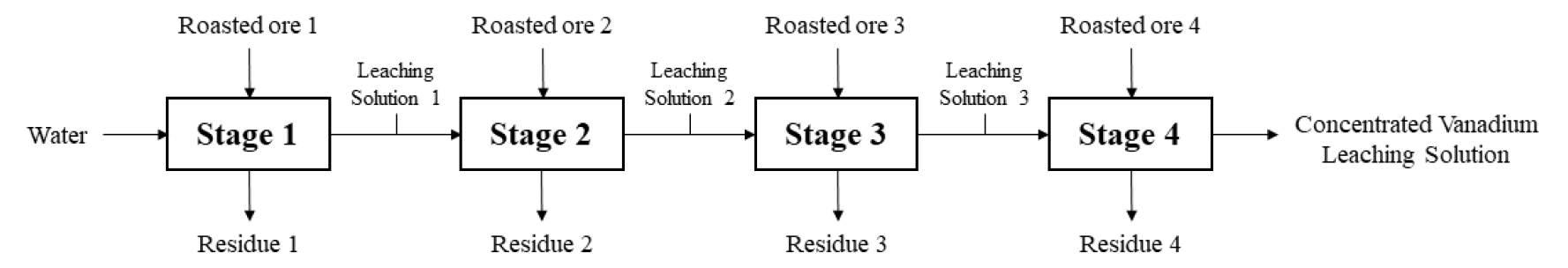
효율적으로 바나듐을 회수하기 위해 고농도 바나듐 용액을 제조하고자 하였다. 본 연구에서 침출하고자 하는 소듐바나데이트 화합물은 수상에서 높은 용해도(15.07 g-NaVO3/100 g-water)23)를 가지고 있으며 수침출 연구 결과에 따라 광액농도 100 w/v%일 때 약 90%의 바나듐 침출율을 보이므로, 주어진 수용액 내 다량의 바나듐을 농축시키기 위해 Fig. 9와 같이 다단 침출을 수행하였다.
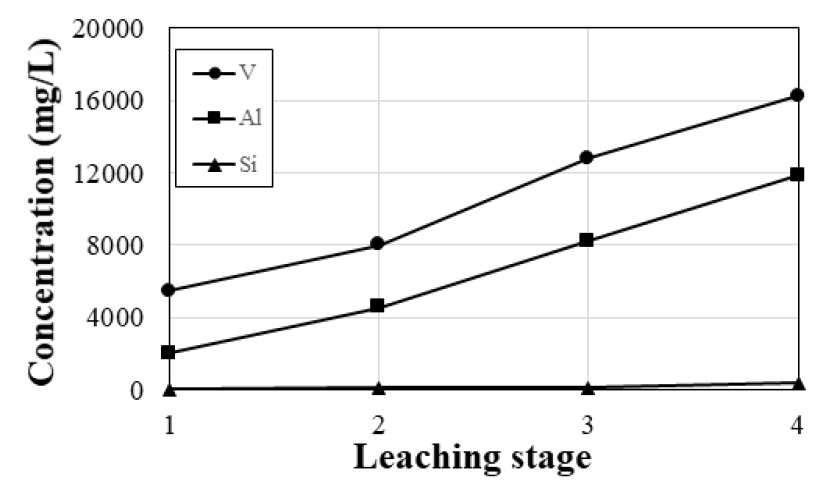
다단 침출은 수침출 영향인자에 따른 연구 결과를 바탕으로 25 °C, 300 rpm, 100 w/v% 조건에서 1시간 동안 수행하였다. 1단 침출 후 발생되는 침출액에 대해 새로운 염배소 산물을 첨가하여 2단 침출 실험을 반복함으로써 2단 침출의 가능성을 조사하였으며, 4단 침출까지 완료한 결과를 Fig. 10에 나타내었다. Fig. 10에서 볼 수 있는 바와 같이 바나듐의 농도는 4단 침출 시 약 16.20 g/L이고 알루미늄과 실리콘의 농도는 각각 11.85 g/L, 0.38 g/L로 분석되었다. 5단 침출 시 바나듐의 농도는 16.6 g/L로 분석되어 추가적인 침출 효과가 미미하였으므로 4단 침출이 적합한 침출 조건이라 판단하였다. 따라서 고농도 바나듐 용액의 제조는 4단 침출을 통해 가능하며 이를 통해 침출수의 소비와 폐수의 발생을 줄이고 침출 공정의 효율을 높일 수 있을 것으로 예상된다.
4. 결 론
본 연구에서는 탄산나트륨을 사용하여 염배소한 VTM 정광으로부터 바나듐을 효율적으로 회수하기 위해 수침출 거동을 조사하였다. 수침출의 영향인자로 온도와 광액농도를 선정하여 바나듐 침출에 미치는 영향을 확인하고 고농도의 소듐바나데이트 침출용액을 제조하였으며 다음과 같은 결론을 얻을 수 있었다.
1. 침출 온도가 증가할수록 바나듐 침출율은 다소 감소하였으며 알루미늄, 실리콘 등의 불순물 농도는 증가하였다. 따라서 고온 침출에 의해 발생하는 고농도의 불순물이 바나듐의 침출에 영향을 미치는 것으로 사료된다.
2. 광액 농도에 따른 바나듐 침출율 변화는 크지 않으며 이는 수상에서 소듐바나데이트의 높은 용해도(15.07 g-NaVO3/100 g-water)에 기인한다. 따라서 공정 효율을 고려한 최적의 침출 조건은 25 °C, 100 w/v%, 300 rpm이다.
3. 침출 공정을 고효율화하고 폐수의 발생을 줄이기 위해 다단 침출을 수행한 결과, 총 4단 침출 후 최종 침출액의 바나듐 농도는 16.20 g/L로 분석되며 고농도의 소듐바나데이트 용액 제조가 가능하였다.