1. 서 론
2. 실험 및 분석방법
3. 결과 및 토의
3.1. 1M NaOH를 이용한 나트륨 탄산염화합물 결정화
3.2. 2M NaOH를 이용한 나트륨 탄산염화합물 결정화
4. 결 론
1. 서 론
산업이 발달함에 따라 인류는 다양한 특성을 갖는 소재를 개발하여 이를 산업 특성에 맞는 용도로 활용하고 있다. 이 중 탄산칼슘과 중탄산칼슘은 기존 소재산업뿐만 아니라 식품 분야에서도 활발히 사용하고 있는 나트륨 화합물이다. 탄산나트륨(Na2CO3)의 경우, 유리 가공 과정에서 자외선 차단제1)로 사용하고 있으며 상수도의 정수 과정 중 pH 조절제2) 및 바이오매스 열분해 촉매3)로도 활용하고 있다. 중탄산나트륨 경우, 의약품(제산제 등)4)이나 베이킹파우더5) 또는 소각공정에서 배출되는 산성가스 제거제6) 등과 같은 용도로 사용하고 있다. 중탄산나트륨은 국내 제조업체 부재로 전량 수입에 의존하고 상황이며 대부분을 중국(약 94%)으로부터 수입하고 있다7). 하지만 2017년 이후 중국의 ‘공해와의 전쟁’ 정책 수행으로 수요 및 가격은 지속적으로 상승하고 있는 상황이다.
탄산나트륨은 공업적으로 솔베 공정(또는 암모니아 소다법)을 통해 합성 가능하며 중탄산나트륨 또한 이 과정에서 중간물질로 생성된다8). 탄산나트륨은 솔베 공정 중 포화식염수 내 CO2 탄산화로 부터 합성한 중탄산나트륨의 열분해를 통해 얻어진다. 이 과정에서 해수를 농축시킨 간수를 포화식염수로 이용하고 있다. 염전에서 발생하는 간수는 산업에서 배출되는 대표적인 나트륨 농축수 중 하나며 우리나라에서 천일염의 생산 공정에서 발생하는 간수는 매년 10만 톤 이상으로 추정하고 있다. 하지만 식품가공용 및 폐수 처리용을 제외하고는 대부분 폐기되고 있으며 전남지역 염전에서 발생한 간수의 경우, 나트륨의 함량이 해수의 약 5배로 높은 것으로 보고된 바 있다9).
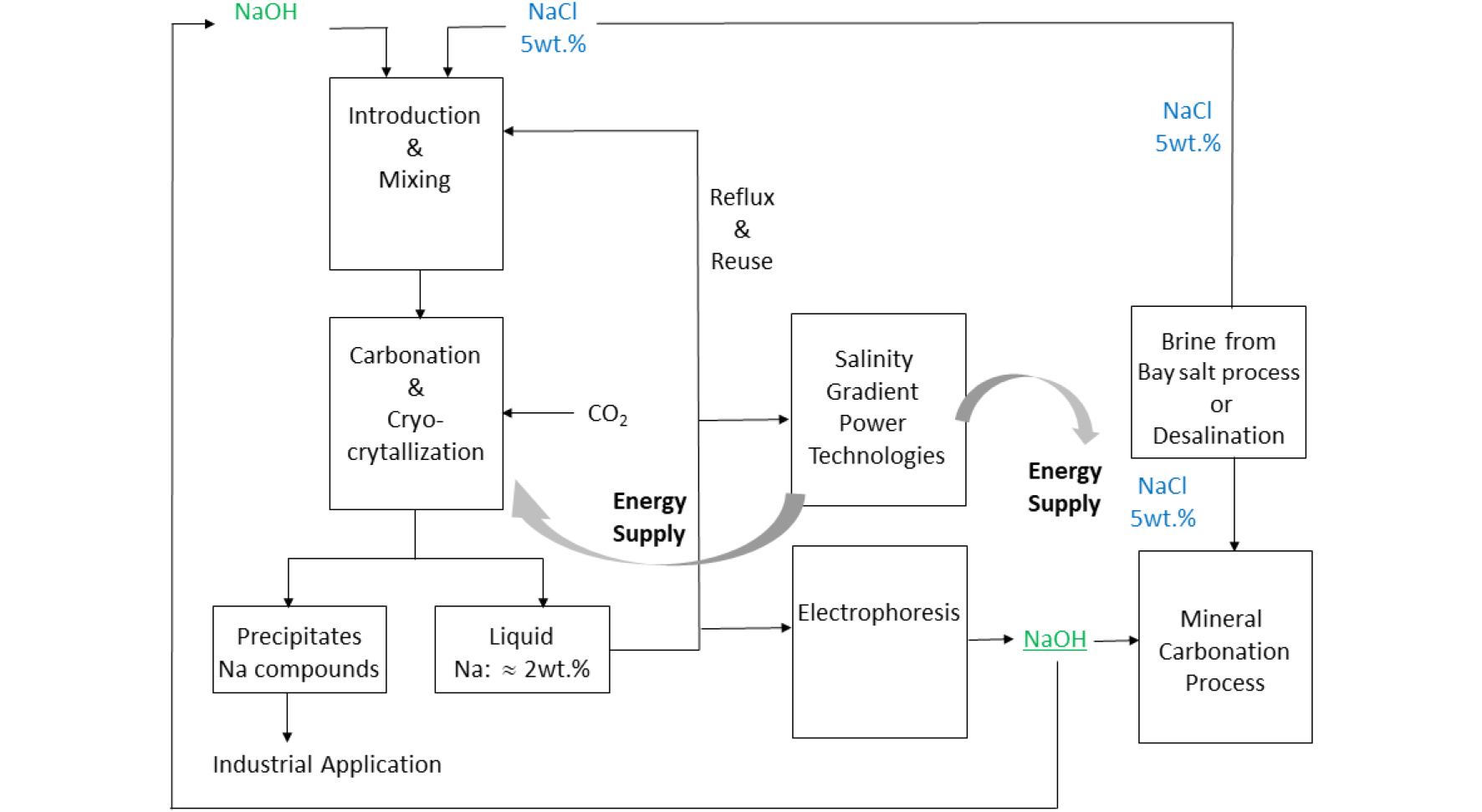
배출 용량과 배출 용액 내 나트륨 성분의 균일성 및 순도를 고려할 때 또 다른 대표적인 나트륨 농축수는 해수담수화 공정에서 부산물로 얻어지는 농축수를 예로 들 수 있다. 해수 담수화 플랜트에서 역삼투압 방식으로 1 톤의 담수를 생산할 경우, 기존 해수보다 2배의 나트륨과 마그네슘 등이 포함된 농축수(또는 농축염수)가 발생한다10). 이들 나트륨 농축수로부터 나트륨 화합물을 선택적으로 분리할 수 있는 기술 개발은 자원 재순환 관점에서 뿐만 아니라 미래 환경 관리 측면에서도 요구되는 상황이다.
본 연구에서는 NaOH와 NaCl을 출발물질로 사용하여 CO2 탄산화 및 저온 결정화 기술을 통해 나트륨 화합물을 합성하고자 하였다. NaOH는 염기성 조건을 유도함으로써 이산화탄소의 탄산 이온 생성을 촉진하고 이를 통한 CO2 포화도 증진 물질로 이용하였고 NaCl은 산업에서 배출되는 농축수를 산정하여 대상물질로 이용하였다. 본 연구에서는 반응 온도 조절 및 이에 따른 이산화탄소 용해도와 pH 변화를 통해 탄산화 반응 속도를 조절하고자 하였으며 저온 결정화 방법을 통해 나트륨 화합물의 결정 성장 및 나트륨 화합물의 순도 향상을 위한 연구를 수행하였다.
2. 실험 및 분석방법
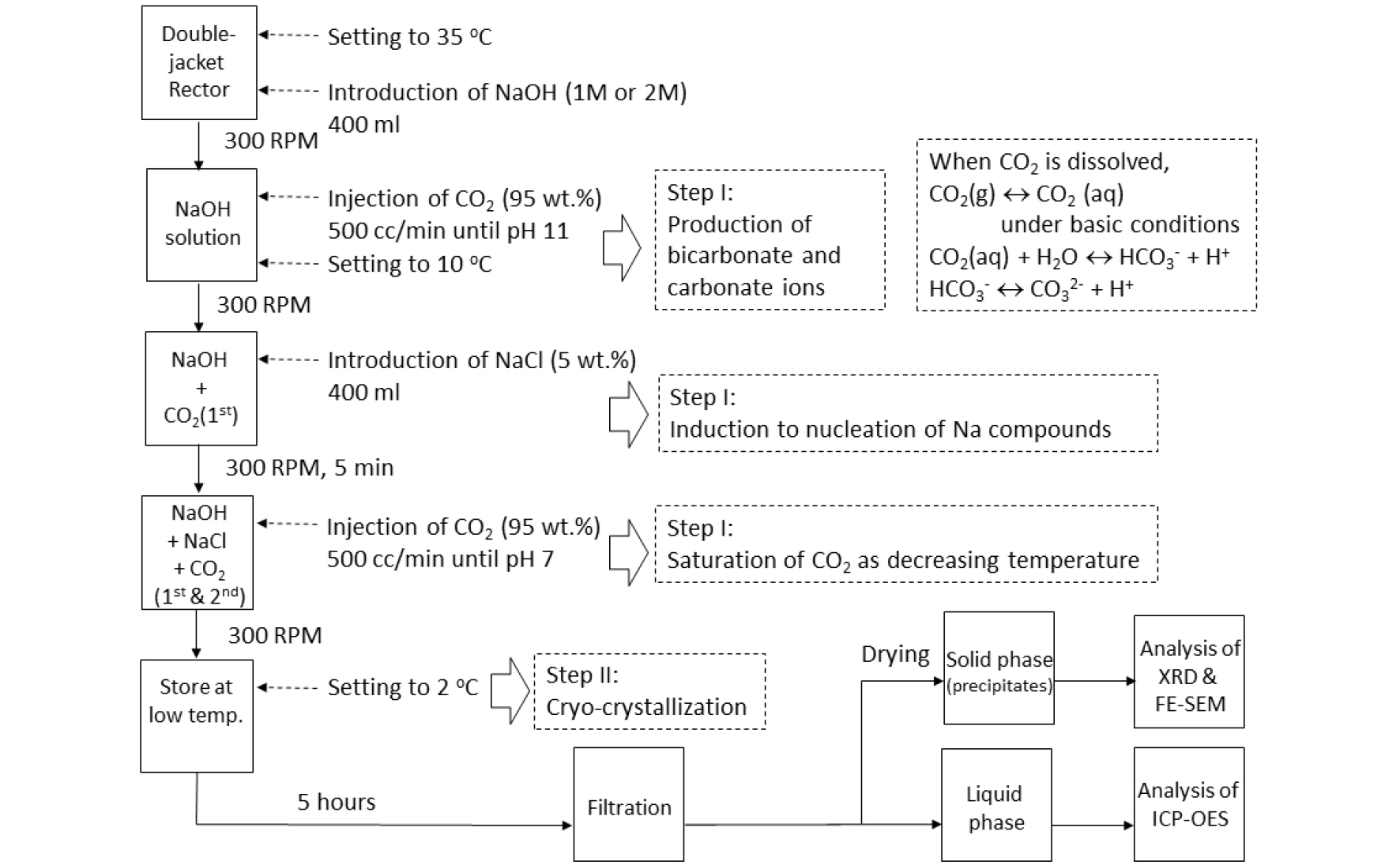
본 연구에서 사용한 반응기는 이중자켓 반응기(double jacket reactor)로 항온수조(water bath)(RW 3025G, JeioTech)를 결합하여 온도 설정과 항온 유지가 가능하도록 설계하였다(Fig. 1). 항온수조를 이용하여 이중자켓 반응기 내로 온도를 조절한 물을 공급함으로써 반응온도를 조절할 수 있었다. 또한 pH meter(Mettler Toledo 1140, Germany)를 사용하여 용액 내 pH 변화를 측정하였다. 실험에 사용한 NaOH과 NaCl 용액은 1급 시약과 증류수를 사용하여 각 농도에 적합하게 제조하였다. NaOH는 이산화탄소 포화도를 증진시키는 염기성 물질로 이용하였고 NaCl은 산업에서 배출되는 농축수를 산정하여 대상물질로 이용하였다.

Fig. 1.
Experimental system for the precipitation of sodium compounds using carbonation and cryo-crystallization. The reaction temperature was controlled by double jacket reactor and water bath. The pH value was recorded by pH meter. CO2 (95 wt,% above) was used for the source of carbonate ion. The mixing rate was 300 RPM.
본 실험은 NaOH 용액을 초기 온도 35 ℃에서 10 ℃까지 냉각시켜 탄산 이온 생성을 촉진함과 동시에 나트륨 화합물의 핵생성 유도 및 CO2 포화 단계(step I) 그리고 2 ℃ 온도 범위에서 진행되는 저온 결정화(cryo-crystallization) 단계(step II)로 구분할 수 있다(Fig. 2).
Step I 에서 반응기의 온도는 35 ℃로 설정하였으며 수산화나트륨(NaOH) 용액(400 ml)을 반응기에 인입한 후 설정 온도 도달과 동시에 실험을 진행하였다. 출발물질인 NaOH 수용액은 1 M과 2 M 농도로 제조 후 각각 실험을 진행하였으며 초기 NaOH 용액의 pH는 약 12.5 ~ 14.1 값을 갖는 강한 염기성 특성을 가지고 있음을 알 수 있었다.
반응기 내 이산화탄소(95 vol.%)의 1차 공급(500 cc/min)은 NaOH 용액의 pH가 11에 도달할 때까지 주입하였으며 주입 후 반응기의 온도를 10 ℃로 설정하였다. 이는 염기성 조건을 유지함과 동시에 이산화탄소를 중탄산 이온 및 탄산 이온으로 쉽게 전환시키기 위한 목적이었다11). Step 1 과정에서 1차 공급한 이산화탄소의 주입을 pH 11에서 중지한 것은 중탄산 이온 및 탄산 이온을 용액 내 존재하게 함으로써 다음 과정에서 공급될 NaCl과 나트륨 화합물의 핵생성을 용이하게 하기 위한 전처리 과정이라 할 수 있다. 이산화탄소 포화 용액과 인공 농축수의 혼합 후 백색 침전체 생성을 확인 할 수 있었다.
반응기 온도가 10 ℃에 도달하면 NaCl(5 wt.%, 400 ml)을 반응기에 투입한 후 300 RPM 교반 속도로 5분간 혼합하였다. 이후 혼합 용액의 pH가 7을 유지할 때까지 분당 500 cc의 이산화탄소(95 wt.%)를 주입하였다. 이와 같은 냉각 과정과 추가적인 2차 이산화탄소 주입은 용액 내 CO2 용해도를 증가시키기 위한 것으로, 가스 상태인 이산화탄소 용해도는 온도에 반비례한다는 원리를 이용하였다.
이산화탄소 2차 주입 후 반응기내 용액은 저온 냉장고(2 ℃)에서 5시간 보관하였다. 이는 저온에서 결정화를 유도함으로써 나트륨 화합물의 결정 성장을 유도하였다. 실험을 진행하는 동안 step I 단계에서 반응기의 혼합 속도는 용액 내 탄산 이온과 나트륨 이온의 상호 반응을 고려하여 300 RPM으로 일정하게 유지하였다.
저온 결정화 과정 이후 용액 내에는 백색 형태의 침전체를 뚜렷히 확인할 수 있었고 여과 과정을 거쳐 고체상과 액체상으로 분리하였다. 고체상은 건조 후 에너지 분산형 X-선 분석기(EDS, energy-dispersive X-ray spectroscopy) (XFlash 6, Bruker)를 장착한 전계방출형 주사전자현미경(FE-SEM, field emission scanning electron microscope) (MERLIN, Carl Zeiss)을 사용하여 표면 형상 및 표면 원소 분석을 수행하였다. 또한 침전체의 결정상(crystalline phase) 분석은 X-선 회절 분석(XRD, X-ray Diffraction) (X’pert MPD, Philips)을 이용하여 분석하였다. 저온 결정화 후 침전체를 제거한 액체상은 유도 결합 플라즈마-광학 방출 분석기(ICP-OES, Inductively Coupled Plasma- Optical Emission Spectroscopy(Optima 5300 DV, Perkin Elmer)를 이용하여 용액 내에 존재하는 나트륨 및 알칼리 이온의 함량을 분석하였다.
3. 결과 및 토의
3.1. 1M NaOH를 이용한 나트륨 탄산염화합물 결정화
1M NaOH를 사용하여 핵생성 유도 및 저온 결정화 과정을 진행한 후 용액 내 침전체를 확인할 수 있었다. 여과 및 건조 과정을 거친 후 침전체의 형상을 전자현미경으로 분석한 결과, 불규칙적인 형상을 갖는 물질들(Fig. 3a and Fig. 3d)로 침전체가 이루어져 있다는 것을 알 수 있었다. 하지만 일정 부분은 rod 형태를 띠는 물질을 포함하고 있다는 것을 확인할 수 있었다(Fig. 3b and Fig. 3c).
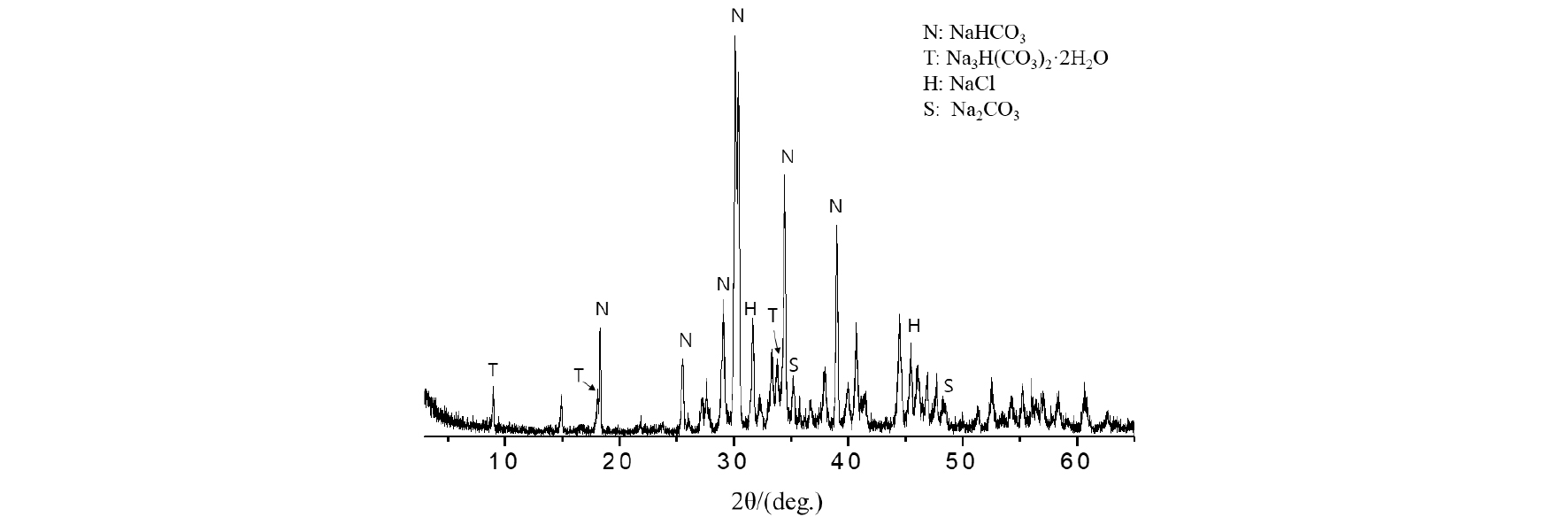
X선 회절분석 결과(Fig. 4), 침전 물질은 중탄산나트륨(NaHCO3)과 2 수화물을 갖는 탄산나트륨(Na3H(CO3)2· 2H2O) 그리고 NaCl과 탄산나트륨(Na2CO3)을 포함하고 있다는 것을 알 수 있었다. 또한, X선 회절분석을 통해 확인 한 NaCl은 반응물질로 사용한 NaCl(5 wt.%)의 미반응 물질이거나 반응 과정에서 재결정화(recrystallization)를 통해 얻어진 산물로 판단된다.
전자 현미경 분석 결과(Fig. 3) 및 X-선 회절 분석 결과(Fig. 4)를 통해 rod 형태를 띠는 물질은 중탄산나트륨(NaHCO3) 또는 수화물을 갖는 탄산나트륨(Na3H(CO3)2· 2H2O)으로 예상할 수 있었다.
1M NaOH 용액의 초기 pH는 13.2-13.5 범위로 강한 염기성 특성을 나타내었다. 초기 반응기 온도를 35 ℃로 설정하고 pH 11에서 1차 CO2 주입을 중지한 이유는 용액 내 중탄산 이온 및 탄산 이온의 생성을 용이하게 할 목적이었다. 평형 조건에서 기체상의 이산화탄소가 수용액 내에서 탄산이온으로 전환되는 과정은 크게 3부분으로 구분할 수 있다. 우선적으로 기체상의 CO2가 용해하여 수용액 상의 이산화탄소의 생성과정, 그리고 수용액 상의 CO2가 중탄산 이온으로 전환되는 과정 및 마지막으로 중탄산 이온에서 수소 이온이 탈리하여 탄산 이온으로 전환되는 과정이다12). 이들 과정을 결정하는 중요변수는 일차적으로 pH이며 실험에서 1차 CO2 주입 시 용액의 pH 값이 11이였던 점을 고려할 때 용액 내 해리된 이산화탄소는 탄산 이온 또는 중탄산 이온으로 안정적으로 존재할 수 있다. 탄산 이온이 포화 상태로 안정적으로 존재하는 조건에서 NaCl 용액을 주입함으로써 나트륨 화합물의 탄산화 및 결정성장을 위한 핵생성을 유도하고자 하였다.
기체 상태의 이산탄소주입량은 CO2 용해도에 의해 결정되며, 용해도를 결정하는 핵심 변수는 온도다. 2차 이산화탄소 주입 전 반응 용액의 온도를 10 ℃로 설정한 이유는 용액 내 CO2 포화 용해도를 증가시키고자 함이었다. 35 ℃에서 이산화탄소의 용해도는 약 0.11 g인 반면에 10 ℃에서 이산화탄소 용해도는 약 0.23 g으로 반응 온도가 감소함에 따라 약 2배 이상 증가한다(Fig. 5).
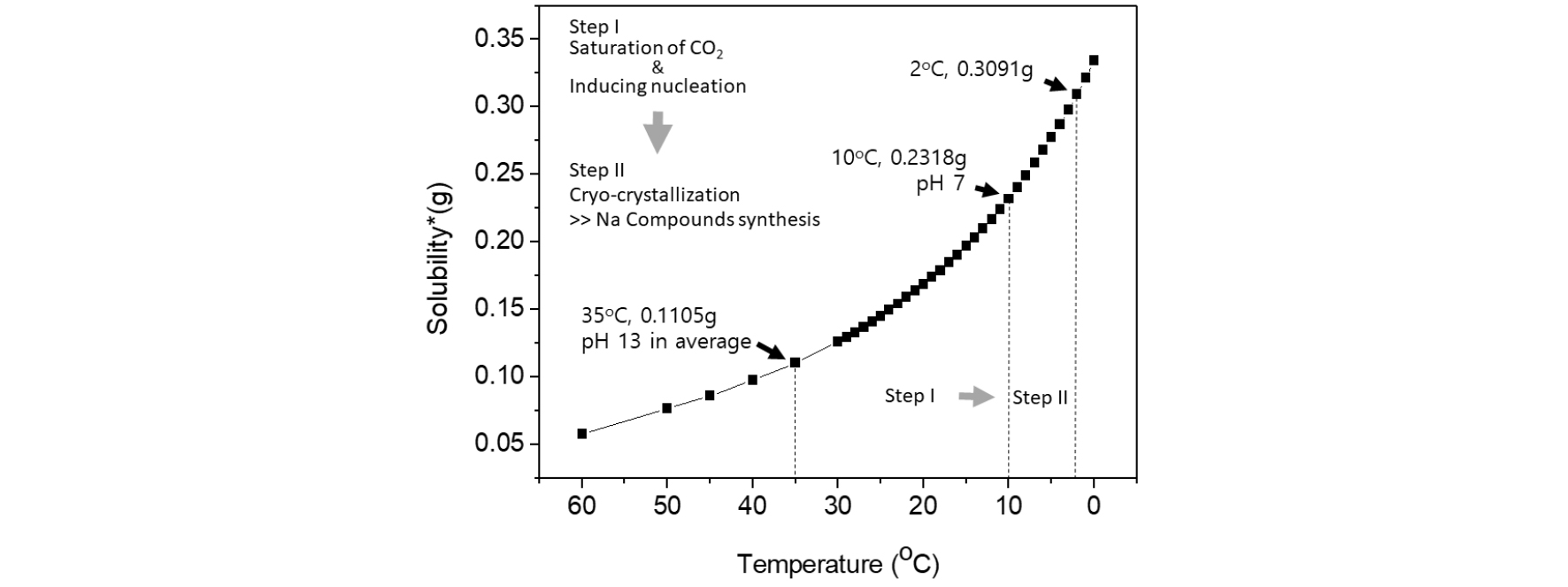
Fig. 5.
Experimental process (step I and II) and solubility of CO2 in water under 1 bar. The solubility of CO2 is calculated based on 100 g of water and is plotted by the data of Dodds et al.15).
온도가 감소함에 따라 용액의 pH는 감소할 수 있지만 탄산 이온의 생성을 극대화 할 수 있고 중탄산나트륨(NaHCO3)과 탄산나트륨(Na2CO3)과 같은 나트륨 화합물의 분해가 진행되지 않는 pH 7까지 이산화탄소를 2차 주입하였다. 이는 탄산 이온의 관점에서 반응을 고려한다면, pH를 높게 유지할 경우 탄산 이온으로 전환될 수 있는 이산화탄소의 용해량이 부족할 수 있으며 이는 나트륨 화합물의 탄산화 속도를 느리게 진행함에 따라 결과적으로 핵생성 및 결정성장 속도에 영향을 줄 수 있다는 것이다. 따라서 본 실험에서는 이를 고려하여 반응 온도를 10 ℃로 유지하면서 pH 값 7까지 이산화탄소를 주입하였다(step I in Fig. 5).
1M NaOH를 사용하여 반응 온도를 변화(35 ℃에서 10 ℃) 시키고 이 과정에서 이산화탄소와 NaCl(5 wt.%)를 공급하여 나트륨 화합물 합성을 위한 탄산화 반응을 진행하였다. 탄산화 반응 후 용액은 2 ℃ 냉장고에 5시간동안 침전체 생성을 위해 저온 결정화(cryo-crystallization)을 거쳤다(step II in Fig. 5). 결정화를 유도할 수 있는 중요 변수는 농도 구배(△C)며 농도 구배 정보로부터 준안정 영역(metastable zone)을 예측할 수 있으며 준안정 영역의 인위적 변화에 따라 결정화를 유도할 수 있다13). 또한 농도 구배를 변화시킬 수 있는 핵심 변수는 온도 및 압력이며 본 실험에서는 대기압(1 bar) 조건에서 온도를 변화시켰다.
본 연구의 목적은 산업체에서 배출되는 나트륨 농축수로부터 나트륨 화합물의 생성을 용이하게 하는 공정을 개발하고자 일차적으로 인공 농축수를 사용하여 침전체 합성 가능성 및 공정 조건을 검토하고자 하였다. 공정의 경제성 확보를 위해서는 기존 나트륨 화합물의 산업적 활용성을 고려해야 하는데 이를 반영하면 중탄산나트륨과 탄산나트륨을 우선적으로 고려 대상으로 둘 수 있다. 중탄산나트륨과 탄산나트륨의 용해도(물을 기준)는 온도가 감소할수록 감소하는 특성을 가지고 있다(Table 1). 이와 같은 중탄산나트륨과 탄산나트륨의 용해도 특성은 이 물질들의 합성에 있어 저온 결정화가 다른 어떤 농축 기술보다 유리한 공정으로 활용될 수 있음을 의미한다.
Table 1.
Solubility of sodium bicarbonate and sodium carbonate in water14)(unit: g/L)
| Compounds\Temperature (°C) | 0 | 60 |
| NaHCO3 | 64.8 | 137.0 |
| Na2CO3 | 64.4 | 317 |
3.2. 2M NaOH를 이용한 나트륨 탄산염화합물 결정화
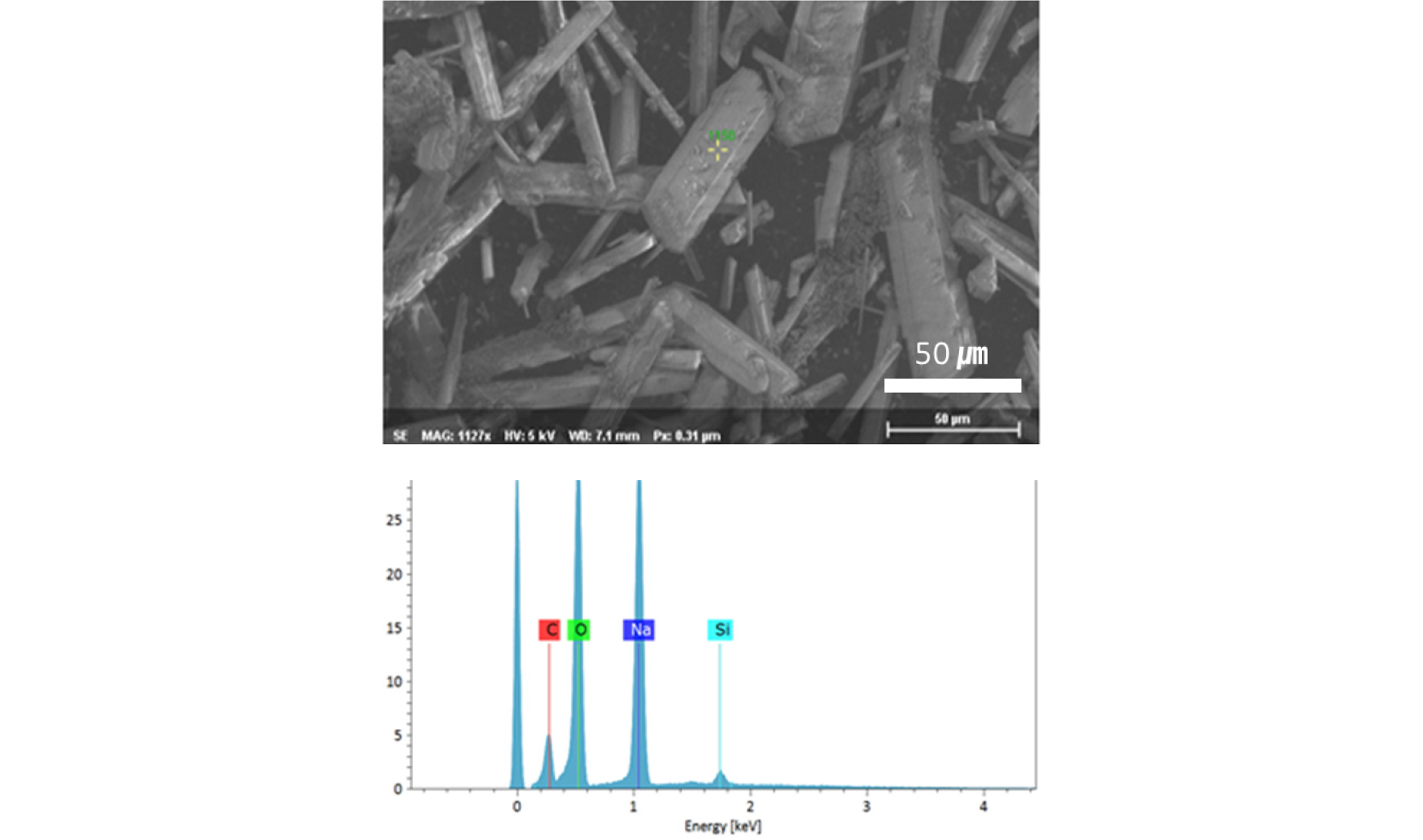
2M NaOH를 이용하여 탄산화 및 저온결정화 과정을 진행한 결과 역시 1M NaOH와 마찬가지로 백색의 침전체(약 20 g)를 얻을 수 있었다. 전자현미경 분석 결과, 침전체는 수십 마이크로미터 크기를 갖는 rod 형태의 물질임을 알 수 있었다(Fig. 6). 이들 rod 물질의 장축의 길이는 약 20 ~ 100 ㎛ 내외였으며 단축의 길이는 2 ~ 10 ㎛ 내외로 평균 종횡비(장축길이/단축길이)는 약 10내외 값을 가진다는 것을 알 수 있었다(Fig. 6c). 흥미로운 점은 하나의 rod가 단결정이 성장하여 이루어진 형상이 아닌 작은 물질들의 결합 형태로 합성되었을 수도 있음을 보여준다는 것이다(Fig. 6d). 탄산화 및 저온 결정화 과정을 통해 용액 내 반응변수(온도 및 pH 등)를 변화시킨 점을 고려할 때 핵생성 및 결정성장이 불 균질적으로 진행되어 이와 같은 요소들이 결정 물질의 불안정성을 유발하였을 것으로 판단된다. 또한, EDS 분석한 결과(Fig. 7)는 침전된 결정들이 나트륨(Na) 및 산소(O)와 탄소(C)로 이루고 있으며 각각의 atomic %는 Na(32.70) 및 O(53.26)와 C(11.43)로 구성되어 있음을 보여주었다. 미량의 Si(2.61)이 확인되었으나 이후 진행한 X-선 회절 분석 결과와 비교하여 판단할 때, 이는 샘플 홀더의 영향인 것으로 확인되었다.
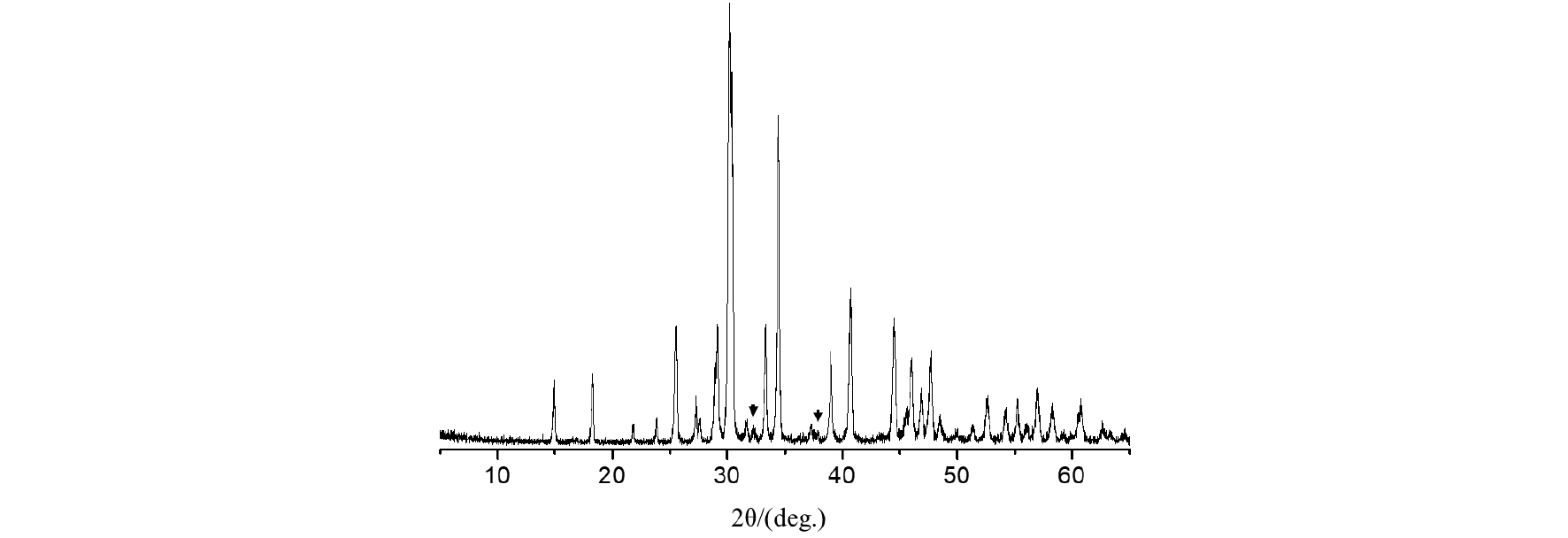
X-선 회절 분석 결과를 통해 2M NaOH를 이용하여 얻어진 백색의 결정들의 결정학적 정보를 명확히 확인할 수 있었다(Fig. 8). 이들은 중탄산나트륨(Na3HCO3) 및 1 수화물을 갖는 탄산나트륨(Na2CO3·H2O)으로 이루어져 있음을 알 수 있었다. 따라서 전자 현미경 분석결과(Fig. 6)로부터 확인하였던 각진 rod 형태의 물질은 나트륨 화합물일 것으로 예상할 수 있다. 또한 X-선 회절 분석 결과(Fig. 8) 중 주피크인 30° 및 34°부근 피크들이 NaHCO3이며 Na2CO3·H2O(Fig. 8의 검은 화살표)이 주피크들의 강도가 매우 낮은 점을 고려할 때, 합성 물질은 대부분은 중탄산나트륨이며 이들이 rod 형태를 갖는 물질임을 알 수 있었다. 1M NaOH를 사용한 경우와 비교하여 2M NaOH를 사용한 경우에서는 침전물의 양이 약 3배 증가하였고 나트륨 화합물의 결정 성상 또한 중탄산나트륨과 1 수화물 형태의 탄산나트륨만이 존재한다는 차이를 보였다. 이는 합성 나트륨 화합물의 산업적 활용 측면을 고려할 때 상대적으로 높은 농도의 NaOH를 사용하는 것이 유리할 수 있다는 것이다. 다만, 이에 대한 선결조건으로는 산업부산물로서 고농도의 NaOH를 주기적으로 공급할 수 있어야 한다는 것과 저농도 NaOH를 농축하는 공정이 필요한 경우에는 두 경우에 대한 공정비용 계산을 통한 경제성 평가 과정이 필요할 것이다.
1M NaOH와 2M NaOH를 각각 사용하여 탄산화 및 저온 결정화 과정 후 용액 내 존재하는 나트륨 및 알칼리 금속의 농도를 분석한 결과(Table 2), 용액 내 나트륨의 농도는 2.0% 미만이었다. 이는 추가 에너지의 투입이 없다면, 탄산화 및 저온 결정화를 통한 얻을 수 있는 나트륨 농도의 최저값이 존재하며 이 또한 공정 평가의 주요 변수로 작용할 수 있다는 것이다.
Table 2.
Concentration of alkali and alkali earth metals in solution after cryo-crystallization (unit: mg/L)
| Concentration of NaOH | Na | Mg | K | Ca |
| 1M | 19,200 | <1.0 | 9.87 | 3.44 |
| 2M | 18,800 | <1.0 | 8.27 | 5.44 |
흥미로운 점은 실험에 사용한 NaOH 농도에 상관없이 탄산화 및 저온 결정화 공정까지 진행시킨 용액 내에 존재하는 나트륨의 농도는 해수담수화에서 배출되는 농축수 내에 존재하는 나트륨 함량(약 20,000 ppm)16)과 매우 유사한 값을 보였다. 이와 같은 결과는 본 연구에서 진행한 탄산화 및 저온 결정화 공정을 이용하여 나트륨이 일정량 이상 존재하는 용액으로부터 나트륨 화합물의 합성뿐만 아니라 공정 후 용액 내 나트륨의 함량을 해수담수화의 농축수 수준까지 저감할 수 있는 잠재적 기술임을 의미한다. 아울러 본 연구에서 확보한 기술과 에너지 및 환경 관련 공정(해수담수화 및 광물탄산화 기술 등)과의 융합 공정 가능성을 검토하기 위한 기초자료로 활용될 수 있을 것으로 판단된다. 그러나 산업에서 배출되고 있는 나트륨 농축수를 통합 공정에 적용하기 위해서는 나트륨 제거 효율을 높여야 한다는 점과 나트륨 이외의 첨가 이온에 대한 검토뿐만 아니라 나트륨 이외의 원소(brine의 경우는 Cl)에 대한 분리 및 활용 기술 개발에 대한 추가 연구가 무엇보다도 필요하다.
나트륨 농축수가 배출되는 산업 공정(해수 담수화 등)과 나트륨 농축수를 이용할 수 있는 기술(광물탄산화 및 염분차 발전 등)간의 연계 및 이를 통한 통합 공정(Fig. 9) 개발은 각 공정이 가지고 있는 단점을 상호 보완할 뿐만 아니라 물·에너지·기후변화 등과 같은 시대적 가치를 향상시킬 수 있는 기술의 개발이 가능한 영역일 것이다. 본 연구를 통해 확보한 나트륨 화합물 합성 공정을 기반으로 해수다수화로부터 발생하는 나트륨 농축수 및 전기분해를 통해 생산한 수산화나트륨을 출발 물질로 이용하고 저온 결정화 이후 용액은 염분차 발전 및 전기분해의 대상물질로 활용할 수 있을 것이다. 다만 산업적 활용을 위해서는 통합 공정에 대한 효율 및 공정비용에 대한 구체적이고 정확한 정보(물질 및 에너지 수지 등)가 요구되며 이는 향후 각 공정별 장·단점 및 공정비용에 대한 경제성 평가연구에서 구체적으로 논의하기를 희망한다.
4. 결 론
탄산화 반응 및 저온 결정화 공정을 이용하여 나트륨 농축수로부터 나트륨 화합물(NaHCO3와 Na2CO3·H2O 포함)을 합성할 수 있었다. 본 연구를 통해 얻어진 결과를 정리하면 다음과 같다.
- 실험 과정은 크게 두 단계로 구분하여 진행하였다. 먼저, 이산화탄소를 용액 내 포화시키는 단계와 나트륨과 포화된 이산화탄소를 상호 반응 시키는 탄산화 단계(step I) 그리고 탄산화 반응 후 온도를 냉각함으로써 결정화 단계의 준안정영역을 빠르게 감소시킴으로써 침전체를 유도하는 결정화 단계(step II)로 진행하였다.
- 1 M과 2 M NaOH를 사용한 경우 모두에서 침전체로 합성된 나트륨 탄산염 화합물은 rod 형태를 갖는 물질을 함유하고 있었다. 특히, 2M NaOH를 사용할 경우에서는 rod 형태의 나트륨 화함물 침전체가 대부분을 차지하였다.
- 2 M NaOH를 사용한 경우에서는 중탄산나트륨(NaHCO3)과 1 수화물 형태의 탄산나트륨(Na2CO3··H2O)만으로 이루어진 침전체를 합성할 수 있었다.
- 탄산화 및 저온 결정화 공정을 완료한 용액 내 나트륨의 함량은 약 2.0% 미만으로 해수담수화에서 배출되고 있는 농축수(concentrated sodium slution 또는 brine)의 나트륨 함량과 유사한 값을 보여주었다.
본 연구를 통해 탄산화 및 저온 결정화 기술이 나트륨 농축수로부터 나트륨 화합물을 합성하는데 잠재적 가치를 가질 수 있다는 것을 확인할 수 있었다. 다만, 산업에서 배출되는 나트륨 농축수에 대한 적용을 위해서는 농축수 성상 및 배출량 등을 고려한 공정변수에 대한 연구가 선행되어야 할 것이다.