1. 서 론
2. 실험방법
3. 실험 결과 및 고찰
3.1. 폐원자재 시료 분석
3.2. Taguchi 방법을 이용한 염산과 산화제 공정인자 영향성 도출
3.3. 염산과 과산화수소를 이용한 금 침출
3.4. 염산과 차아염소산나트륨을 이용한 금 침출
4. 결 론
1. 서 론
최근 과학기술의 발달로 전기전자 제품 생산 수요가 급증하면서, 거의 모든 전기전자 제품의 필수 부품인 인쇄 회로 기판(PCB)의 사용이 확대되고 있다1). 폐전자제품에는 약 10~1600 ppm의 금이 포함되어 있으며, 2030년에는 전체 전자 폐기물 7,400만 톤 중 약 250만 톤으로 3.17 ppm의 금이 함유될 것으로 예측된다2,3). 금 가격 상승으로 전자제품 내 금 사용량은 감소하고 있으나, 폐전자제품의 발생량은 지속적으로 증가하는 추세를 보인다. 실제로 2009년 연간 2,500만 톤 미만이었던 폐전자제품 발생량은 2019년 약 5,360만 톤으로 증가하였으며4), 향후에도 지속적인 증가가 예상된다. 개별 폐전자제품의 금 함유량은 감소하고 있으나, 폐전자제품 발생량의 증가는 전체 금 함유량의 점차적으로 증가할 것으로 예상된다.
금은 낮은 산화전위를 가지며 산화제 없이 침출이 어려워 금 침출 시 주로 시안화물 또는 왕수를 침출제로 사용한다5). 시안화물은 수백 년 전부터 경제성으로 인해 활용되었으나6,7), 침출 속도가 느리고 치명적인 독성을 가진다는 한계가 있다8,9). 왕수는 비교적 짧은 시간 내 금을 100% 침출할 수 있으며, 물리화학적으로 금과 결합한 금속의 회수에 널리 사용된다6,5). 그러나 왕수는 높은 부식성과 화학적 불안정성으로 인해 소규모 공정에서만 제한적으로 사용되고 있다6). 또한, 왕수와 금의 반응 시 발생하는 NO(일산화질소)는 강한 독성을 가지며, 인체에 유해할 뿐 아니라 왕수의 부식성으로 인해 특수 기기의 사용이 필요하다1). 이에 따라 염산, 황산, 티오우레아 등 대체 침출제에 대한 연구가 오랜 기간 진행되어 왔다. 염산을 이용한 금 침출 공정에서는 산화제로 과산화수소와 차아염소산나트륨을 사용한다. 과산화수소는 산성 용액에서 강력한 산화제로 작용하며, 분해 시 산소와 물을 생성하여 환경친화적인 산화제로 평가된다10,11,12). 차아염소산은 시안화물에 비해 빠른 침출 속도와 낮은 환경 독성을 보이며13), 수소 이온과 반응 시 금 침출 효율이 증가한다14). 다만, 차아염소산은 금보다 황철석 및 맥석광물에 우선 반응하여 금 침출률이 저하되므로 황 함량이 적은 폐전자 부품에 적합하다13,15,16). 금 침출 공정에서 왕수를 대체하는 다양한 선행 연구가 보고된 바 있으며, 저품위 광석, 폐기된 컴퓨터 CPU 칩, 휴대폰 PCB, 양극 슬라임 등 금 함유 자원에서 90~100 %의 높은 금 침출률을 나타내었다. 그러나, 이때 침출액 내 금 농도는 0.01~0.6 g/L 수준으로, 효율성 있는 현장 적용을 위해 요구되는 금농도 15 g/L 이상에 미치지 못하였다. 따라서, 유해물질 사용을 줄이고 작업 환경을 개선하며, 효율적이고 안정적인 금 회수 공정의 현장 적용을 위해서는 높은 금 농도를 확보할 수 있는 공정 최적화가 필요하다.
본 연구에서는 폐전자제품 내 금 침출 공정에서 왕수 사용을 대체하고자, 질산 대신 산화제를 이용하는 공정을 개발하였으며, 산화제로는 과산화수소와 차아염소산나트륨을 사용하였다. 선행 연구보다 약 30배 높은 고액비를 적용하여 산업 현장에서의 적용성을 높일 수 있는 고농도 금 침출 가능성을 평가하였고, 염산과 산화제의 조합을 통해 전자 부품 폐자원 내 금 침출 공정 최적화를 수행하였다.
2. 실험방법
금이 함유된 폐반도체 부품에서 금을 침출하기 위해 염산에 산화제를 첨가하여 실험을 수행하였다. 25 g의 폐반도체 부품을 염산, 염화나트륨 및 산화제가 혼합된 30 ml 용액에 투입한 후, 온도와 용액 교반을 조절하여 2시간 동안 침출 실험을 진행하였다. 염산의 농도, 산화제의 첨가량, 반응 온도를 공정인자로 설정하여 각 인자가 금 침출에 미치는 영향을 Taguchi 법을 통해 평가하였으며, 공정인자들의 범위는 Tables 1과 2에 나타내었다. Taguchi 실험 결과를 바탕으로 염산 농도, 산화제 및 염화나트륨의 첨가량을 조절하여 세부 실험을 수행하였다. 염산과 과산화수소 조건에서는 5~8 M 염산 농도, 0.581~1.744 M 과산화수소 첨가량 및 0~0.5 M 염화나트륨 첨가량 범위에서 실험을 진행하였다. 또한 염산과 차아염소산나트륨 조건에서는 4~7 M 염산 농도, 0.162~1.134 M 차아염소산나트륨 첨가량 및 0, 0.5 M 염화나트륨 첨가량 범위에서 실험을 수행하였다. 용액 내 금 농도는 ICP-OES(Inductively Coupled Plasma Optical Emission Spectrometer)를 사용하여 20분 간격으로 분석한 후 금 침출률을 계산하였다.
Table 1.
Taguchi design for hydrochloric acid, hydrogen peroxide and temperature, and gold leaching results
Table 2.
Taguchi design for hydrochloric acid, sodium hypochlorite and temperature, and gold leaching results
3. 실험 결과 및 고찰
3.1. 폐원자재 시료 분석
실험 시료로 사용한 폐반도체 부품에 대해 성분 분석을 수행하였으며, 시료를 왕수로 용해한 후 ICP-OES로 분석하였다. 폐반도체 부품에는 2.317 wt.%의 금, 0.332 wt.%의 구리, 0.09 wt.%의 니켈, 2.078 wt.%의 철이 함유되어 있었다.
3.2. Taguchi 방법을 이용한 염산과 산화제 공정인자 영향성 도출
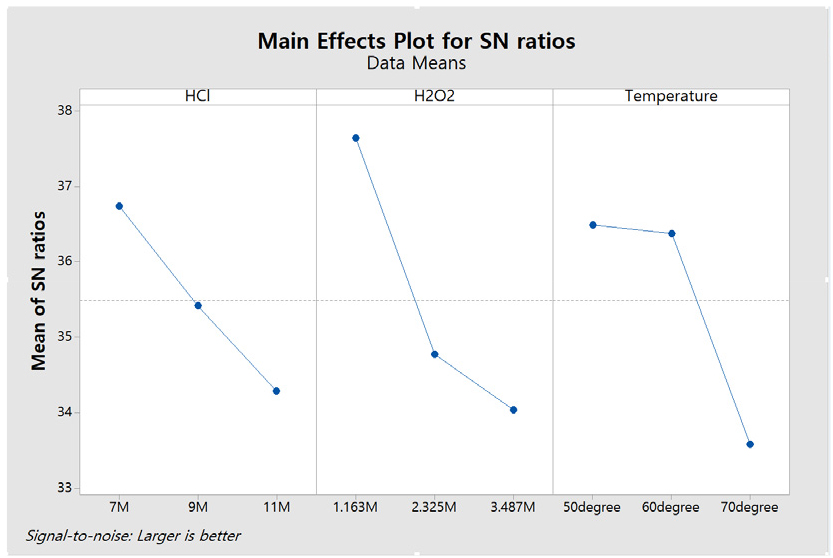
Taguchi 방법은 전체 실험 횟수를 최소화하여 시간 및 비용 효율성 측면에서 상업적으로 유리한 장점을 제공한다17,18). Taguchi 법의 직교 배열(OA)은 균형 잡힌 최소한의 실험 설계를 가능하게 하며, S/N(Signal/Noise) 비율은 최적화 목표 함수로서 데이터 분석과 최적화 결과 예측에 도움을 준다19). 따라서 Taguchi 방법을 통해 염산, 과산화수소, 온도에 대한 공정인자가 금 침출에 미치는 영향을 평가하였다. Table 1은 염산과 과산화수소의 농도 및 온도에 대한 침출공정 인자들을 직교 배열로 정리하고, Taguchi 방법에 따른 실험결과로 도출된 금 침출률을 나타내었으며, Fig. 1은 이러한 조건에서 염산 농도, 과산화수소 첨가량, 온도가 금 침출에 미치는 영향을 S/N 비로 평가한 결과를 나타내었다. 염산 농도, 과산화수소 첨가량, 온도가 증가할수록 금 침출률이 감소하는 경향을 보였으며, 특히 과산화수소의 기울기가 급격하게 감소하는 경향을 보였다. 이 결과에서는 과산화수소 첨가가 금 침출에 가장 큰 영향을 미치고, 그 다음으로 염산 농도와 온도 순서로 영향을 미치는 것을 확인하였다.
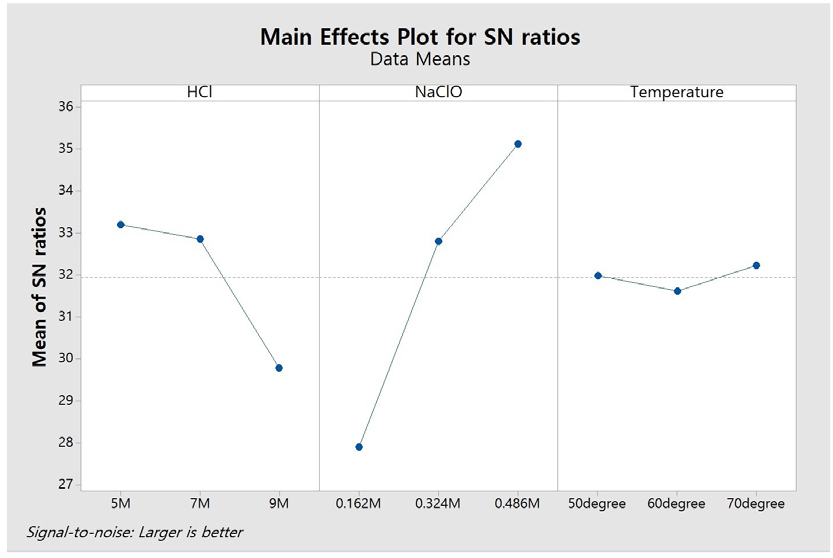
Table 2는 염산, 차아염소산나트륨 및 온도에 대한 공정 인자들의 직교 배열표이고, 금 침출 후 침출률을 나타낸 결과이며, S/N 비율로 평가한 결과를 Fig. 2에 나타내었다. 이 결과에서, 염산 농도가 증가할수록 금 침출률이 감소하는 반면, 차아염소산나트륨 첨가량이 증가할수록 금 침출률이 증가함을 확인하였다. 온도는 금 침출에 유의한 영향을 미치지 않는 것으로 나타났다. 차아염소산나트륨의 기울기가 급격하게 증가하는 경향을 보이는 것으로 보아, 차아염소산나트륨이 금 침출에 가장 큰 영향을 미치고, 그 다음으로 염산 농도가 영향을 미치는 것을 확인하였다.
3.3. 염산과 과산화수소를 이용한 금 침출
3.3.1. 염산의 농도
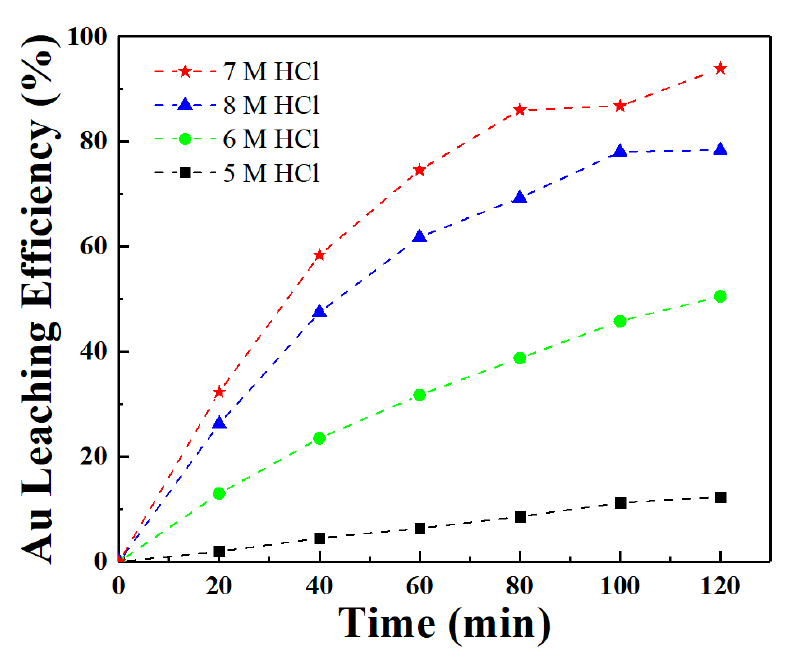
염산 농도가 금 침출에 미치는 영향을 평가하기 위해, 1.163 M 과산화수소, 0.5 M 염화나트륨, 50 ℃ 온도 조건에서 염산 농도를 5 M, 6 M, 7 M 및 8 M으로 증가시켜 실험을 수행하였다. 그 결과, Fig. 3과 같이 금 침출률은 각각 12.30 %, 50.36 %, 93.92 % 및 78.38 %로 나타났으며, 염산 농도가 증가함에 따라 금 침출률이 증가하다가 8 M 염산 농도 조건에서 감소하였다. 식 (1)과 (2)는 염산과 과산화수소가 금과 반응하는 반응식을 나타내며, 염산 농도가 증가함에 따라 Cl⁻ 이온이 증가하고, 이로 인해 HClO의 생성량이 늘어나 금 침출률이 향상된 것으로 보인다. 그러나 8 M 염산 농도에서는 금 침출률이 감소하는 현상이 관찰되었다. M. Dimitrijević et al.(1999)의 연구에 따르면, 염산이 과다할 경우 염소 이온이 금속 표면에 흡착하여 과산화수소와 금속 간 반응을 방해하고, 이로 인해 침출률이 감소한다고 보고된 바 있다20). 본 실험에서도 이러한 메커니즘에 따라 금 침출률이 감소한 것으로 판단되며, 염산 농도의 적절한 제어가 필요하다.
3.3.2. 과산화수소의 농도
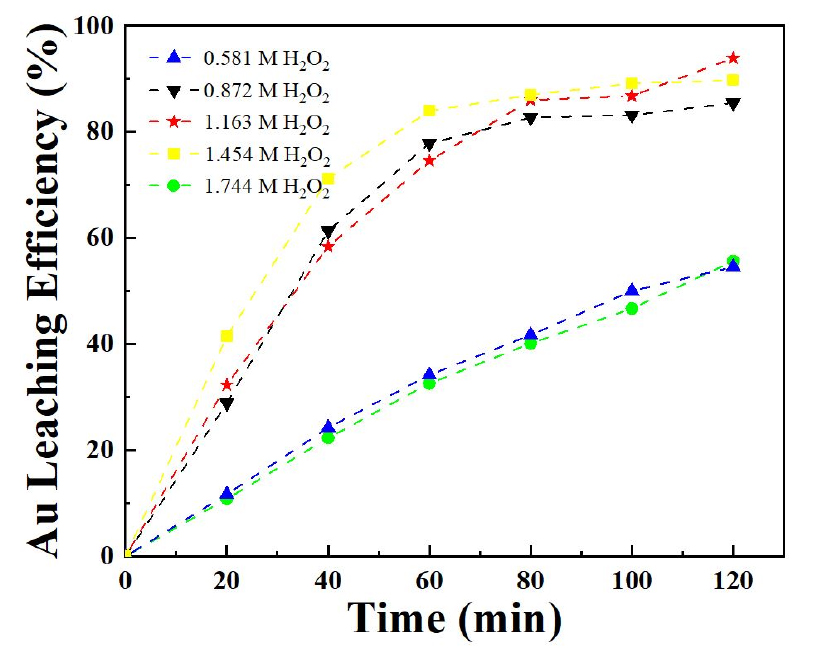
과산화수소 첨가량이 금 침출에 미치는 영향을 평가하기 위해, 7 M 염산, 0.5 M 염화나트륨, 50 ℃ 온도 조건에서 과산화수소 첨가량를 0.581 M, 0.872 M, 1.163 M, 1.454 M 및 1.744 M으로 증가시키며 실험을 수행한 결과를 Fig. 4에 나타내었다. 금 침출률은 각각 55.67 %, 85.49 %, 93.92 %, 89.71 % 및 54.55 %으로, 금 침출률이 증가하다가 감소하는 경향을 보였다. 이 결과는 식 (1)과 (2)에서와 같이 과산화수소 첨가량이 증가함에 따라 차아염소산 발생량이 늘어나 금 침출률이 증가할 것으로 판단된다. 반면, 1.454 M 과 1.744 M 과산화수소 첨가량에서는 금 침출률은 점차 감소하는 경향을 보였다. Pratik K. Sen(1996)의 연구에 따르면, 염산과 과산화수소 반응에서 과산화수소가 과량 첨가될 경우 부반응이 활성화되어 과산화수소가 분해되면서 O2(gas)로 소모가 되어 금 침출률이 감소한다고 보고하였다21). 따라서, 과산화수소의 첨가량의 적절한 제어가 필요하며, 본 실험에서는 1.163 M 과산화수소를 첨가할 때 금 침출률이 가장 높게 나타남을 확인하였다.
3.3.3. 염화나트륨의 첨가량
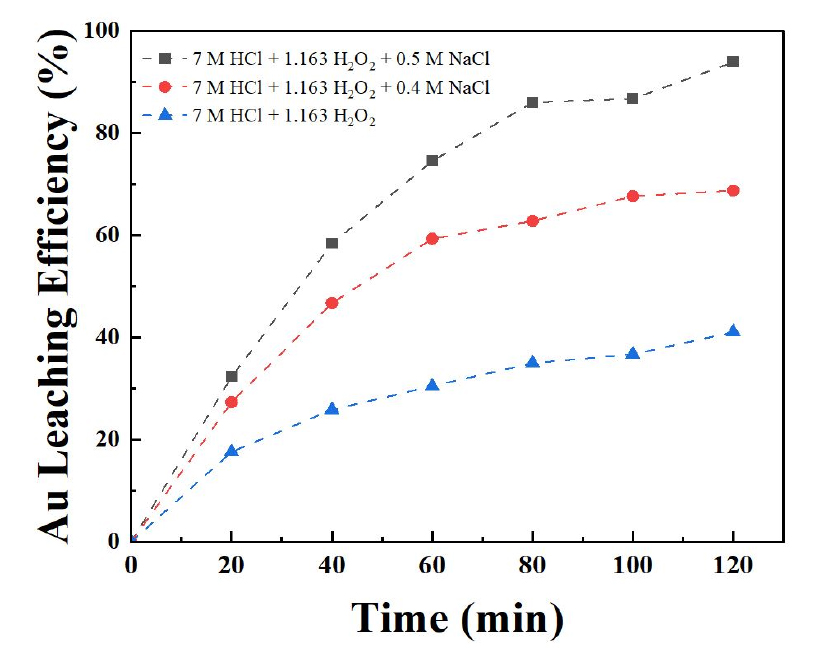
염화나트륨 첨가량이 금 침출에 미치는 영향을 평가하기 위해, 7 M 염산, 1.163 M 과산화수소, 50 ℃ 온도 조건에서 염화나트륨 첨가량를 0 M, 0.4 M 및 0.5 M으로 증가시키며 실험을 수행한 결과를 Fig. 5에 나타내었다. 금 침출률은 각각 41.05 %, 68.80 % 및 93.92 %으로 금 침출률이 크게 증가하는 경향을 보였다. 식 (3)에서와 같이 강산 조건에서 염화나트륨은 과산화수소와 반응함으로써 염소가 발생하며, 식 (4)에서와 같이 물과 반응하여 차아염소산을 생성하게 되어, 이후 식 (2)에 따라 금과 반응하여 금 침출률을 크게 향상시킨다. 염화나트륨을 첨가하여 염화 이온을 공급할 때, 염산 첨가로 인한 과량의 수소 이온이 생성되지 않으면서 염화 이온을 효과적으로 제공하여 금 침출률을 크게 향상시키는 역할을 하는 것으로 확인하였다.
염산과 과산화수소 사용 시 최적 조건은 7 M 염산, 1.163 M 과산화수소, 0.5 M 염화나트륨, 50 ℃으로 도출하였으며, 2시간 실험을 진행했을 때 금 침출률은 93.92 %이었고, 18.135 g/L의 고농도의 금 침출액을 확보하였다. 최적 공정조건에서 장시간(3시간) 이상 실험 시 약 98.34 %의 높은 금 침출률을 확보할 수 있었다.
3.4. 염산과 차아염소산나트륨을 이용한 금 침출
3.4.1. 염산의 농도
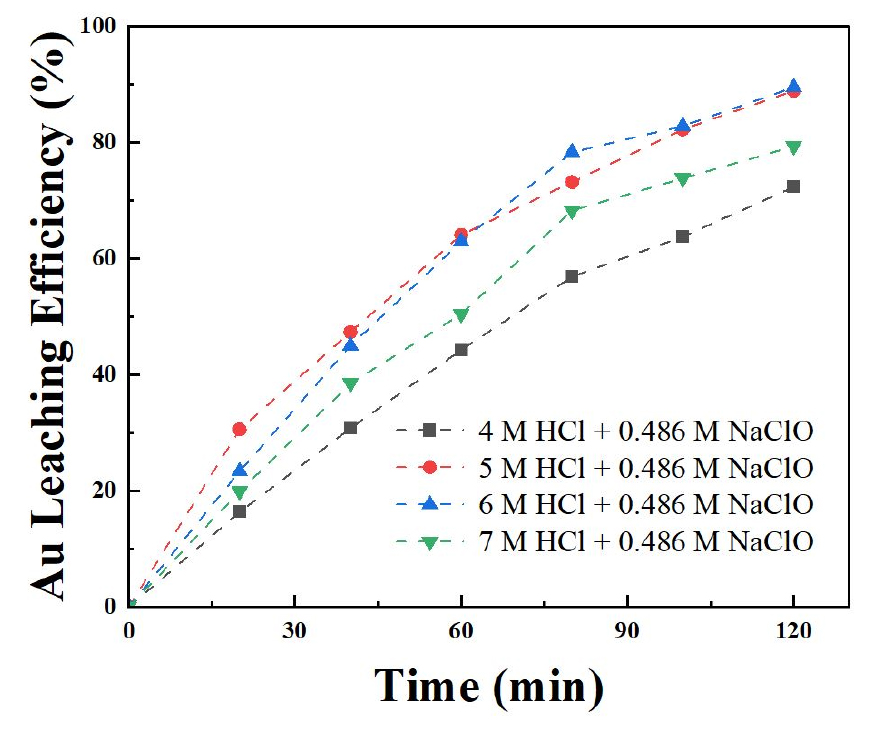
염산과 차아염소산나트륨을 사용하여 금 침출 시 염산 농도가 미치는 영향을 평가하기 위해 실험을 진행하였다. 염산의 농도는 4 M, 5 M, 6 M 및 7 M로 했으며, 다른 변수들은 0.486 M 차아염소산나트륨, 온도 50 ℃로 고정하였다. 그 결과 Fig. 6과 같이 염산의 농도가 4 M, 5 M, 6 M 및 7 M일 때 각각의 금 침출률이 72.37 %, 88.95 %, 88.53 %, 76.38 %으로 금 침출률이 증가하다가 감소하였다. 이는 식 (5)와 (6) 같은 반응이 일어나 염산의 농도가 증가할수록 금 침출률이 증가하였지만, 6 M 염산일 때는 이는 M. Dimitrijević et al.(1999)에 의하여 염화물이 금에 흡착하여 침출되는 것을 방해하기 때문에 금 침출률이 감소하며 염산의 농도를 제어할 필요가 있으며, 실험을 통해서 5 M 염산일 금 침출률이 높다는 것을 확인하였다20).
3.4.2. 차아염소산나트륨의 농도
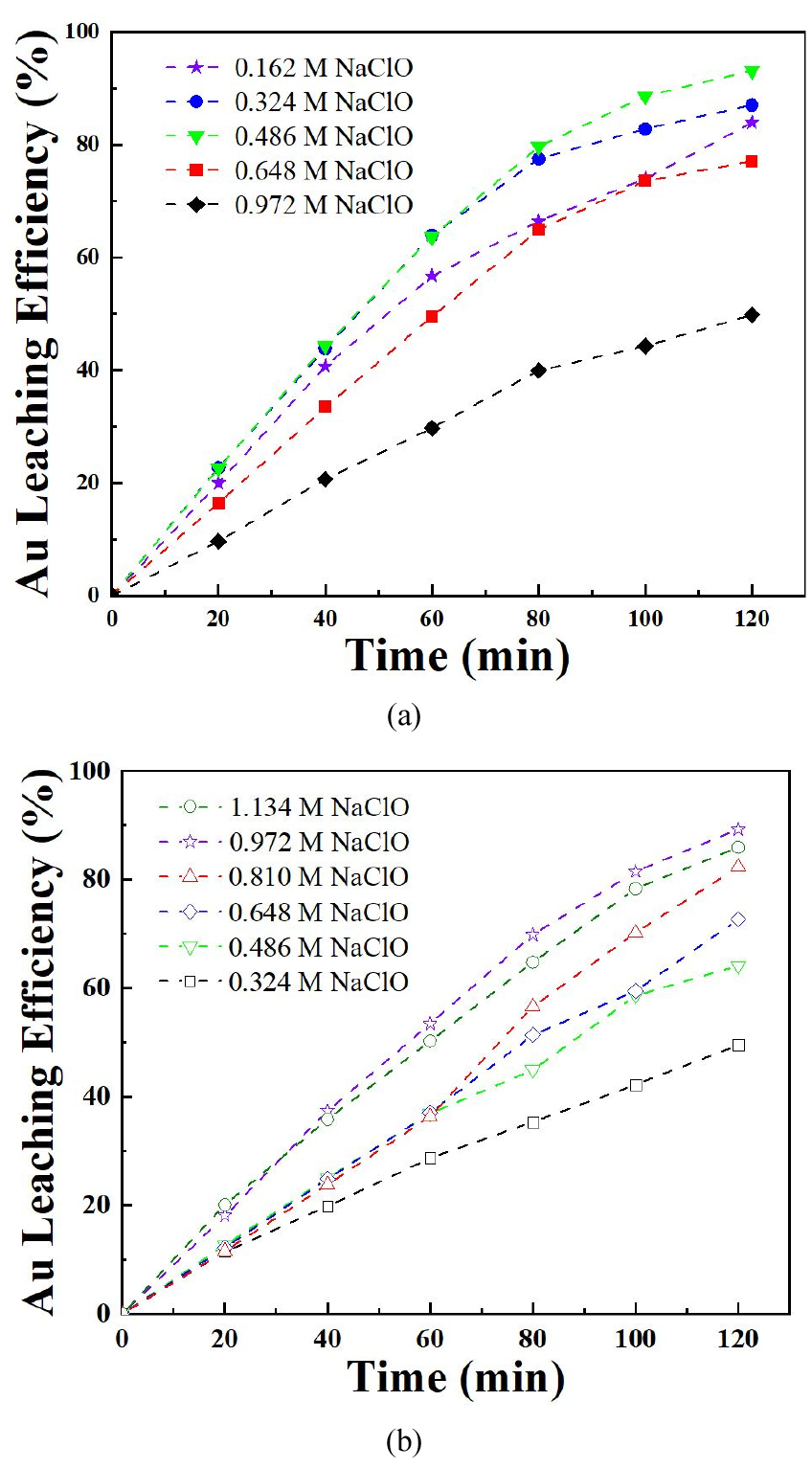
염산과 차아염소산나트륨의 조건에서 차아염소산나트륨이 금 침출에 미치는 영향을 평가하기 위해 실험을 진행하였다. 차아염소산나트륨의 첨가량은 0.162 M, 0.324 M, 0.486 M, 0.648 M, 0.972M로 설정하고, 5 M 염산, 온도 50 ℃ 조건으로 고정하여 진행하였다. 그 결과는 Fig. 7(a)에 나타난 바와 같이 차아염소산나트륨의 농도가 0.162 M, 0.324 M, 0.486 M, 0.648 M 및 0.972M일 때 금 침출률은 각각 49.86 %, 77.13 %, 93.21 %, 87.09 % 및 83.51 %로, 금 침출률이 증가하다가 다시 감소하는 경향을 보였다. 이는 식 (6)에서와 같은 반응에 의해 금 침출률이 증가하지만, 차아염소산나트륨 농도가 0.648 M 이상일 때 염산과 반응하여 염화나트륨이 생성되고, 이로 인해 금과 반응할 수 있는 차아염소산나트륨의 양이 줄어들어 금 침출률이 감소하는 것으로 해석된다. 따라서 차아염소산나트륨의 적절한 첨가량을 제어하는 것이 필요하며, 실험 결과 0.486 M에서 가장 높은 침출률을 확인할 수 있었다. 염산과 차아염소산나트륨 조합에서 금 침출 시 염화나트륨의 영향을 평가하기 위해 0.5 M 염화나트륨을 첨가한 실험을 진행하고, 그 결과를 Fig. 7(b)에 나타내어 염화나트륨을 첨가하지 않은 경우와 비교하였다. 0.5 M 염화나트륨을 첨가하였을 때는 차아염소산나트륨의 첨가량이 0.324 M, 0.486 M, 0.648 M, 0.810 M, 0.972 M 및 1.134 M일 때 금 침출률은 각각 49.51 %, 64.14 %, 72.69 %, 82.33 %, 89.30 % 및 85.92 %를 나타내었다. 0.5 M 염화나트륨을 첨가하지 않은 경우, 첨가한 경우보다 낮은 차아염소산나트륨 농도에서도 더 높은 침출률이 나타났다. 이는 차아염소산나트륨이 금과 반응하기에 충분히 Cl- 이온이 포함되어 있어, 염화나트륨이 추가하면 Cl- 이온이 과잉 상태가 되어 오히려 금 침출률을 감소시키기 때문이다. 따라서, 염화나트륨을 첨가하지 않는 것이 금 침출률을 높이는 방법임을 확인하였다.
염산과 차아염소산나트륨 사용 시 5 M 염산, 0.486 M 차아염소산나트륨, 50 ℃가 최적 조건인 것으로 도출하였으며, 2시간 실험을 진행했을 때 금 침출률은 93.21 %이었고, 17.998 g/L의 고농도의 금 침출액을 확보하였다. 최적 공정조건에서 장시간(3시간) 이상 실험 시 약 96.47 %의 높은 금 침출률을 확보할 수 있었다.
4. 결 론
금이 함유되어 있는 폐전기전자제품에서 금을 침출시키는 방법으로 염산과 산화제를 사용했으며 Taguchi 방법을 통해서 공정인자가 금 침출에 미치는 영향을 평가하였다. 최적 조건을 위해 염산의 농도, 산화제의 첨가량, 염화나트륨의 첨가량의 조건으로 실험을 수행하였으며, 실험 결과 아래와 같다.
1. Taguch 방법을 통해서 염산과 산화제(과산화수소, 차아염소산나트륨)에서 산화제의 첨가량, 염산의 농도, 온도의 순으로 금 침출에 영향일 미친다는 것을 확인하였다.
2. 염산과 과산화수소의 조건에서 7 M 염산, 1.163 M 과산화수소, 0.5 M 염화나트륨, 50 ℃가 최적 조건이며, 2시간 실험을 진행했을 때 93.92 %의 금 침출률과 18.135 g/L의 고농도 금 침출액을 얻었다.
3. 염산과 차아염소산나트륨의 조건에서 5 M 염산, 0.486 M 차아염소산나트륨, 50 ℃가 최적 조건이며, 2시간 실험을 진행했을 때 93.21 %의 금 침출률과 17.998 g/L의 고농도 금 침출액을 얻었다.