1. 서 론
이산화탄소를 이용해서 건축물을 경화시키는 기술은 고대 로마시대부터 시작되었으나, 19세기 초에 1종 포틀랜드시멘트가 개발되면서 수경성시멘트가 건축물 생산의 새로운 기준이 되었다. 하지만 최근 시멘트산업에서의 탄소중립이 요구되면서 이산화탄소를 감축시킬 수 있는 혁신적 기술로 인식되어 탄산화, 이산화탄소 분리 및 이산화탄소 반응 활성화 관점에서 다양한 연구가 진행되고 있다1). 칼슘실리케이트 시멘트(calcium silicate cement, CSC)는 이산화탄소를 흡수하여 경화하는 기경성 시멘트로써, 1종 포틀랜드 시멘트 대비 70% 이상의 이산화탄소를 감축할 수 있는 친환경 저탄소 시멘트이다. CSC의 주요광물상은 wollastonite(CaSiO3, CS)와 rankinite (Ca3Si2O7, C3S2)로써, 이산화탄소 반응경화 과정에서 CaCO3와 SiO2광물형성을 통해 강도가 증진되며 최대 70MPa의 압축강도 발현이 가능하여 친환경 건설재료로의 활용이 가능한 것으로 알려져 있다2). 이러한 특성에 주목하여 미국 Solidia사에서는 2015년부터 CSC에 대한 클링커 합성, 환경적 영향평가, 물성발현 메카니즘 및 내구성 평가 등에 대한 실험을 시작하여 현재는 유럽 및 중국 등에서 대량생산 실증실험을 진행하는 등 활발한 연구가 진행되고 있다3). 국내에서도 2024년도에 연간 1,000톤 규모 파일롯 규모 제조 및 응용실험을 목표로 연구를 진행 중에 있다.
CSC는 이산화탄소 반응에 의하여 경화되는 기경성 물질로써 초기반응 활성화를 위해서는 반응표면적을 증가시키는 것이 중요하며, 이를 위해서 경화체 내부에 남아있는 수분을 제거하는 사전경화 과정을 거치게 된다. 하지만 사전경화 과정을 거치기 위해서는 제품 경화가 진행되지 않은 상태에서 제품 탈형 뿐 아니라 정밀한 경화분위기 제어기술 및 이를 위한 장비가 요구되어 상용화 적용에 장애요인으로 인식되고 있다. CSC 확대적용 및 상용화를 위해서는 사전경화 과정을 거치지 않고 CSC의 초기강도를 증진할 수 있는 기술개발이 필요하지만 아직까지 이에 대한 연구는 보고되지 않고 있는 실정이다. 본 연구에서는 CSC에 속경성 시멘트를 혼합하여 초기강도를 증진함으로써, 사전경화 과정을 거치지 않고 건설재료를 제조할 수 있는 가능성을 살펴보고자 하였다. 이를 위해서 국내 원료물질인 석회석과 실리카흄을 사용하여 제조한 CSC에 속경성 시멘트인 칼슘설포알루미네이트 시멘트(calcium sulfoaluminate cement, CSA) 및 알루미나 시멘트(alumina cement, AC)를 혼합하여 압축강도와 광물특성 함량 변화를 살펴보았다.
2. 실험방법
2.1. 사용재료 및 배합비
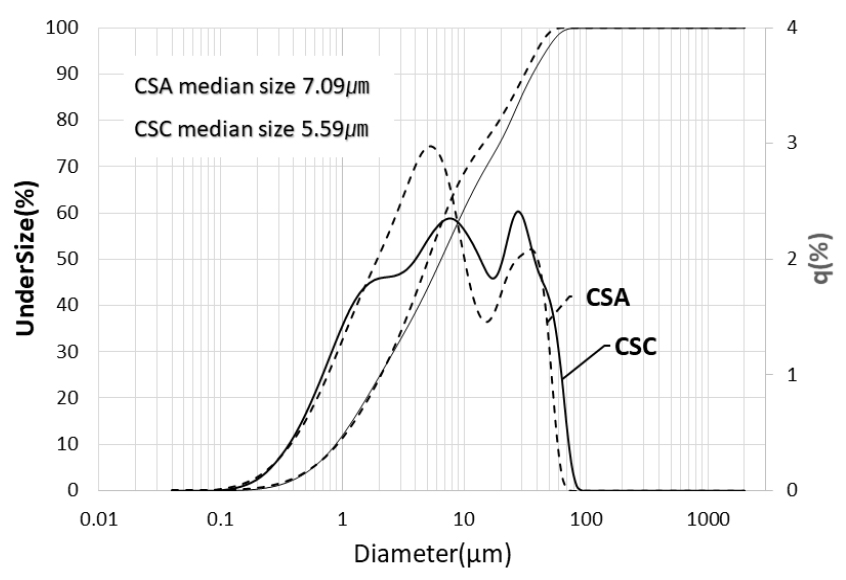
한국석회석신소재연구소에서 석회석과 실리카 흄을 원료로 사용하여 제조한 CSC를 원료로 사용하였다. 속경성 시멘트로써 중국 T사에서 수입한 CSA를 사용하였으며, 알루미나시멘트(alumina cement)는 국내 S사에서 공급한 제품을 사용하였다. 무수석고(anhydrate gypsum)는 H 시멘트 사에서 공급한 제품을 혼합하여 사용하였다. CSA 시멘트는 속경성 특성을 갖고 있을 뿐 아니라 slag나 fly ash와 같은 포졸란 물질의 활성화에 도움을 주는 것으로 알려져 있을 뿐 아니라 CSC의 주요성분인 wollastonite광물의 수화특성에 영향을 주는 것으로 알려져 있다. 알루미나시멘트와 석고는 CSA시멘트의 부피팽창과 응결특성 제어를 위하여 사용하였다. 사용원료에서 CSC와 CSA시멘트의 화학성분은 M4 TORNADO (Bruker, 독일) 장비를 이용하여 분석하였으며, Table 1에 분석결과를 나타내었다. LA-950 Laser Scattering Size Distribution Analyzer(Horiba LA950)를 이용하여 CSC 및 CSA 시멘트 입도분포를 분석하였으며, Fig. 1에 분석 결과를 나타내었다. Median size가 각 각 7.09μm 및 5.59μm로 CSA 입도가 CSC 입도보다 미세한 것을 알 수 있었다.
Table 1
Chemical composition of CSC and CSA cement (unit : wt%)
| Comp. | SiO2 | Al2O3 | CaO | MgO | Fe2O3 | K2O | TiO2 | SO3 | P2O5 | LOI |
| CSC | 51.4 | 0.27 | 45.2 | 0.56 | 0.09 | 0.56 | 1.24 | 0.39 | 0.09 | 1.1 |
| CSA | 9.47 | 27.6 | 48.1 | 2.98 | 2.95 | 0.87 | 0.01 | 8.31 | 0.09 | 2.2 |
CSC 와 CSA 혼합 시멘트의 반응특성 평가를 위하여 CSC 배합비율을 25%, 50%, 75% 및 100%로 변경하였으며, W/C는 40%로 고정하였다. CSC 와 CSA 혼합시멘트의 유동성을 일정하게 유지하기 위하여 감수제, 증점제 등의 혼화제를 첨가하였으며, 세부 배합비율을 Table 2에 나타내었다.
Table 2
Mix proportions of CSC and CSA mixed cement paste (unit : g)
| Specimen | Weight | Ad | w | |||
| CSC | CSA | CAC | AG | |||
| CSC 100 | 3,000 | 0 | 0 | 0 | 8.40 | 1,200 |
| CSC 75 | 2,250 | 281.25 | 281.25 | 187.50 | 17.40 | |
| CSC 50 | 1,500 | 562.50 | 562.50 | 375.00 | 26.40 | |
| CSC 25 | 750 | 843.75 | 843.75 | 562.50 | 35.40 | |
2.2. 실험방법
시멘트 혼합은 KS L 5109 “수경성 시멘트 페이스트 및 모르타르의 기계적 혼합방법”에 의한 용량 4.73ℓ의 몰탈 전용믹서를 사용하였으며, 시편제조는 KS L 5220 “건조시멘트 모르타르”에 준하여 CSC 혼합시멘트 페이스트를 준비하였다. 압축강도 측정용 시편은 KS L ISO “시멘트 강도 시험방법”에 준하여 40×40×160mm 몰드에 제작한 후 20±2℃, 습도 60%, 이산화탄소 분위기에서 양생을 실시하였으며, 압축강도 측정 속도는 2400N/s ± 200N/s로 하여 재령(1, 3, 7일)에 따른 강도변화를 측정하였다. CSC 와 CSA 혼합 시멘트 페이스트의 반응기간별 광물특성 변화를 파악하기 위한 시료는 100×100×5mm 플라스틱 시료용기에 3m 두께의 페이스트를 담아 이산화탄소 반응기에 투입하였다. 일정기간(4h, 1일, 3일, 7일) 양생 후에 페이스트 시료를 꺼냈으며, 메탄올에 투입 후 알루미나 유발에서 미세하게 분쇄후 건조하여 페이스트 수화물의 반응을 제어하였다. 시료의 광물특성 변화는 X-회절분석기(BRUKER사 D8 Advance)를 이용하였으며, 광물정량은 XRD-Rietveld 법을 사용하여 구하였다.
3. 실험결과 및 고찰
3.1. 광물특성
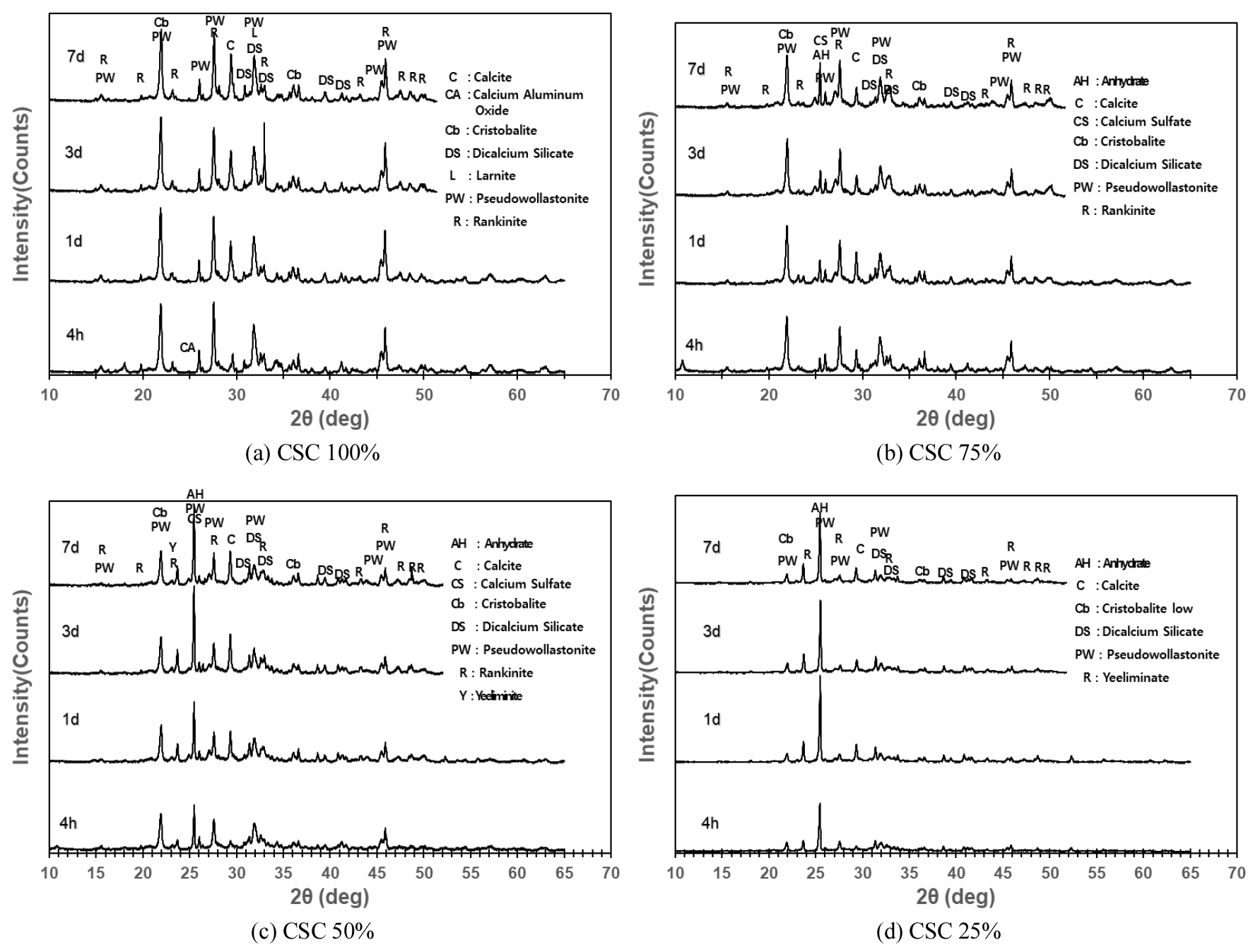
이산화탄소 분위기에서 경화기간(4h, 1일, 3일, 7일)에 따른 CSC 혼합 시멘트 페이스트의 광물특성 및 함량변화를 살펴보고자 하였다. Fig. 2(a)에 CSA 속경시멘트를 혼합하지 않은 CSC 100 시료의 XRD 분석결과를 나타내었다. 주요 구성광물이 pseudowollastonite, cristobalite(SiO2) 및 rankinite광물로 구성되어 있으며 경화시간에 따른 광물특성 peak 변화가 거의 없음을 관찰할 수 있었다. XRD-Rietveld 법을 사용한 광물함량 분석결과, pseudowollastonite광물은 60.3~55.4%, cristobalite광물은 11.5~12.2%, rankinite광물은 10.9~12.1%로 광물함량 변화가 거의 없음을 확인하였다. 이 결과는 경화기간(4h, 1일, 3일, 7일)동안에 cristobalite광물과 rankinite광물의 이산화탄소에 의한 경화반응이 진행되지 않았음을 의미한다. CSC의 주요광물인 rankinite 및 pseudowollastonite광물은 주변에 존재하는 H2O에 CO2가 용해되어 H2CO3가 생성되고 H2CO3는 이온화가 되어 최종적으로 SiO2(gel)과 CaCO3를 생성하여 강도를 발현하는 것으로 알려져 있다4,5). 일반적으로 CSC의 이산화탄소에 의한 경화반응은 이산화탄소와 반응물과의 확산반응이 중요하며, 이산화탄소 확산반응을 활성화하기 위해 사전경화가 필요하다고 보고하고 있다6,7,8). 이러한 기존 연구결과와 비교해볼 때, 이산화탄소 경화반응이 거의 진행되지 않은 본 실험결과는 경화물에 수분이 과량 존재하여 이산화탄소 확산반응이 저해되었기 때문이라 판단되었다. CSC 4h 수화물에 calcium aluminum oxide(Ca2(Al2O5)광물이 관찰되는데 이것은 원료로 사용한 석회석에 존재하는 알루미나 성분에 의해서 생성된 것으로 예상된다. 4h 반응이후에 calcium aluminum oxide(Ca2(Al2O5)와 larnite(Ca2(SiO4))광물이 관찰되지 않았다. 이결과는 탄산화 반응에 의해 4h 이후 증가한 calcite 광물함량 증가와 밀접한 관련이 있을 것으로 판단되었으며, Melaku N. Seifu et al.(2023)에9) 의한 CSC의 탄산화 모델링 결과로써 calcite와 비정질 aluminosilicate 광물이 생긴다는 결과와 일치하였다. 이 실험결과는 하기 3.2절의 CSC 100 시료의 경화시간에 따른 강도발현 실험에서 강도발현의 전혀 없어 측정불능 상태로 유지된 실험결과와 일치함을 알 수 있다.
CSC 100 시료에 CSA 속경시멘트를 0%, 25%, 50% 및 75% 혼합하여 제조한 CSC 혼합 시멘트 페이스트를 이산화탄소 분위기에서 경화시간별로 경화한 XRD 분석결과를 Fig. 2(a~d)나타내었으며, XRD-Rietveld 법을 사용한 광물함량 분석결과를 Tables 3, 4, 5, 6에 나타내었다. CSC의 함량이 100%에서 75%, 50% 및 25%로 감소할수록 주광물인 pseudowollastonite 광물함량이 감소하는 것을 확인할 수 있었다. 하지만 CSC 함량 100%, 75% 조건에서 반응기간에 따른 pseudowollastonite 광물 량 변화는 각, 각 55.4%~60.3% 및 51.2%~52.7%로 함량변화가 거의 없는 반면에, CSC 함량 50%, 25%조건에서 반응기간에 따른 광물 량 변화는 각, 각 28.8%~38.8% 및 14.4%~24.5%로 상대적으로 많은 량의 pseudowollastonite 광물양이 감소하는 것을 알 수 있다. CSC의 주요광물인 wollastonite 및 rankinite 광물의 탄산화 생성물과 영향인자에 대한 많은 연구가 진행되었으며, 비표면적이 매우 중요한 탄산화 인자임을 보고하였다10,11,12). 본 실험결과에서 CSC 50% 및 25%조건에서 pseudowollastonite 및 rankinite 광물 함량이 감소함에 따라서 탄산화 생성물인 calcite함량이 증가하였으며, 이 결과는 CSC 50% 및 25%조건(CSA 속경성 시멘트 50% 및 75%)에서 비표면적 증가와 같이 wollastonite의 탄산화 반응에 유리한 환경이 조성된 것을 뒷받침하는 것이다. CSC 함량이 75%에서 50% 및 25%로 감소하고 반응경화시간이 증가할수록 anhydrite(CaSO4)함량이 증가함을 알 수 있는데, 이것은 CSA 속경성 시멘트 원료로 사용한 anhydrate gypsum(CaSO4)에 기인한 것이다. CSC 25% 조건에서 yeeliminate(Ca4Al6O12(SO4)광물생성을 확인하였다. Yeeliminate광물은 CSA 시멘트의 수화과정에서 생성되는 것으로 알려져 있으며13), 본 실험에 사용한 CSA시멘트 사용에 따른 수화생성물로써 yeeliminate광물이 생성되었음을 확인할 수 있었다.
Table 3
Rietveld analysis of CSC 100 paste according to curing time (4h, 1d, 3d, 7d) (unit : wt%)
Table 4
Rietveld analysis of CSC 75 paste according to curing time (4h, 1d, 3d, 7d) (unit : wt%)
Table 5
Rietveld analysis of CSC 50 paste according to curing time (4h, 1d, 3d, 7d) (unit : wt%)
Table 6
Rietveld analysis of CSC 25 paste according to curing time(4h, 1d, 3d, 7d) (unit : wt%)
3.2. 압축강도
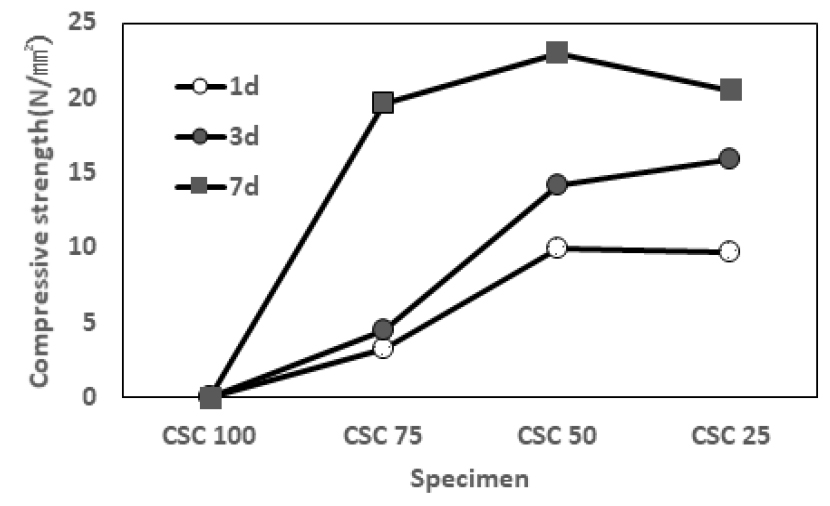
Table 5와 Fig. 3에 CSC 배합조건에 따른 경화기간별 압축강도를 나타내었다. CSC 확대적용을 위해서는 별도의 사전경화과정을 거치지 않고 초기강도를 증진하는 기술이 중요하다. CSC 100% 일 때, 이산화탄소 반응기간 1일, 3일 및 7일에서 강도발현이 전혀 없어 압축강도 측정이 불가능하였다. 이결과는 Table 3의 광물분석 결과에서, CSC의 주광물인 pseudowollastonite 및 rankinite 광물함량이 반응기간(1일, 3일 및 7일)동안 변화가 거의 없어 이산화탄소에 의한 경화반응이 진행되지 않은 결과와 일치한다. CSC 75 조건에서 3일과 7일 압축강도가 각 각 4.48N/mm2과 19.55N/mm2으로 1종 시멘트의 KS규격인 12.5N/mm2과 22.5N/mm2에 미치지 못하지만 강도발현 상승폭이 큼을 확인하였다. CSC 50 조건에서 3일과 7일 압축강도가 각 각 14.18N/mm2과 22.98N/mm2으로 1종 시멘트의 KS규격인 12.5N/mm2과 22.5N/mm2을 만족하는 강도발현을 확인하였다. CSC 50 시멘트의 광물변화를 살펴보면, pseudowollastonite 및 rankinite 광물함량이 반응기간(1일, 3일 및 7일)동안 각 각 38.8%에서 29.6%, 18.6%에서 12.3% 감소하였으며, 이산화탄소 반응경화 생성물인 CaCO3 광물량이 1.8%에서 9.8%까지 증가하였으며, 이것은 이산화탄소 경화반응이 진행되었다는 것을 의미한다. CSC의 경화반응은 이산화탄소와 반응물과의 확산반응이 중요하다고 알려진 기존 연구결과1,6,7,8)와 본 실험결과를 비교해볼 때, CSA시멘트 첨가에 따른 수화반응 진행 및 미세기공 생성과 아울러 이산화탄소가 기공을 통해서 CSC와 반응한 것으로 판단되었다.
4. 결 론
이산화탄소 분위기에서 CSC와 CSA 시멘트 혼합비율에 따른 경화기간별 광물특성과 압축강도 특성을 측정한 결과는 다음과 같다.
1) CSC 100% 조건에서 경화기간(4h, 1일, 3일, 7일)에 따른 pseudowollastonite 및 rankinite 광물함량은 변화가 거의 없어 이산화탄소에 의한 경화반응이 진행되지 않았음을 알 수 있었다. 이결과는 경화시간에 따른 압축강도 실험에서 강도발현이 전혀 없었던 실험결과와 일치한다.
2) CSC에 CSA 시멘트를 50% 및 75% 혼합한 결과, pseudowollastonite 및 rankinite 광물함량이 감소하고, 탄산화 생성물인 calcite 광물함량이 증가하여 이산화탄소에 의한 경화반응이 진행된 것을 확인하였으며, 이것은 CSA 시멘트 첨가에 의한 초기 수화반응이 이산화탄소 확산반응에 유리한 환경을 조성하였다는 것을 의미한다.
3) CSC 25% 조건에서 CSA시멘트 사용에 따른 수화생성물로써 Yeeliminate 광물생성을 확인하였다.
4) 7일 경과 후에도 수화광물인 dicalcium silicate 및 yeelimite광물뿐 아니라, 이산화탄소 반응경화광물인 rankiniten와 pseudowollastonite 광물이 다량 관찰되어 7일이후의 강도발현 가능성을 확인하였다.
5) 압축강도 측정결과, CSC 75 조건에서 3일과 7일 압축강도가 각 각 4.48N/mm2과 19.55N/mm2으로 강도발현 상승폭이 큼을 알 수 있다.
6) CSC 50 조건에서 3일과 7일 압축강도가 각 각 14.18N/mm2과 22.98N/mm2으로 1종 시멘트의 KS규격인 12.5N/mm2과 22.5N/mm2을 만족하였다. 이는 CSC 와 CSA 시멘트를 혼합 사용함으로써, 사전경화과정을 생략할 수 있어 CSC의 건설재료 활용성을 높일 수 있을 것으로 예상된다.