1. 서 론
Ti의 밀도는 4.506 g/cm3으로 Mg이나 Al보다 높으나, 비강도(강의 약 2 배, 알루미늄의 약 6 배)는 물론 내식성이 우수하여 항공, 우주, 해양, 국방 분야는 물론 민수 영역에서도 널리 사용되고 있다. 한편 Ti은 지각 중 원소 존재도가 9위일 정도로 풍부한 자원이지만1), 광석으로부터 금속 Ti의 생산 비용이 높아 수요가 확대되지 못하여 전 세계 연간 생산량은 20만 톤 수준에 불과하다2).
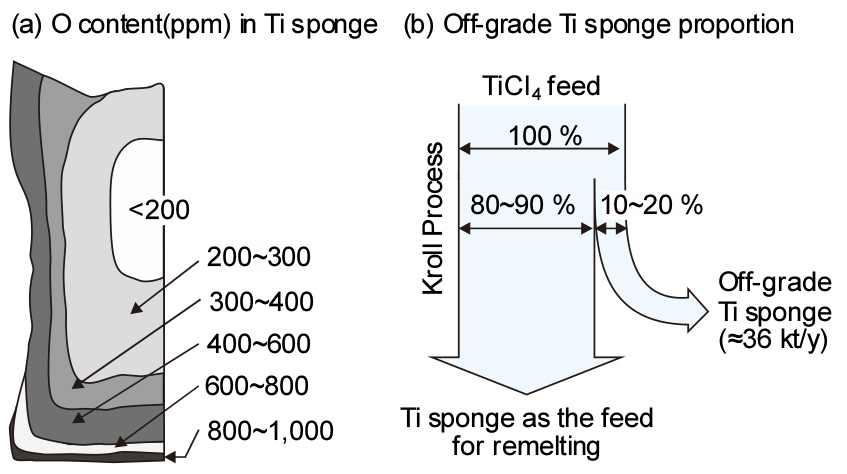
금속 Ti은 Mg으로 TiCl4를 환원하는 Kroll법3)에 의해 생산되고 있다. Fig. 1에는 Kroll법으로 제조된 10 톤 Ti 스펀지 괴 중의 [O] 농도(ppm)4)와 물질수지5)를 모식적으로 나타내었다. Kroll법의 환원 반응기로 저탄소강을 사용하고 있으므로 스펀지 괴의 외각부는 Fe 농도가 높을 뿐만 아니라, O의 농도도 높다. 특히 Kroll법에서 제조된 스펀지 괴 중 내부는 [O] 함량이 0.02 wt% 이하로 매우 낮으나, 외각부는 약 0.1 wt%O까지 나타내어 전신재용으로 사용할 수 없으므로 잉곳을 만들기 전에 제거하고 있다. 따라서 Ti 스펀지 괴의 10~20 %는 off-grade 스크랩으로 발생되고 있다. 또한 Ti 스펀지를 잉곳으로 제조하는 공정이나 제품 제조공정에서도 [O] 함량이 높은 Ti 스크랩이 다량으로 발생하고 있다.4) 특히 항공기 부품의 경우 원소재의 80~90 %가 스크랩으로 발생하고 있다6). Ti 내 [O] 함량이 높으면 연성이 저하되고 취성이 증가하여 전신재로 사용할 수 없으므로 Ti의 생산 비용 절감 및 off-grade Ti 스크랩의 고부가 가치화를 위해 [O]를 제거하기 위한 많은 연구가 수행되었다.
Yoon 등은 Ca으로 Ti 분말 스크랩을 탈산하였으나, 반응 생성물인 CaO가 완전히 제거되지 않아 산소 농도가 평형값보다 높게 나왔다7). Oishi 등은 반응 생성물인 CaO를 할로겐계 플럭스 중으로 용해시켜 산소 농도를 0.05 wt% 이하까지 탈산하기도 하였다8). IME에서는 약 2 wt%O의 스크랩을 VIM(vacuum induction melting)에서 용해할 때 탈산제로 CaAl2를 첨가하여 0.15 wt%O 이하까지 탈산하였다9). Okabe 등은 희토류 금속을 이용한 Ti 스크랩 중의 탈산에 대해 많은 연구를 수행하였다10,11,12). 특히 희토류 금속의 생산량이 증가하면서 부산물로 발생하는 희토류의 가격이 낮아져 향후 많은 활용이 기대되고 있다.
한편 Mg은 TiCl4의 환원제로 사용되고 있으며, Ti 중으로 고용한계가 매우 낮아 우수한 탈산제로 사용될 수 있으나, Ti 중 산소와 반응하여 생성된 부산물인 MgO의 활동도를 제어하여야 원하는 수준까지 탈산이 가능하다. 따라서 본 연구에서는 MgO의 활동도를 제어하기 위해 MgCl2와 YCl3의 혼합 용융염 중에서 Mg을 탈산제로 사용한 off-grade Ti 스크랩의 탈산 거동에 관하여 조사하였다.
2. 이론적 고찰
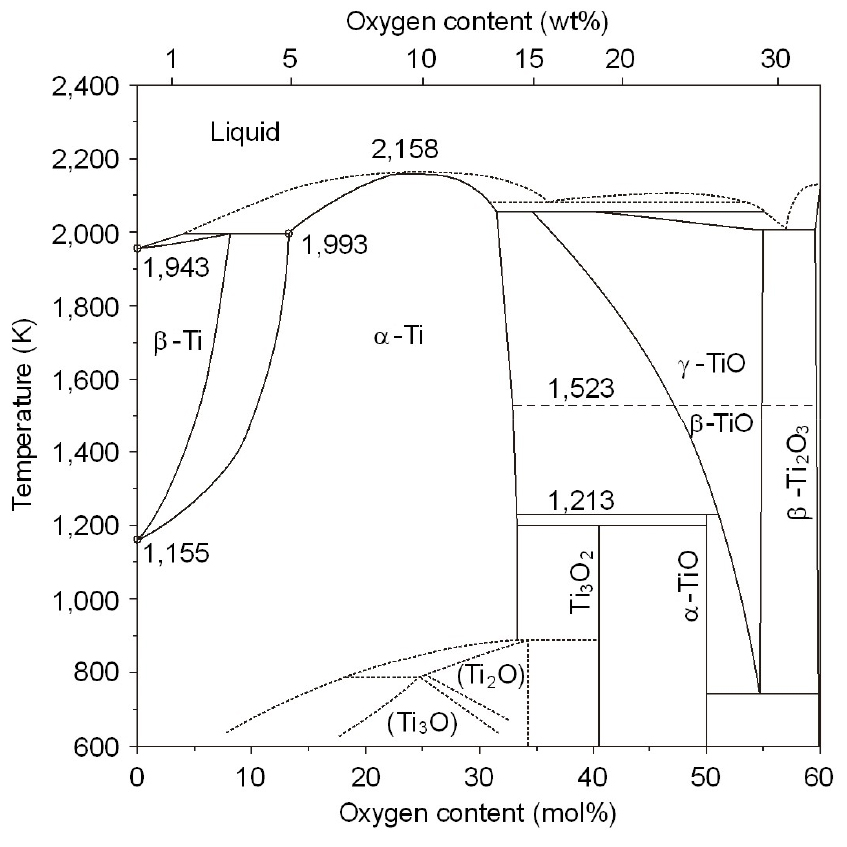
Fig. 2에는 Ti-O계 상태도를 나타내었으며13), 금속 Ti 중 산소 용해도가 매우 큰 것을 알 수 있다. 1,300 K에서 β-Ti 중 산소 용해도는 약 1 wt%이며, α-Ti 중 산소 용해도는 약 14 wt%(33 at%)이다.10) 이러한 산소는 Ti의 hcp 구조의 팔면체 격자간에 위치하여 침입형 합금을 만든다. 따라서 Ti은 경하고 취성을 가지게 되며, 결정 구조에 민감한 가공성 등의 성질에 현저한 영향을 미친다. 일반적인 Ti 제품의 O 농도가 약 0.2 wt% 이하이므로 스크랩 중의 O 농도를 0.1 wt% 수준으로 낮추면 Ti 스크랩을 원소재로 사용할 수 있을 것이다.
화학반응을 이용하여 Ti을 탈산하기 위한 탈산제로는 산소와의 친화력이 Ti보다 크고, Ti 중에 고용되지 않아야 하며, 그리고 반응 생성물인 산화물의 제거가 쉬워야 한다. 이러한 탈산제가 될 수 있는 금속으로는 산화물의 표준 생성 자유에너지도로부터 Mg, Ca, Y 등이 있다. Mg은 융점이 923 K로 Ca의 1,115 K 및 Y의 1,799 K 보다 낮아서 고-액 반응에 유리하지만, Mg 단독으로는 0.5 wt%O 이하까지 탈산할 수 없는 문제점이 있다14). 그러나 생성물인 MgO의 활동도를 1,173 K의 MgCl2 중에서 전기화학적인 방법으로 낮추면 0.1 wt%O에서 0.02 wt%까지 탈산할 수 있는 것으로 보고되었다15). 본 연구에서는 Ti을 Mg으로 탈산하면서 MgCl2-YCl3의 혼합 플럭스를 이용하여 반응 생성물인 MgO의 활동도를 낮추고자 하였다.
우선 Ti으로의 산소 용해 반응은 다음 식과 같이 나타낼 수 있다16).
그리고 Mg의 산화 반응은 다음과 같다17).
식 (1), (2)로부터 Mg에 의한 Ti의 탈산 반응은 식 (3)과 같이 나타낼 수 있다.
은 기체 상수(8.314 J/K·mol), 는 절대 온도(K)이며, , 는 각각 MgO와 Mg의 활동도, 는 고체 Ti 중에 용해된 O의 헨리형 활동도 계수를 나타낸다. 식 (3)의 를 1로 가정하고 Ti 중 O가 용해되어 있는 상태가 헨리의 법칙을 만족하여 가 1이 된다고 가정하면 Mg, MgO와 평형하는 Ti 중의 산소 농도는 식 (4)처럼 와 의 함수로 나타낼 수 있다. 따라서 식 (4)로부터 와 온도가 낮을수록 Ti 내 O의 농도가 낮아지므로, 일정한 온도에서 를 제어하면 원하는 수준까지 탈산이 가능하다.
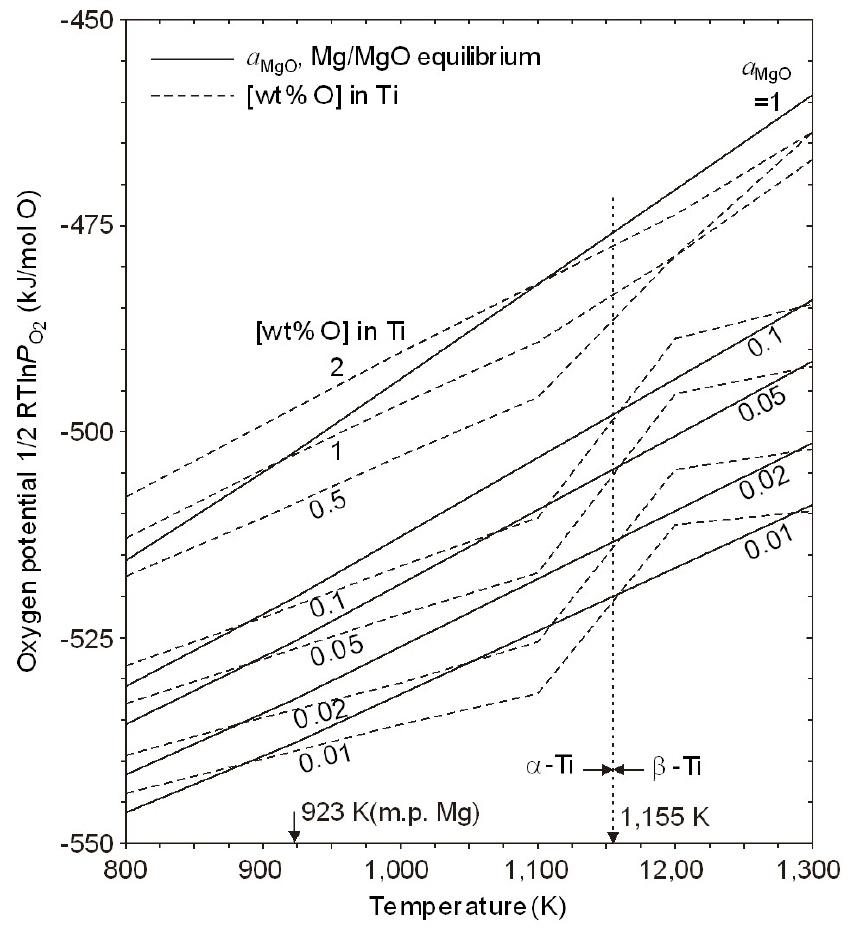
Fig. 3에는 Mg/MgO 평형에서 반응식 (2)의 를 1로 두고 에 따른 산소 퍼텐셜(자유에너지, 실선)과 식 (1)의 Ti-O 고용체의 온도에 따른 산소 퍼텐셜15)을 비교하여 나타내었다. Mg을 환원제로 사용하면, 그림에 나타낸 바와 같이 Mg의 융점 이상에서는 가 1일 때 Ti 중 산소를 1 wt% 이하로 낮출 수 없으나, 를 0.05 이하로 낮춘다면 0.1 wt%O 이하로, 를 0.02 이하로 낮추면 0.05 wt%O 이하까지 낮출 수 있다.
따라서 본 연구에서는 Mg을 이용한 탈산에서 를 낮추기 위해 YCl3를 플럭스로 사용하였다. YCl3와 MgO의 반응에서는 다음 식과 같이 YOCl이 생성된다. 반응 중 생성된 YOCl에 대한 열역학적 데이터가 불확실하다는 문제점이 있으나, YOCl에 대한 자유에너지는 Patrikeev의 데이터18)를 해당 온도까지 외삽하여 구하였다.
따라서 식 (3), (5)로부터 YCl3-MgCl2 혼합 용융염 중 Mg을 탈산제로 사용한 Ti 스크랩의 탈산은 다음 식과 같이 나타낼 수 있다.
식 (6)에서 Mg은 금속상이며, 실험온도에서 YOCl은 고체 상태로 존재하므로19)와 을 1로 가정하였다. 따라서 =1로 두었을 때 타이타늄 중의 산소 농도는 식 (7)과 같이 나타낼 수 있다.
식 (7)로부터 플럭스로 사용하는 MgCl2와 YCl3의 비율과 온도에 따라 Ti 내 산소 농도를 0.1 wt% 이하까지 낮출 수 있다. 따라서 본 연구에서는 Mg을 탈산제로 사용하고, 생성된 MgO를 MgCl2-YCl3계의 혼합 염화물 중으로 용해시켜 off-grade Ti 스크랩의 탈산 거동에 미치는 반응 조건의 영향에 대하여 조사하였다.
3. 실험방법
본 실험의 시료로는 러시아 VSMPO-AVISMA사의 off-grade Ti 스펀지 스크랩을 사용하였다. 분말상의 시료를 850 μm 이하로 분급하여 사용하였으며, 분급 후 측정된 Ti 스크랩의 평균 산소 농도는 약 0.5 %였다. 환원제로는 Mg 잉곳(Balmann instrument Co., Ltd.)을 사용하였고, 플럭스는 분말 형태의 MgCl2(99 %, Alfa Aesar Chemical Co., Ltd)와 YCl3(99.9 %, Alfa Aesar Chemical Co., Ltd)를 사용하였다.
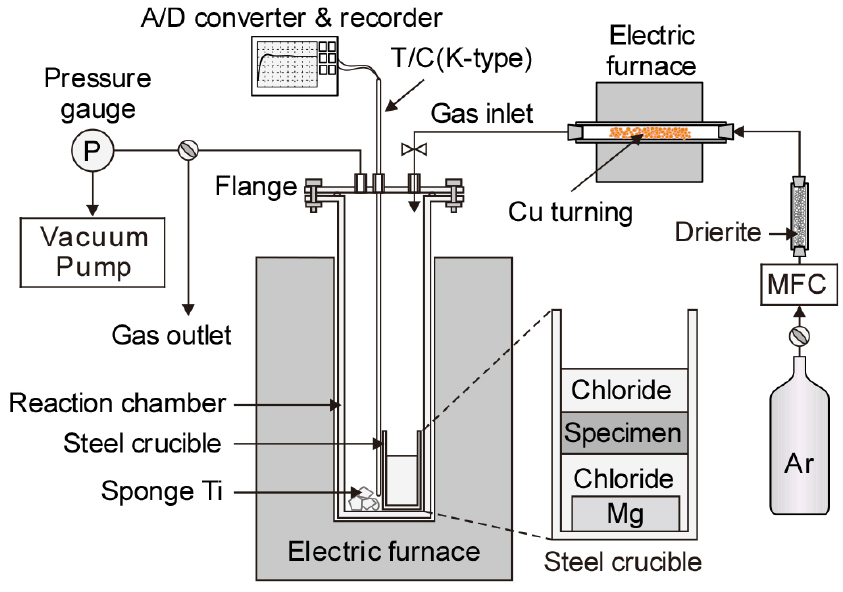
Fig. 4에 실험 장치의 모식도를 나타내었다. 전기로를 가열 장치로 사용하였으며, 반응기(외경=110 mm, 내경=100 mm, 높이=400 mm)는 스테인리스강으로 내부 분위기를 조절할 수 있도록 제작하였다. 상부 플랜지로부터 Ar을 송입하였고, 배출구에 진공 펌프를 연결하여 배기가 가능하도록 하였다. Ar은 흡습제와 873 K의 탈산로를 거쳐 수분과 산소를 제거시켰으며, MFC(Mass Flow Controller: MKS type 247)를 이용하여 유량을 제어하였다. 반응기 내부에 잔존하는 산소를 제거하기 위해 Ti 스펀지를 반응기 내의 도가니 옆에 두었고 반응 중 열전대(K type)를 도가니 벽면에 붙여서 반응 온도를 측정하고 제어하였다.
Table 1에 실험 조건을 나타내었다. 먼저 글로브 박스를 이용하여 저탄소강제 도가니(내경=36 mm, 높이=60 mm)에 시료를 넣은 후 반응기 내부에 장입하였다. 그 후 반응기를 밀폐하여 내부를 배기한 후 탈산한 Ar을 1,000 sccm 유량으로 주입하였다. 상온에서 230 ℃까지 5 ℃/min의 속도로 승온하였고, 반응기 내의 공기와 수분을 제거하기 위해 진공 배기와 Ar 송입을 3회 실시하였다. 진공 배기를 완료한 후 Ar 분위기 중에서 10 ℃/min의 속도로 실험 온도까지 승온시켜 목표 시간까지 유지하였다. 실험 후 시료는 상온에서 수세한 후, 0.3 M HCl, 0.2 M HNO3 용액에서 각각 2시간 산세하여 잔여하는 염화물, MgO, YOCl 그리고 미반응 Mg을 제거하였다. 수·산세를 거친 시료는 건조 후 산소 농도를 분석(ON-900, ELTRA)하였다.
4. 결과 및 고찰
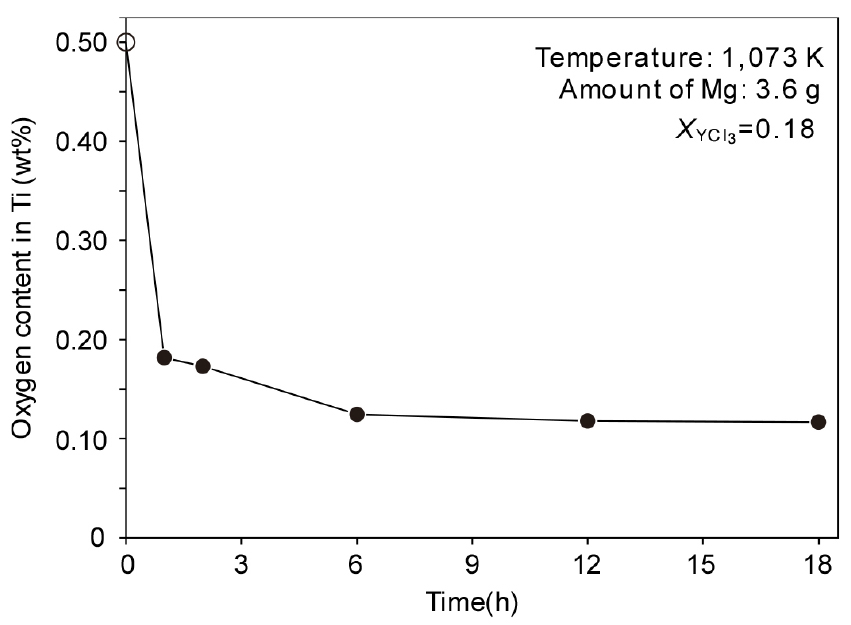
Fig. 5에 반응 시간에 따른 Ti 내 산소 농도의 변화를 나타내었다. 실험은 1,073 K, Mg=3.6 g, YCl3의 몰비인 ()=0.18의 조건에서 실시하였다. 대부분의 산소가 스크랩 표면에 존재하여20) 1시간만에 Ti 내 산소가 초기의 0.5 wt%에서 0.2 wt% 이하로 급격하게 감소하였고, 6시간까지는 산소 농도가 지속적으로 감소하였다. 6시간 이후에는 탈산속도가 현저하게 감소하였는데, 이는 Ti 스크랩 표면에 있는 산소가 제거되어 빠른 속도로 탈산되는 반응 초기와는 달리 시간이 지날수록 Ti 내에 고용되어 있는 미량의 산소가 표면까지 확산하여 탈산 반응이 일어났기 때문으로 생각된다. 12시간 반응하였을 때 약 0.124 wt%를 나타내었으며, 그 이후에는 거의 일정한 수준의 농도를 나타내었다. 한편 탈산한 시료를 수세 후 ICP분석 하였을 때 Y은 0.002, Mg은 0.012 wt% 정도 검출되어 산소를 제외한 플럭스에 기인하는 불순물은 쉽게 제거 되었다.
Fig. 6에는 탈산제로 사용한 Mg 양에 따른 Ti 내의 산소 농도 변화를 나타내었다. 식 (6)으로부터 0.5 wt%의 산소 농도를 가지는 Ti 스크랩 4 g의 탈산에 필요한 Mg은 화학 양론적으로 약 0.03 g이지만, 본 실험에서는 액체 상태의 Mg에 의한 탈산을 위해 Ti 스크랩과 Mg이 충분히 접촉할 수 있도록 과량의 Mg을 첨가하였다. Mg를 넣지 않은 실험에서는 산소 농도가 약 0.8 wt%까지 증가하였으나, 1.7 g의 Mg를 첨가하였을 때 약 0.13 wt%까지 탈산되었다. 그러나 그 이상의 Mg을 첨가하여도 Ti 중 산소 농도는 크게 변하지 않았다. 따라서 Mg이 탈산제 역할을 하며, YCl3는 직접적으로 탈산에 관여하지 않고, 식 (4) 및 식 (5)에 나타낸 바와 같이 MgO와 반응하여 를 감소시키는 역할을 하는 것으로 생각된다.
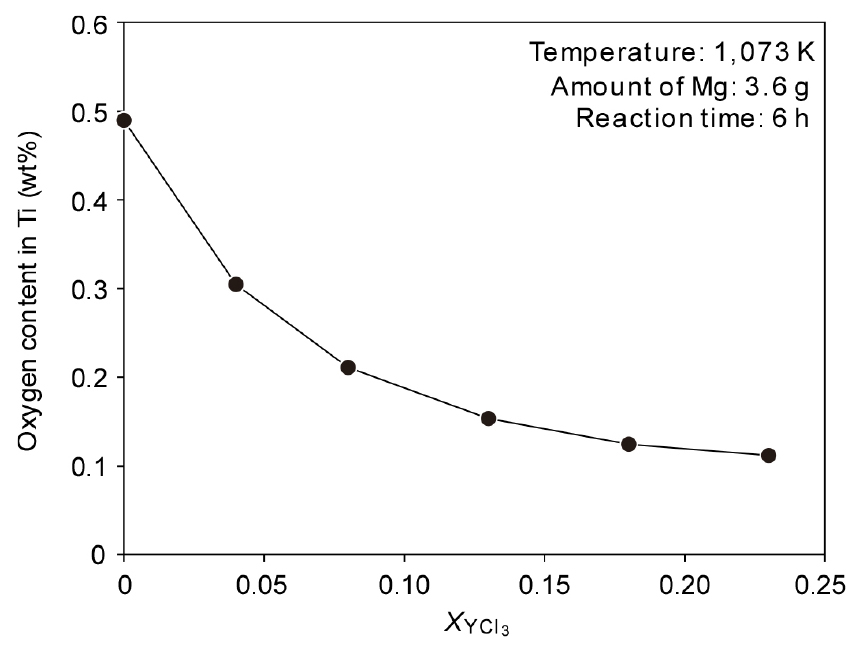
Fig. 7에 식 (7)의 의 영향을 파악하기 위한 변화에 따른 Ti 내 산소 농도 변화를 나타내었다. 플럭스로 사용한 혼합 용융염인 YCl3+MgCl2는 26 g으로 고정하였다. YCl3를 첨가하지 않은 MgCl2 단일 플럭스일 때의 Ti 중 산소 농도는 초기값과 거의 차이가 없었다. 그러나 용융염 중 YCl3의 비율이 높아질수록 산소 농도가 감소하였으며, =0.23에서 가장 낮은 0.1117 wt%를 나타내었다. 이러한 결과는 식 (5)의 반응에 의한 플럭스 중 MgO의 활동도 감소에 의한 것으로 생각된다. 그리고 식 (7)로부터 Ti 중 산소 농도는 가 증가할수록 증가하고, 가 증가할수록 낮아진다. 본 실험에서는 용융염 중 YCl3가 많아지면 가 증가하고 는 감소하여 Ti 중 산소 농도가 감소한 것으로 생각된다.
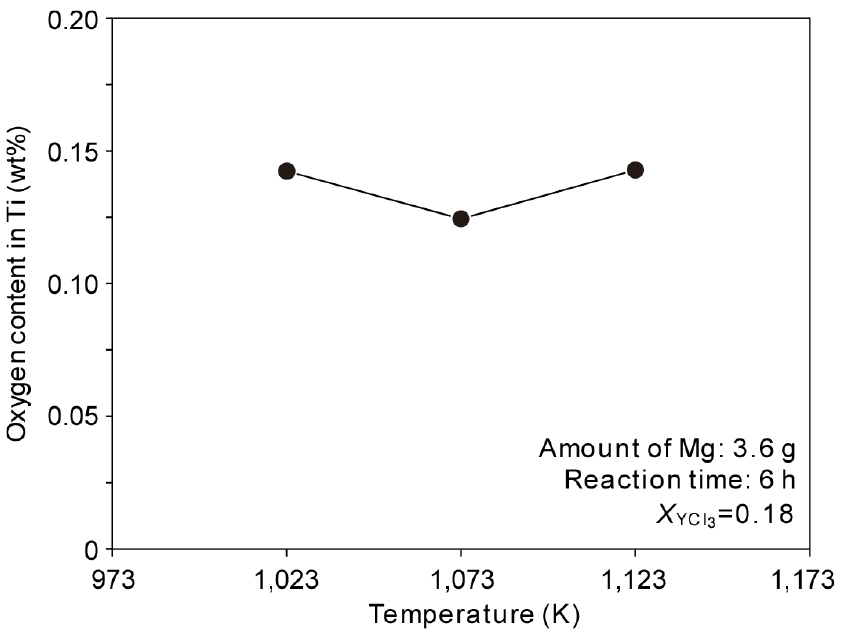
Fig. 8에는 1,023~1,123 K에서 반응 온도에 따른 Ti 내 산소의 농도 변화를 나타내었다. 식 (7)에 나타낸 바와 같이 플럭스의 비율이 일정한 경우, 온도가 높을수록 Ti 중 산소 농도가 증가한다. 그러나 실험 결과 온도의 영향은 크게 나타나지 않았다. 이러한 결과는 분석 오차를 포함하여 온도의 영향과 반응 시간의 영향이 복합적으로 나타났기 때문으로 생각된다. 온도가 낮을수록 Ti 중 산소 농도가 감소하여야 하지만, Mg이 Ti 중의 O와 반응하기 위해서는 용존 O의 확산도 중요하다. 온도가 낮을수록 Ti 중 O의 확산계수가 감소하여21) 반응 속도가 감소된 영향과 열역학적 요인이 복합적으로 작용된 것으로 생각되며 향후 온도에 영향에 대한 면밀한 검토가 필요할 것으로 생각된다.
5. 결 론
본 연구에서는 Ti의 제련 및 가공 과정에서 발생한 off-grade Ti 스크랩을 Mg으로 탈산할 때, 반응 생성물인 MgO의 활동도를 낮추기 위하여 플럭스로 MgCl2와 YCl3를 사용하였다. Ti 스크랩의 탈산에 미치는 반응 시간, 온도, Mg 양, 플럭스인 염화물 비율의 영향을 조사하였으며, 그 결과를 종합하면 다음과 같다.
1) 혼합 플럭스 중에서 Mg으로 Ti 스크랩을 탈산시켰을 때, 반응 시간의 증가와 함께 산소 농도가 감소하였으며, Ti 스크랩 표면의 산소는 짧은 시간 안에 낮은 산소 농도까지 탈산되었다. 그러나 Ti 스크랩의 내부에 고용되어 있는 산소의 탈산에는 더 많은 시간이 소요되었으며, 12시간 이후에는 유사한 산소 농도를 나타내었다.
2) 화학 양론값보다 많은 Mg를 넣고 용융염 내 YCl3를 증가시킴에 따라 Ti 내의 O 농도가 감소하였으며, =0.23에서 가장 낮은 0.1117 wt%까지 도달하였다. 이는 YCl3가 MgO와 반응하여 를 감소시키고, 가 증가하였기 때문으로 생각된다.
3) 열역학적 평형 계산으로부터 온도가 낮을수록 Ti 중 산소 농도가 감소하여야 하지만, 본 실험 온도 범위에서는 큰 차이가 나지 않았다.