1. 서 론
바나듐(V)은 금속, 기계기구, 재료, 화학약품, 안료 등 다양한 분야에 사용되며, 이 중 철강분야에서는 합금소재로 이용되며 화학분야에서는 촉매 재료로도 이용된다1,2). 바나듐을 함유하고 있는 광물은 매우 다양하며3,4), 이러한 바나듐의 회수는 대체로 배소(Roasting), 침출 등 여러 공정을 통해 이루어진다2,4,5). 이 중 염배소 후 침출을 통한 회수가 종종 거론되는데. 가장 대표적인 바나듐 염배소 반응의 반응물은 오산화바나듐과 염화나트륨이며 생성물은 바나듐산나트륨이다6,7). 이러한 공정을 통해 후단에서의 고순도 바나듐 화합물 침출회수가 용이하다. 특히 본 연구에서는 바나듐 염배소시 열화학적 측면에서의 rotary kiln 적용성 타진에 중점을 두었다. Rotary kiln 장비의 적정 설계와 운전을 위해서는 장치내 열/물질전달, 화학반응, 고체입자거동 등 복잡한 메카니즘을 이해하고 정량화해야 하는데, 이 중 특히 열 및 온도에 관련된 메카니즘이 매우 중요하다. 이에 본 연구에서는 열화학 및 열전달 모델링 측면에서 rotary kiln의 열 및 온도에 관련된 인자와 중요도를 평가하였다. 특히 이러한 메카니즘과 인자를 논의하는 과정에서 바나듐 배소용 rotary kiln내 최적 배소온도를 유지하는 방안을 논의하였다.
이를 위해 본 연구에서는 적정 배소 온도 및 이에 소요되는 열원(연소반응 및 발열반응)을 살펴보고 주 열전달 메카니즘에 부합한 열전달 경로를 검토하였다. 또한 적정 체류시간 산출을 위해 티탄철석내 바나듐의 염배소 반응 및 바나듐 주위의 자철석 발열에 관련된 반응속도식을 제사하였다. 마지막으로 현실적인 rotary kiln 구조 상에서 적정 온도 구간내 체류시간을 유지하기 위한 방안 등을 논의하였다.
2. 연구 방법
본 연구에서 Rotary kiln내 열 관련 메카니즘 분석 및 모델링은 바나듐 염배소 반응속도 모델링, 바나듐 함유 티탄철석의 상당부분을 차지하는 자철석의 고온산화 반응속도 모델링, 열원에서 광석으로의 열전달 및 그게 따른 온도 분포로 구분된다. 이중 염배소 반응속도 모델링에 활용된 반응속도 실험 데이터는 본 연구 관련 예비실험 결과 데이터이다. 예비실험에서 도출된 데이터를 적절한 반응속도 메카니즘을 가정하고 이에 따른 반응속도 모델식을 산정한 것이다. 자철석 산화반응속도 모델은 기존의 유사 모델식을 약간 변형한 것이다. 한편 화학반응속도는 통상적으로 반응물/생성물 농도 외에도 온도의 영향을 많이 받는데, 이 때 반응속도 및 관련 속도계수의 온도의존성은 Arrenius식이나 유사식을 적용할 수 있다8,9). 그리고 자철석 산화반응에 따른 발열량은 자철석 발열반응에서 엔탈피(열) 산정시 엔탈피양은 산화도(광석내 자철석 중 발열 산화된 양의 비율)에 정비례한다고 가정한다. 이를 통해 자철석 산화반응모델에 의거 rotary kiln내 주어진 체류시간 동안 산화도를 먼저 계산되면 그게 상응하여 합리적인 엔탈피에너지(발열량)을 구할 수 있다. 마지막으로 열원 및 발열량에 따른 열전달과 열수지를 고려한다. 이 때 모델의 편의를 위해 가상적 rotary kiln내 freeboard내 가스상이나 입자상 거동은 완전혼합상태 및 정상상태를 전제로 한다. 바나듐 염배소 반응의 특성상 rotary kiln내 임의의 지점에서의 가스 및 광석 bed 온도는 반응률에 영향을 미치는 가장 중요한 인자이며 이러한 임의지점에서의 온도분포는 연료발화나 광석발열반응 등에서 발생되는 열이 rotary kiln내 여러 지점으로 전달되는 다양한 형태의 열전달 메커니즘을 통해 예측된다. 연소 또는 외부가열(벽면으로부터 받은 열량)로부터 얻은 열량 중 고체층의 온도를 상승시키는데 사용된 열량, 화학반응에 사용된 열량, 벽면으로 손실된 열량이 계산되면 해당 셀에서 기체상과 고체층의 온도가 연결되어 계산된다10,11).
3. 결과 및 고찰
3.1. 배소반응속도 모델
배소반응속도 모델을 도출할 예비 실험은 광석과 첨가제(탄산나트륨)을 회분식로에 일시에 주입하여 고온가열하는 방식이었다6,7). 예비 실험 결과, 주요 인자는 시료입도, 염배소 온도, 배소시간, 탄산나트륨량 등으로 파악되었다. 이 중 특히 염배소 온도가 가장 critical 한 인자로 관찰되었는데, 반응기내 온도를 섭씨 1123~1373 K 조건하에서 탄산나트륨의 중량비를 전체 광석+탄산나트륨의 0%~30% 정도로 혼합하고 배소시간을 0.5~3시간을 적용한 결과 바나듐 침출률이 최고 80% 이상을 달성하였다6). 단 배소효과의 온도 의존성이 매우 민감하여 상기 적정 배소 온도범위를 하회할 경우 배소 후 침출률이 저하되는 반면, 상회할 경우 용융 등이 발생하여 배소 자체가 저해되었다6,7). 따라서 향후 rotary kiln 설계/운전시 광석을 상기 적정온도범위 내 가급적 넓은 구역에서 장기 체류시키는 것이 관건으로 판단되었다. 본 연구에서는 배소반응속도식을 산출하였는데 이는 배소 초기부터 0.5시간까지는 배소효과의 급격한 증가와 0.5시간에서 3시간까지의 완만한 증가세를 정량화하였다. 이에 따라 반응속도식은 배소시간 초기 15분은 배소효과가 시간에 따라 선형적으로 급격히 증가하며 그 선형기울기는 Arrhenius 반응식을 적용하여 온도에 의존되도록 표현하였다8,9). 반면 배소시간 15분 이 후 부터는 증가세가 급격히 감소되어, 기존 유사문헌에서 제시한 바와 같이 배소초반의 반응우세(Reaction dominant)구간과 후반 확산우세(Diffusion dominant)구간으로 구분하었다8). 이는 각각 반응제한 및 확산제한 영역으로 지칭하여도 크게 무리가 없다고 본다. 즉 배소 초기에는 다음과 같은 선형적 관계를 가진다(k‘는 선형계수).
여기서 침출율은 배소시간 t를 가한 이후의 침출율을 의미하며 사실상 배소효과를 의미한다. 초기 침출율은 배소시간 t = 0 즉 배소전처리가 없는 상태에서의 침출율(문헌에서는 4.32%)을 의미한다. 반면, 배소 후기에는 배소시간에 다른 배소효과의 비선형적 완만한 다음의 증가곡선으로 묘사되었다8).
또한 반응속도계수 k와 k‘의 온도의존성을 나타내는 Arrhenius 방정식(k = Aexp(-Ea/(RT))은 자연로그를 이용하면 다음의 식으로 변형시킬 수 있다.
여기서 Ea는 활성화에너지, R은 기체상수, T는 절대온도 그리고 A는 상수이다.
그리고 상기 모델을 본 과제의 바나듐 배소실험에 적용하였다. 그 결과 Fig. 1에서 나타낸 형태와 같은 모델결과가 도출되었다. 예비실험결과가 배소시간에 따라 배소효과가 완만하게 증가되는 확산제한구역에 포함되어 있다고 판단되어 확산우세 반응속도계수(k)부터 산출하였다. 기존문헌에서 제시한 반응우세 및 확산우세 영역을 본 연구에서는 배소시간 15분을 기준으로 구분하였다8). Table 1을 보면 배소시간에 따른 전환율과 반응속도 계수를 도시하였으며 예를 들면 배소온도 1050 °C의 경우 확산우세 구간의 반응속도 계수는 0.0009(/min)로 산출되었다. 그리고 온도에 따른 반응속도계수 변화량도 기술하였다. 물론 온도의존성은 이미 언급한 Arrhenius 식을 이용한 것이다. Fig. 1 우측의 두 그래프를 보면 반응속도계수의 자연로그값과 배소온도의 역수(1/K)의 선형상관관계를 볼 수 있으며 이는 결정계수 90% 이상의 높은 상관성을 보였다. 참고로 배소시간 15분 이전의 반응제한구역내 반응속도계수(k’)는 단순히 배소효과(침출율)을 15분으로 나눠서 산출하였다. 이때 침출율은 먼저 구한 확산제한구역의 속도계수를 외삽하여 추정한 것이다. Arrhenius식과 배소온도의 역수와의 선형성은 95%의 결정계수로 매우 높은 상관관계를 보였다. 이를 종합하여 배소속도식을 산출하면 배소시간 Fig. 1의 좌상에 나와있는 수식처럼 배소시간 15분을 기준으로(반응제한) 반응속도계수 k’를 포함한 선형곡선과 15분 이후(확산제한) 반응속도계수 k를 포한한 비선형곡선으로 구분하여 나타내었다. 여기에 필요하면(Fig. 1의 좌하측에 나타낸 바와 같이) 탄산나트륨의 농도 관련 식을 추가할 수 있으며 이는 탄산나트륨의 중량비가 전체의 20% 이상이 될 경우 1에, 0%일 경우 0에 수렴하며 중간일 경우 실측값에 맞도록 적당한 함수를 적용하면 쉽게 해결된다. 또한 입도 등의 다른 인자들은 속도계수를 입도에 따른 함수로 전환하고 그 함수내 계수를 실측치에 맞춰서 나타낼 수 있을 것이다.
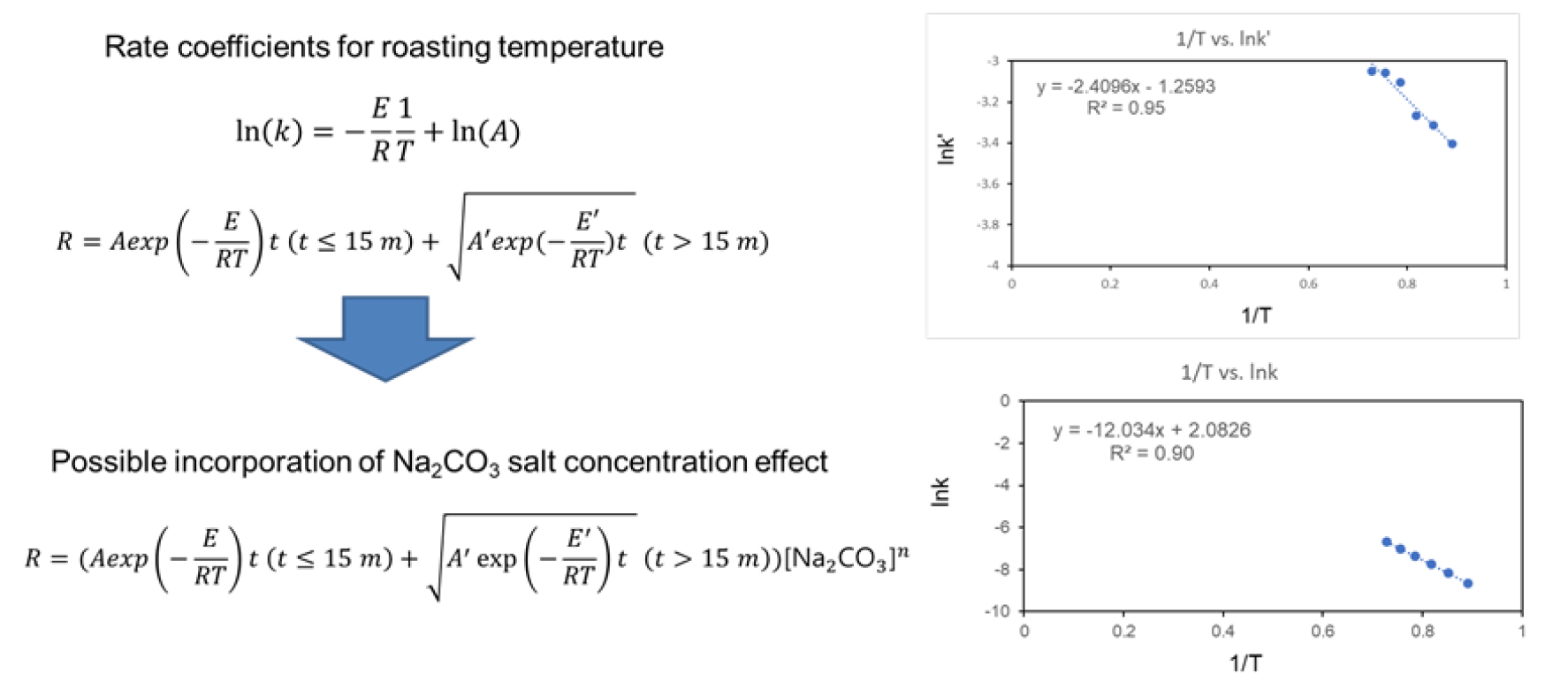
Fig. 1.
Demonstration of vanadium roasting rate efficient variation according to roasting temperature and potential incorporation of salt effects (Left), and the two plots on roasting rate coefficient lnk’ versus inverse temperature (1/K) (Right-top) and lnk versus increase temperature (1/K) (Right-bottom).
Table 1.
Vanadium roasting rate coefficients for the reaction (k) and the diffusion (k’) dominant regions, respectively
3.2. 자철석 산화반응속도 모델
또한 본 연구에서는 바나듐 배소 외에도 티탄철석의 상당부분을 차지하는 산화철 특히 자철석의 산화반응을 살펴볼 필요가 있다. 이는 자철석이 산화되면서 상당한 열을 생성시키기 때문인데 자철석(Fe3O4) 1몰이 적철석(Fe2O3)으로 산화하면서 발생되는 열(ΔH° ≈ 115 kJ/mol)은 대략 석탄내 탄소성분이 이산화탄소로 산화될 때 발생하는 열(ΔH° ≈ 393 kJ/mol)의 1/4~1/3 정도에 달한다9,11). 이는 상당한 수준의 발열로 생각되며 연소열의 상당부분을 자철석의 발열로 대치가능하다고 판단된다. 발열에 소요되는 시간은 자철석의 산화반응속도와 연관이 있다고 전제한다. 이에 관련된 최근문헌을 보면 Cho and Pistorius (2011)은 시간에 따른 자철석 산화곡선이 포물선 형태로 그려짐을 관찰하였다9,12). 반응물의 고체 확산에 기인하며, 이에 입도를 고려한 산화반응을 간단히 다음의 식으로 나타내었다9,12).
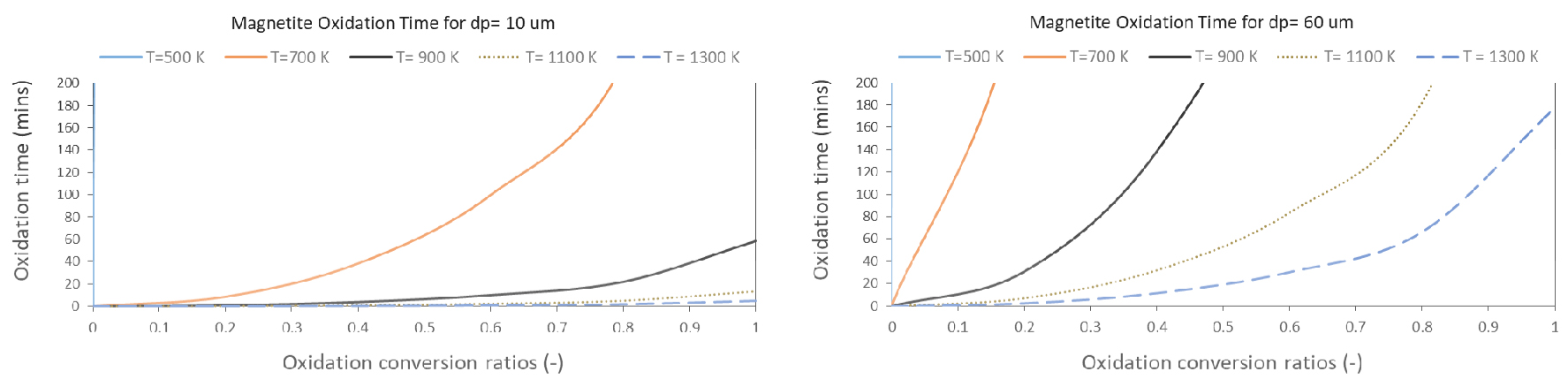
여기서 t(min)는 자철석 입자 전체 중 산화도 a(-)만큼 산화되었을때 걸리는 시간을 의미하며 d(μm)는 자철석입자의 입도; kp(μm2/min)는 속도상수를 의미한다. 문제는 상기 식이 t의 함수가 아니고 산화도 a의 함수로 표기되어 있어 수치계산 입력에 필요한 시간에 따른 도함수 등을 도출하기가 힘들다. 따라서 본 연구에서는 상기 식을 다음과 같이 근사하였다.
이 식의 결과 값을 원래 식과 비교하였을 때 매우 유사하며 시간에 따른 도함수로 표현하기가 매우 원활하다. 여기서 속도상수 kp의 온도의존성은 Arrhenius 식을 통해 표현 가능하다. 기존 문헌에서는 kp = 220·exp(65100/R/T)를 제시하였으며 여기서 R은 기체상수 T는 절대온도(K)이다9,12). 참고로 상기 포물선 속도 상수 도출 실험은 원래 53 μm에서 63 μm 사이의 좁은 크기 범위를 갖는 자철석 정광 입자를 일반 공기와 유사한 조성을 가진 기체 혼합물에서 500, 600 및 800 °C에서 24시간 동안 산화한 결과를 분석한 것이다. 다른 연구에서도 400~800 °C 온도 범위에서 74~100 μm인 자철석 정광 입자 산화실험 결과 유사한 형태의 포물선 곡선이 도출되었으며 속도상수까지 유사하다는 점을 발견하였다12,13). 또한 산화반응 속도는 극히 저산소조건이 아니면 산소 함량에 크게 영향을 받지 않는다고 보고되었다12).
Fig. 2에서 나타낸 두 그래프는 서로 다른 자철석 입자 및 온도조건하에서 산화도에 따른 산화반응시간을 위 식에 따라 도시한 것으로 모든 곡선이 우상향을 나타내고 있다는 것은 높은 산화도(a~1)를 달성하는데 오랜 산화반응시간이 필요하다는 점을 의미한다. 온도가 높을수록 그리고 입도가 작을수록 임의의 산화도에 도달하는데 필요한 산화반응시간이 단축된다는 점도 알 수 있으며 특히 낮은 산화도를 달성하는데 요구되는 반응시간은 매우 짧지만 요구되는 산화도가 증가하면서 점점 긴 반응시간이 필요하다. 이는 산화도가 낮으면 주위 산소 및 고온환경에 쉽게 노출되는 입자표면부터 산화가 신속히 진행되기 때문인 반면, 높은 산화도 조건에서 산화반응을 지속시켜 산화도를 증가시키려면 입자내부로 산소 등의 반응물질확산과 열확산이 동시에 이루어져야 하기 때문에 상대적으로 오랜 반응시간이 걸리기 때문일 것이다.
3.3. 열전달 모델링
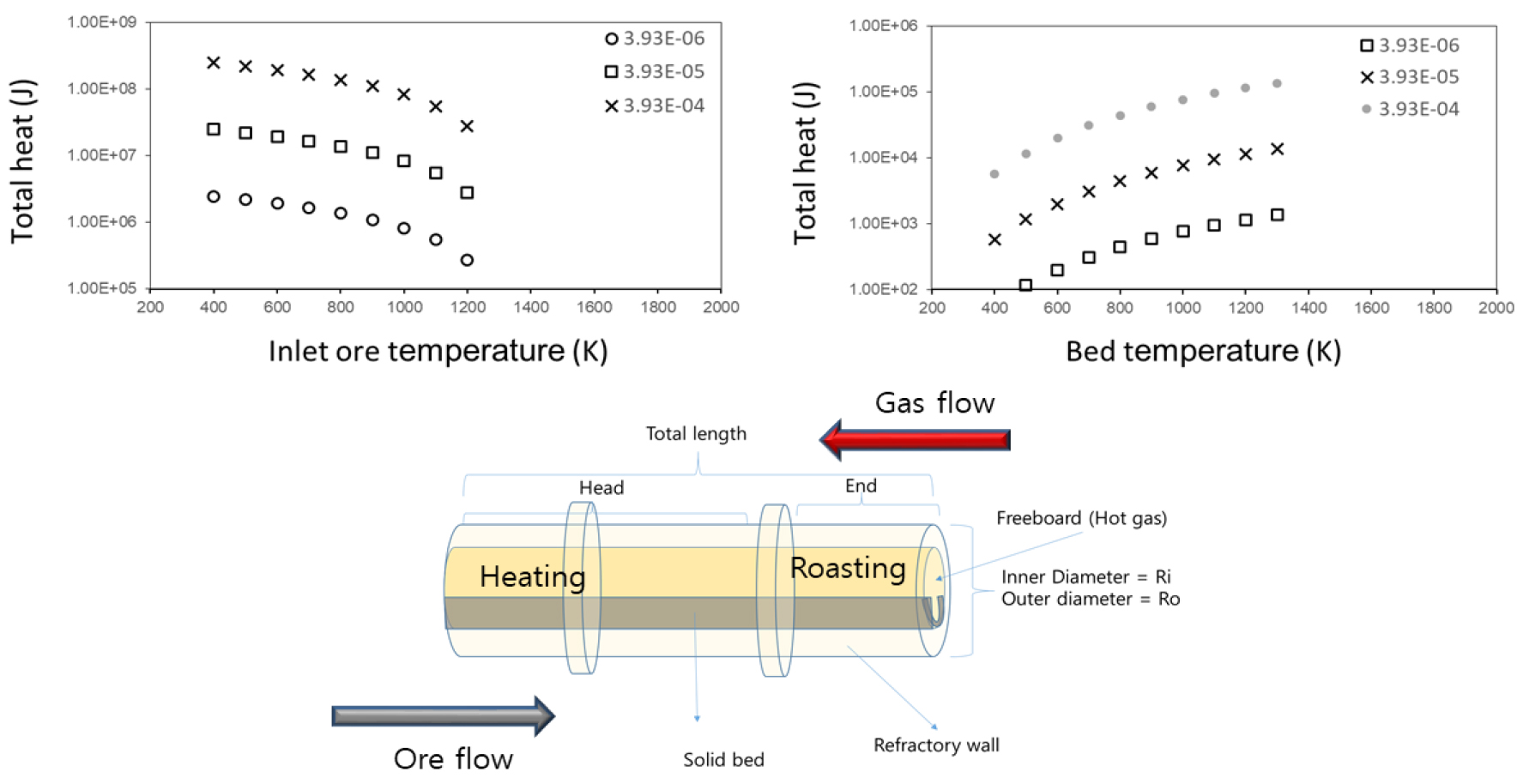
본 장에서는 rotary kiln내에서 발생한 열전달과 온도분포에 대해 논의할 것이다. 참고로 열전달 방정식 및 계수는 기존문헌에서 제시된 것이다10,11,14,15,16). 한 가지 다른 점은 본 연구에서는 광석 입도에 따른 영향을 고려하였는데, 이는 광석입자의 입도가 작을 때 열전달 면적이 증대되어 열전달률이 증가된다는 것을 반영할 필요가 있다. 그리고 모델링 대상 rotary kiln는 Fig. 3에 나타낸바와 같이 광석/가스의 향류식 흐름을 전제하고 있다. Rotary kiln을 축방향으로 크게 2 section으로 구분할 수 있는데 먼저 광석유입/가스배출 지점에 가까운 Head, 그리고 광석배출/가스유입지점에 가까운 부분을 End로 구분하였다. 복사열원인 화염은 당연히 End 부분에서 End와 Head의 중간부분까지 미친다고 가정한다. 그러면 기존문헌의 온도구배를 토대로 Head/End와 각 section별로 적당한 온도, 길이 및 체류시간(각 section별로 1시간씩)를 기입하면 광석내 자철석의 section별 산화도가 계산된다. 참고로 산화도는 온도에 따라 크게 의존하며 고온구역에서 집중적으로 산화도가 상승하며 이에 따라 발열량도 증대된다. 참고로 발열량은 한국지질자원연구원에서 제공 받은 자철석 산화 반응의 온도별 엔탈피 변화량 도표를 이용하여 산정하였으며 온도가 도표에 표기되지 않은 경우에는 표기된 온도를 내삽하여 추정된 엔탈피 값을 이용하였다. 그리고 주어진 길이방향의 온도구배를 달성하기 위해 공급되어야 될 열을 계산하여야 하는데 이는 부분적으로 방금 언급한 광석내 자철석의 산화열에서 충당하겠지만 대부분은 연소반응결과 나오는 복사열전달이 주된 경로일 것이다.
예를 들어, bed층 광석이 Head에서 End로 흐를 때까지 400 K에서 1300 K까지 증대된다고 하면, 각 section마다 온도를 올리는데 필요한 열의 상당부분이 freeboard에서 나오는 연소반응 복사열에서 충당되어야 한다는 것이다. 또한 복사열전달이 진행되기 위해서는 freeboard내 연소화염의 온도가 bed층보다 상당히 높아진다11). 고온가스 주입량은 해당 연소반응을 통해 복사열전달을 충분히 일으킬만한 (탄화수소)연료량+(산소포함)예열공기량과 같으며 이때 예열공기량은 연료 및 광석내 자철석의 완전산화가 가능한 이론적 공기량에서 약 1.2배 정도를 곱한 만큼을 고려하는 것이 합리적일 것이다. 연소반응에서 나오는 발열량은 연료의 탄화수소의 완전산화를 가정하여 산출된 엔탈피 값을 이용하면 되고 연소불꽃의 온도는 산소공급량에 따른 기존문헌에 도시된 도표를 참조하면 될 것이다11). 그리고 연소반응결과 발열량의 대부분(90% 정도)이 복사열 형태를 통해 광석층으로 전달된다고 하면 이에 필요한 연료주입량을 계산할 수 있을 것이다.
Fig. 3에 나타난 좌측 그래프는 열수지 모델링 결과 가상 향류식 rotary kiln의 온도분포를 얻기 위해 광석을 가열하는 열을 나타낸 것이다. 또 다른 우측 그래프는 광석층 온도에 따라 광석내 자철석 산화반응결과 발열량을 나타낸 것이다. 여기서 광석은 freeboard내 열원과 내벽에 의한 주로 복사열에 의해 가열될 수 있는데 참고로 열원의 경우만 한정시켜 볼 경우 초당 1 mol의 메탄가스가 완전연소될 경우 약 900 kJ/s을 발생시켜 충당한다고 보면 된다. 복사열전달을 원활하게 하려면 화염의 온도를 극대화시키는 것이 좋은데 이는 메탄 등 연료주입과 더불어 연료/공기주입비가 중요하다11). 고온가스의 복사열전달은 rotary kiln end 부위의 화염에서 발생되므로 화염의 길이 및 온도분포도 rotary kiln의 온도분포에 중요한 영향을 끼치게 된다. 즉 rotary kiln End 부위의 온도구배를 완화하려면(급격한 온도변화를 방지하려면) 화염에 의한 복사열이 rotary kiln 내부까지 진행되어야 함을 의미한다. 실제 rotary kiln에서는 내부 약 1/3 지점까지 화염이 도달하므로 고온구역이 훨씬 확장되어 있을 것으로 생각된다. 따라서 향후 모델링에서는 연료분사에 따른 화염의 형상을 모델링하는 것도 좋은 방안이라고 생각된다. 또한 Head와 End 부위사이 화염의 끝부분에서 산화발열이 활발하여 온도를 높이고 화염의 최대온도부분에서는 화염의 복사열로 광석 bed 층을 가열시키면 End 부위의 온도를 고르게 하는데 약간의 기여를 할 것이다. 연료와 함께 분사되는 1차 공기 외에도 rotary kiln 중간에 2차 공기를 주입하여 연소산화를 원활하게 하는 방법도 생각해 볼 수 있다17). 추가적으로 화염에 의해 내벽을 가열시킬 경우 달궈진 내벽에 의해서 광석층이 가열될 수 있는데 이 경우 내외벽간의 열손실만큼 열원에서 내벽으로의 열전달이 지속된다. 그리고 rotary kiln 축방향으로의 내벽 온도구배는 화염을 포함한 freeboard의 온도구배에 영향을 받을 것이다. 이 경우 내벽의 온도구배를 완화시키기 위해서는 내외벽간 손실열 최소화 이외에 내외벽간 열전도율이 큰 Lining재를 설치를 통해 rotary kiln 축에 따른 열전도율을 증가시켜 온도구배를 완화시키는 방안도 있을 것이다.
4. 결 론
본 연구에서는 후단에서의 침출공정을 용이하게 하기 위한 바나듐 염배소 전처리에 Rotary kiln를 적용시 kiln내 열화학적 모델링 인자를 논의하였다. 이는 kiln내 열수지, 열전달 및 그에 상응하는 온도분포를 직관적으로 추정하는데 도움을 주는 것이 연구 목적 중 하나이다. 특히 최적 염배소 온도인 1000 °C 근방을 가능하면 kiln내에서 장기간 유지하는 것이 관건이다. 연구 결과, 열원은 탄화수소(천연가스) 연료연소 외에 광석내 자철석의 발열 반응 등이 있으나 염배소시 긴 체류시간(≫1 hr) 및 낮은 kiln내 충진율(< 15%)을 고려하면 발열을 높이기 위해 광석처리량을 크게 증가시키기는 힘들다. 따라서 연료의 연소반응을 조절하는 것이 주된 방안이라고 생각된다. 열전달의 경우 복사열전달이 중요한데 이 경우 직/간접 열원에서의 온도를 높게 유지하는 것이 중요하다. 즉 열원을 고온으로 유지하여 광석 Bed층을 직접 복사가열하거나 내벽을 고온가열시켜 Bed 층을 간접가열시키는 경로를 고려할 수 있다. 전자의 경우 연료/산소주입비 최적화가 중요하고 후자의 경우 내외벽간의 열손실을 최소화하고 내외벽간 Lining을 통해 kiln 축방향으로의 열전도를 다소 원활하게 하면 kiln 축방향으로의 온도구배를 약간 완화시킬 수 있다. 전달된 열은 주로 kiln내 가장 저온인 광석을 가열하는데 소모되는데 이 때 열원의 화염 끝부분에서 광석 또는 첨가제의 산화반응을 유도하여 화염의 최고온부위에서는 산화반응을 종료시켜 온도구배를 일정하게 유지시키는 방안을 고려할 수 있다. 또한 연료주입와 함께 공기주입의 다변화를 도모하는 것도 바람직하다고 판단된다.