1. 서 론
2. 실험 방법
2.1. 재료
2.2. 방법
3. 실험 결과 및 고찰
3.1. 양극 분극 거동에 대한 황산 전해액 농도의 영향
3.2. 정전류 용해 거동
3.3. 황산 전해액내 주석이온의 전해회수 거동
3.4. 전기화학 반응 및 은 농축율에 미치는 염소이온 첨가 효과
3.5. 본 연구에 기초한 폐무연솔더 재활용 제안 공정
4. 결 론
1. 서 론
솔더(solder)는 땜납을 지칭하는 용어로서 주석(Sn)과 납(Pb)으로 이루어진 저융점 합금이며 용도에 따라 주석과 납의 함량이 달라진다. 1980년대까지만 해도 수도관 등의 납땜(soldering)에 납 성분이 포함된 솔더를 사용하였으나 납의 인체 유해성이 밝혀져 주석 함량을 증가시키면서 은(Ag), 구리(Cu), 안티몬(Sb) 등으로 납을 대체하는 솔더가 개발되기 시작하였다1). 그리고 환경규제의 강화와 함께 2000년대 들어서면서 전기·전자제품에 납 성분의 사용을 규제하는 RoHS(Restriction of Hazardrous Substances Directive)와 WEEE(European Union Waste Electrical and Electronic Equipment Directive)2)가 발효됨에 따라 납솔더는 주석이 주성분인 무연솔더로 급속히 대체되기 시작하였다.
무연솔더는 조성 및 용도에 따라 Sn-Ag-Cu 계, Sn-Ag 계, Sn-Cu 계 Sn-Bi 계, Sn-Zn 계, 등이 있는데, 이 중에서 대표적인 것은 전자산업의 조립공정에서 널리 사용되고 있는 Sn-Ag-Cu 합금계로서 SAC 이라고도 부른다3). SAC은 종래의 솔더에 비하여 고가인 주석의 함량이 훨씬 높을 뿐만 아니라 귀금속인 은이 함유되어 있다. 특히 무연솔더의 주성분인 주석의 경우 중국과 더불어 주요 생산국 중의 하나인 인도네시아가 정광의 수출을 금지하는 조치를 취하는 등 광물자원정책의 변화에 따라 주석의 수급이 원활하지 않은 실정이다. 따라서 전기·전자제품의 제조공정에서 발생하는 폐무연솔더 또는 사용 후 전기·전자제품에 함유되어 있는 무연솔더로부터 주석과 은 같은 유가금속을 회수하여 산업원료로 재활용하는 기술의 개발이 고성능 무연솔더의 개발만큼이나 중요하다고 해도 과언이 아닐 것이다.
폐무연솔더로부터 주석을 비롯한 유가금속의 재활용 기술은 크게 건식제련, 습식제련, 전해제련 등으로 대별된다. 건식제련법은 주로 폐무연솔더를 유기용제와 단순 용융한 다음 솔더로 재사용하는 것이다4). 김병수5) 등은 납의 정련에서 은을 제거하는데 이용되고 있는 Parkes법을 응용하여 폐무연솔더로부터 은을 제거하여 회수함과 동시에 주석을 정련하는 공정을 개발하였다. 폐무연솔더를 용융한 후 아연(Zn)을 투입하여 은을 금속간화합물로 제거, 회수함으로써 주석을 정제하는 것이다. 이 방법은 비교적 간단하고 폐수의 발생이 없으며 대규모 조업이 가능하지만 은을 제거하는 효율이 높지 않은 것이 단점이다. 또한 에너지 소모가 많고 구리의 제거가 용이하지 않다.
반면 습식제련법은 질산을 사용하여 폐무연솔더로부터 은과 구리를 침출하거나 염산을 사용하여 주석과 구리를 침출한 뒤 분리함으로서 주석, 은, 구리를 각각 고순도로 회수하는 것이다. 질산을 사용하는 경우 폐무연솔더에 존재하는 주석은 주석산(SnO2·H2O)으로 석출시키는 반면 은과 구리를 침출시키는 것이다6). 류현승7) 등은 질산이 함유된 폐솔더 박리액으로부터 옥살레이트 침전법에 의해 주석산화물 형태의 선택적 회수가 가능함을 보고하였다. 주석산은 탄소환원 또는 수소환원을 거쳐서 금속 주석으로 회수된다. 반면 염산의 경우 산화제로 과산화수소(H2O2)8) 또는 염화제이철(FeCl3)9)를 사용하여 폐무연솔더의 주성분인 주석을 침출한다. 이 때 구리도 함께 침출되지만 은은 염화은(AgCl)로 석출되어 분리, 회수된다. 주석용액에 존재하는 구리는 주석을 사용하는 시멘테이션에 의하여 석출, 회수되며 뒤이어 전해채취에 의하여 고순도 주석이 회수될 수 있다. 그러나 질산과 염산을 사용하는 습식제련공정의 경우 NOx가스 또는 염소 가스의 발생으로 인한 조업환경이 해로울 뿐만 아니라 폐수 발생의 단점이 있다.
한편 전해제련법은 고순도 금속을 직접 회수하는 것이 가능하고 화학약품의 사용과 이로 인한 폐수 발생을 최소화할 수 있는 기술이다. 주석 광석을 건식제련법으로 처리하여 회수한 주석(순도 ~98 %)을 용융하여 조주석양극(crude Sn anode)을 만든 다음 이를 전해정련하여 순도 99.9 % 이상의 고순도 주석을 생산하고 있다10,11,12,13). 주석의 전해정련기술14)은 이미 상용화된 기술로서 산성 또는 알칼리 전해액을 사용하여 낮은 전류밀도에서 행해진다. 일반적으로 산성 전해액은 황산과 황산제일주석(SnSO4)으로 구성되고 알칼리 전해액은 수산화나트륨(NaOH)이나 수산화칼륨 (KOH)과 이들의 아주석산염(Na2SnO2 또는 K2SnO2)으로 구성된다. 알칼리 전해액을 사용할 경우에는 낮은 순도의 조주석양극을 사용할 수 있는 장점이 있지만 산성 전해액에 비해 전기 에너지 소모가 높고 생산성이 낮아 주로 주석 도금철판이나 양철캔으로부터 주석을 제거하는 용도로 사용된다.
이와 같은 이유로 본 연구에서는 국내에서 발생하는 폐무연솔더를 전기화학적 방법으로 재활용하는 공정을 개발하고자 하였다. 현재 상용화되어 있는 주석의 전해정련기술을 이용하여 폐무연솔더의 재활용 공정을 구성하는 것은 큰 어려움 없이 가능하지만 페무연솔더에서 주석의 순도가 종래의 전해정련공정에 사용되는 조주석양극에 비해 약 5 % 정도 낮을 뿐만 아니라 은과 같은 고가의 귀금속을 동시에 회수라기 위해서 개량기술의 개발이 필요하다.
따라서 주요 구성성분이 Sn-Ag-Cu인 폐무연솔더를 용융하여 조주석양극을 제조하고 이를 황산 전해액에서 전해정련하여 고순도 주석과 은을 회수하기 위해 필요한 전기화학적 반응들을 연구하였다. 전해액의 황산 농도가 폐무연솔더 작업전극의 양극 분극 거동(anodic polarization) 에 미치는 영향, 정전류 용해(constant current dissolution) 거동, 용해된 주석의 전해전착(electrodeposition) 거동 등을 조사하였다. 특히 고부가가치 금속인 은의 효율적인 회수를 위하여 작업전극의 전해용해 시 양극슬라임으로 회수되는 은의 농축율과 주석의 전착효율을 동시에 향상시킬 수 있는 방안을 찾고자 하였으며, 이를 위해 전해액내 염소이온 첨가 효과를 조사하였다. 또한 이러한 전기화학적 연구 결과를 바탕으로 폐무연솔더로부터 고순도 주석과 은을 회수하기 위한 전해정련 중심의 재활용 공정을 제안하고자 하였다.
2. 실험 방법
2.1. 재료
본 연구에서는 국내에서 발생하는 폐무연솔더를 실험재료로 사용하였다. 폐무연솔더의 주요성분은 주석, 은, 구리가 각각 93 %, 3.26 %, 0.89 %이었다15). 폐무연솔더의 주성분인 주석과 은은 각각 금속 주석 그리고 Ag3Sn 상으로 존재하였다15). 괴상 형태의 폐무연솔더를 용융, 주조, 압연 과정을 거쳐서 제조한 시편을 전기화학 실험의 작업전극으로, 백금 판을 대전극으로 사용하였다. 그리고 전해액의 제조를 위하여 일본 Junsei Chemical의 시약급 황산과 염산을 사용하였으며 모든 실험에 초순수(18 MΩ․cm 이상)를 사용하였다.
2.2. 방법
2.2.1. 전극 제조
전기화학 실험을 위해 압연과정을 거쳐 1 mm의 스트립으로 만들어진 폐무연솔더 시료는 적절한 크기로 자른 뒤 사포와 1 μM 입도의 알루미나 분말로 표면을 연마하였다. 그리고 알코올에서 초음파 세척 후 에폭시로 마스킹하여 노출면적 4 cm2의 실험용 작업전극을 준비하였다. 대전극은 노출면적 25 cm2의 백금판을 사용하였다. Fig. 1은 본 연구에서 사용된 폐무연솔더 작업전극과 백금 대전극을 나타낸 그림이다.
2.2.2. 전기화학 실험
전기화학 실험은 삼전극 시스템(three-electrode system)을 이용하여 수행하였다. 작업전극, 대전극 및 포화칼로멜전극(saturated calomel electrode)으로 구성된 세 개의 전극들이 장착된 워터자켓이 달린 전해조에 농도가 조절된 황산 용액을 전해액으로 주입하였다. 전해조 외부에 설치된 항온조를 사용하여 전해액의 온도를 조절한 다음 potentiostat(Biologic, VSP, France)로 전기화학 실험을 수행하였다. 전기화학 실험은 일정속도로 작업전극의 전극전위를 높이면서 전류 반응을 측정하는 양극 분극(anodic polarization) 실험과 일정 전류를 인가하고 전극전위를 측정하는 정전류(constant current) 실험을 실시하였다. 정전류 실험 후는 작업전극과 대전극을 회수하여 작업전극의 용해량과 표면에 형성된 양극슬라임(anodic slime), 그리고 대전극에 전착된 주석의 양을 측정하였다. 작업전극은 초순수 초음파 세척을 통해 전극 표면에 형성된 양극슬라임을 제거하고 건조 후 전극의 무게를 측정하여 용해량을 구하였다. 양극슬라임은 초순수로 3회 초음파 세척, 여과 후 80 °C에서 48시간 건조하고 무게를 측정하였다. 양극슬라임의 형상을 관찰하기 위하여 주사전자현미경(SEM, Scanning Electron Microscope, JSM-6400, JEOL)을 이용하였으며 성분 분석에는 부착된 EDS(Energy Dispersive X-ray Spectroscopy)을 이용하였다. 대전극에 전착된 주석은 수작업으로 분리하여 회수하고 초순수 초음파세척을 행한 다음 80 °C에서 48시간 건조하고 무게를 측정, 주석 전착 전류효율을 식 (1)에 따라 구하였다. 전해액내 주석이온은 +2가로 존재한다고 가정하였다.
한편 황산 전해액에 염산을 첨가하여 염소이온의 효과를 측정하는 실험 시 전해액내 염산의 첨가방식은 다음과 같다. 1 molL-1 농도의 황산 용액 용매에 염산을 용질로 첨가하여 일정 농도의 염소이온을 함유한 전해액을 제조하였다.
3. 실험 결과 및 고찰
3.1. 양극 분극 거동에 대한 황산 전해액 농도의 영향
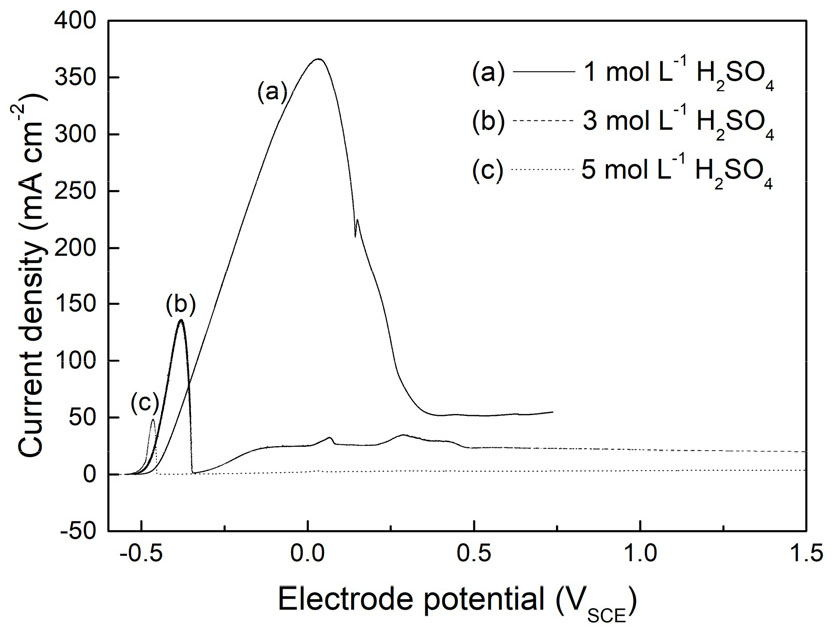
Fig. 2는 전해액의 황산 농도에 따른 작업전극의 분극 거동을 나타낸 것이다. 황산 농도 1 molL-1의 경우 전극전위가 OCP(Open Circuit Potential)인 –0.5 VSCE 부근에서부터 높아짐에 따라 용해가 일어나면서 산화전류가 급격히 증가하기 시작하였다. 전위의 상승에 따라 계속 증가하던 산화전류는 0.03 VSCE에서 365 mAcm-2의 최고치에 도달한 뒤 감소하기 시작하였다. 전극전위가 0.34 VSCE에 도달하였을 때 감소 추세가 멈추었으며, 그 이후 전극전위 상승에 따라 50 mAcm-2의 정도의 산화전류를 유지하며 미세한 증가 추세를 나타내었다.
이러한 산화전류의 감소는 전극용해 시 양극 표면에 생기는 부동태층16)이 전기화학반응을 방해하기 때문이다. 황산 전해액 1 molL-1인 경우 산화전류 피크가 이후 통상의 부동태층이 형성되었을 때보다 다소 높은 산화전류가 지속적으로 관찰되는 것은 본 실험에서 생긴 부동태층이 치밀한 구조보다는 어느 정도 수준의 전기화학반응에 필요한 전해액이 함유될 수 있는 성긴 구조로 생기기 때문으로 생각된다. 그러나 황산 전해액의 농도가 높아짐에 따라 전극용해가 시작되는 전위값이 낮아지고 전극전위 상승에 따른 산화전류의 증가율은 더욱 커지지만 산화전류 피크값과 해당 피크의 전극전위는 낮아졌다. 또한 부동태가 나타나는 전위가 낮아지고 부동태 영역에서 발생하는 산화전류값 역시 급격히 감소한다. 이는 황산 전해액의 농도가 높아짐에 따라 전극용해반응이 보다 활발하게 일어나서 낮은 전극전위에서 시작되고 전류값 증가율도 크지만 낮은 전극전위에서부터 치밀한 표면 부동태층이 형성되면서 곧바로 전극 용해반응이 차단되기 때문으로 생각된다. 이러한 실험결과는 폐무연솔더의 전기화학적 용해를 위해서는 전해액으로서 기능을 발휘하기에는 충분하고 부동태층 형성이 주는 영향은 최소한으로 적은 1 molL-1 황산 전해액 농도가 적절함을 의미한다.
3.2. 정전류 용해 거동
Fig. 3은 양극 분극 결과에 따라 전해액으로 1 molL-1 H2SO4 용액을 선택하여 상온 정전류 용해 시 인가전류밀도가 증가함에 따른 작업전극의 전극전위 변화를 나타낸 것이다.
전류밀도가 10 mAcm-2에서 100 mAcm-2로 증가함에 따라 정전류 용해 시 전극전위가 비교적 일정하게 유지되는 시간이 짧아지면서 전위값이 높아졌다. 높은 전위값은 전류밀도가 높아짐에 따른 과전압에 의한 것이다. 용해반응이 진행됨에 따라 전극전위가 서서히 증가하는 것은 작업전극 표면에서 생성되고 점차로 두꺼워지는 부동태층인 양극슬라임에 의해 전기화학적 용해반응이 저해되기 때문이다. 특히 Fig. 3의 (c)와 (d)에서 짧은 시간 내에 전극전위가 수직으로 급격히 높아지며 실험이 중단되는 것은 점차로 두꺼워진 양극슬라임 내에서 해당 전류밀도 조건에서 전기화학반응에 필요한 이온의 이동현상이 완전히 차단되기 때문으로 생각된다. 위의 결과로부터 전극전위의 상승을 최소화하면서 지속적인 정전류 용해가 가능한 전류밀도 조건은 10 mAcm-2임을 알 수 있었다.
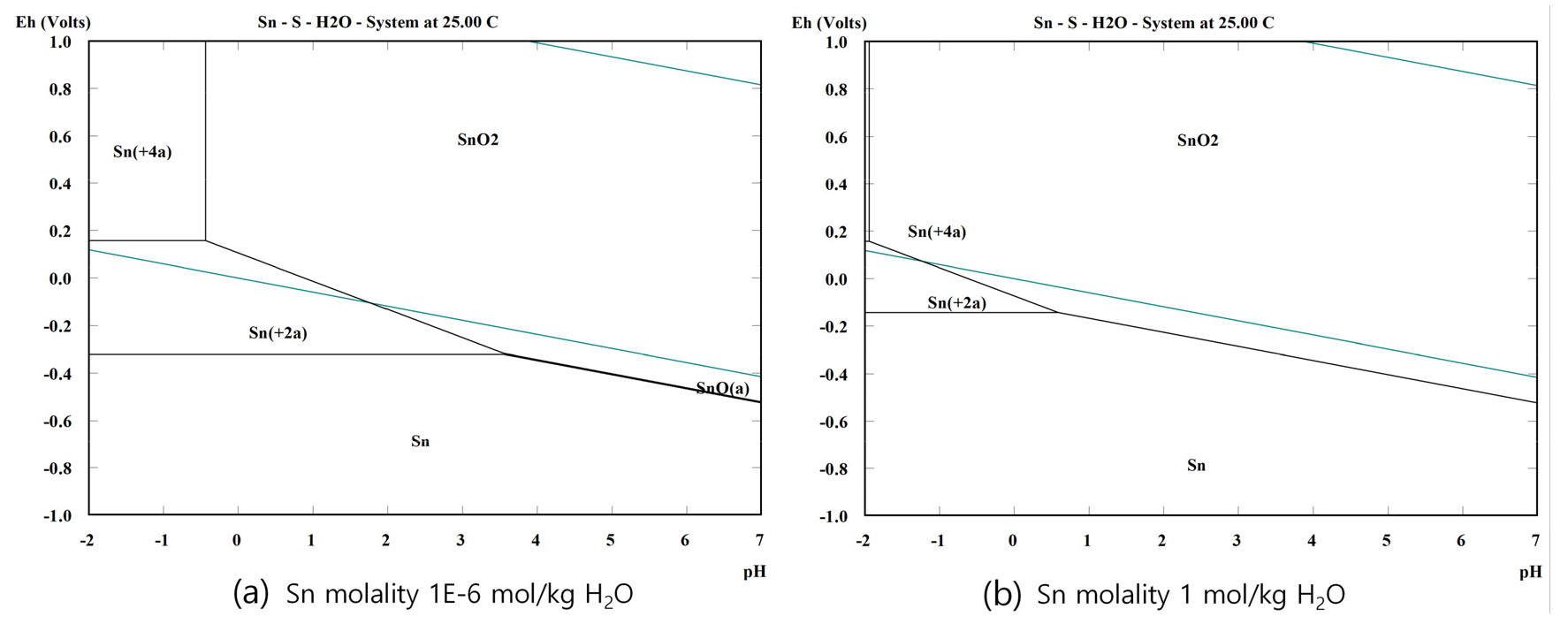
Fig. 4는 HSC로 작성한 주석의 Eh-pH 도이다. 용액의 pH가 0 부근의 주석과 은이 전기화학적 산화반응에 의해 용해되는 표준전극전위는 각각 -0.136 VSHE, 0.799 VSHE이다17). 표준전극전위의 차이가 0.935 V로 크기 때문에 주석과 은을 함유하고 있는 폐무연솔더를 전해용해할 경우 주석이 은보다 우선적으로 용해된다. 이는 정전류 용해 시 인가전류의 조절을 통해 전극전위가 적절한 값으로 유지된다면 주석만 용해되고 은은 양극슬라임내 잔사로 남겨두는 선택적 용해가 가능함을 의미한다. 그러나 Fig. 4 (a), (b)의 Eh-pH 도에서 보는 바와 같이 주석의 경우 pH가 낮은 산성 영역에서도 전해액내 주석이온의 농도가 높아지게 되면 전극전위가 높아짐에 따라 산화주석 (SnO2)으로 산화된다. 즉, 용액의 pH가 0인 산성용액에서 주석이온의 농도가 10-6 molkg-1를 초과하여 계속 높아지면 산화물이 생성되는 전극전위가 0.1 VSHE 이하로 낮아지고 이에 따라 인가전류가 커질수록 과전압의 증가에 의한 전극전위의 상승으로 전극 표면에서 부동태화 현상이 발생할 가능성이 커진다. 부동태층이 생성되면 이의 성장에 의해 두꺼운 주석산화물 층으로 이루어진 양극슬라임 생성이 동반된다. 따라서 폐무연솔더에 함유된 은은 높은 표준전극전위로 인해 전해용해 시 전해액으로 용해되지 않고 전극표면에서 생성되는 양극슬라임에 포집, 농축될 가능성이 높다.
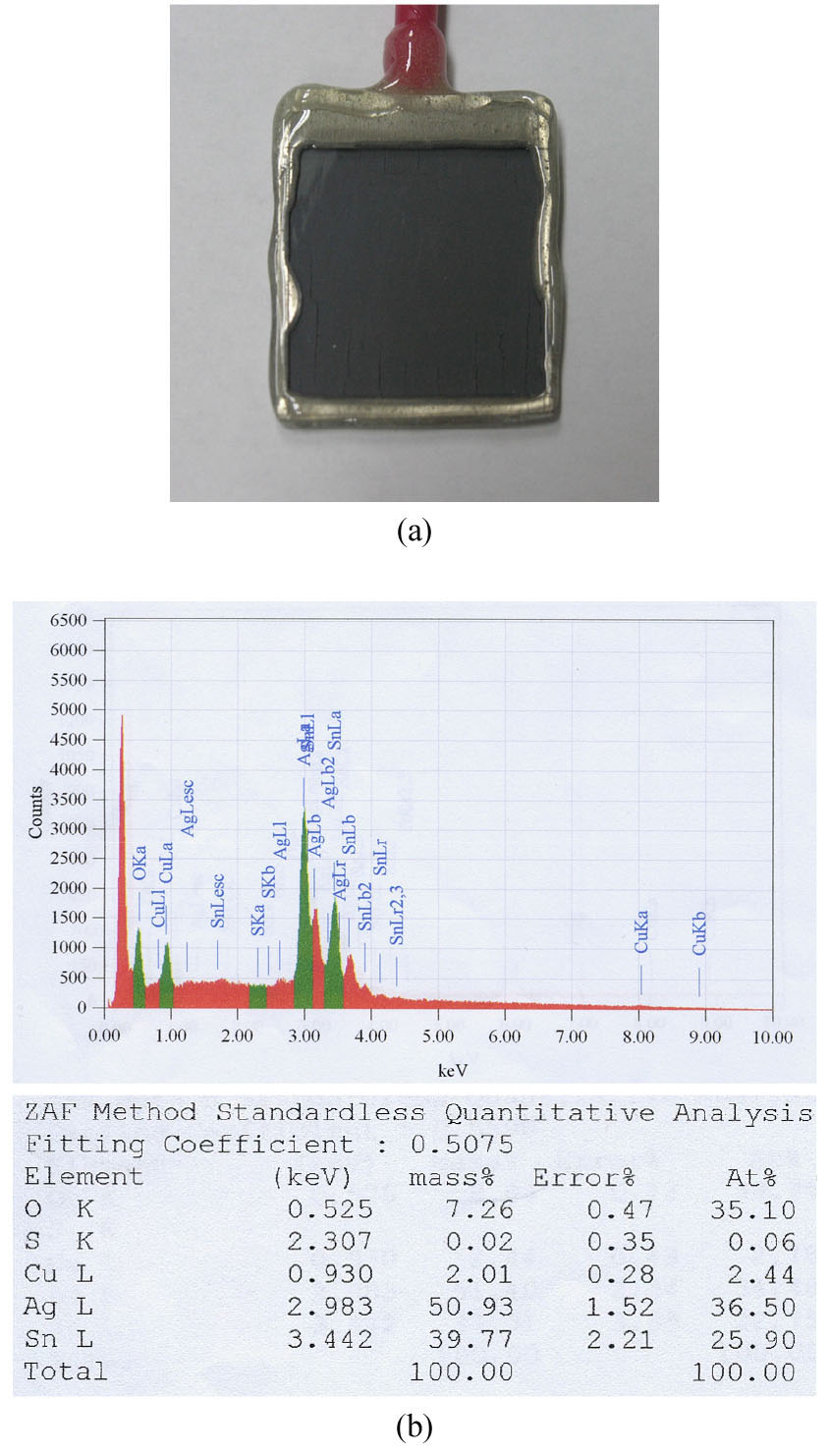
이상의 실험결과와 Eh-pH 도의 고찰로부터 양극슬라임의 주된 성분은 은과 주석산화물로 예상할 수 있다. Fig. 5는 1 molL-1 황산 전해액, 10 mAcm-2 인가전류밀도, 25 °C의 전해용해 조건에서 25 시간동안 폐무연솔더 전극을 용해한 후 회수된 양극슬라임과 이의 EDS 분석결과를 나타낸 것이다. 이때 양극의 용해량은 2.4064 g이었으며, 회수된 양극슬라임의 무게는 0.1558 g이었다.
Fig. 5(a)에서 보는 바와 같이 전해용해 후 작업전극은 흑갈색의 양극슬라임이 표면을 덮고 있었다. 그리고 Fig. 5(b)에 나타낸 EDS 분석결과로부터 양극슬라임은 은 50.9 wt.%, 주석 39.8 wt.%, 산소 7.3 wt.%, 구리 2.0 wt.%, 그리고 황(S) 0.02 wt.%로 구성되어 있음을 알 수 있다. 미량의 황이 검출된 것은 세척 후 잔존한 전해액 황산이온 성분에서 유래한 것으로 생각된다. 은이 양극슬라임의 주성분이라는 실험결과는 폐무연솔더 전극의 전해용해를 통하여 주석을 용해하면서 은은 양극슬라임에 선택적으로 농축시켜 회수할 수 있음을 의미한다.
Fig. 6은 Fig. 3 (a)를 자세히 나타낸 것이다. 전류인가 시 전극전위는 -0.432 VSCE에서 시작하여 전극표면의 양극슬라임 층이 생성되고 두꺼워짐에 따라 서서히 지속적으로 높아졌으며, 25시간 경과 시 -0.413 VSCE에 도달하였다. 25시간동안 전극전위는 19 mV 높아졌으며, 대략 시간당 평균 0.7 mV씩 상승하였다. Fig. 4 (a)의 Eh-pH 도에서 보는바와 같이 전해액내 주석이온 농도 1 molL-1인 경우 pH 0에서 전극전위가 높아짐에 따라 –0.1 VSHE 이상에서는 주석은 주석이온으로 전해액에 용해되는 구간을 지나 산화주석으로 산화된다. 전해용해 시 생성되는 양극슬라임 층이 전기화학반응 유지를 위한 충분한 전해액을 함유하고 이온이 이동할 수 있는 채널을 확보하고 있더라도 주된 반응이 주석이 주석이온으로 용해되는 반응에서 산화주석으로 산화되는 시점에 도달하면 치밀한 산화주석이 전극표면을 덮으면서 전해반응은 중단될 것이다. 이는 전해용해반응을 최대한 오래 유지하기 위해서는 이러한 전극전위 상승을 효과적으로 억제해야함을 의미한다.
Fig. 7은 40 °C, 1 molL-1 황산 전해액에서 10 mAcm-2 정전류 인가에 의한 폐무연솔더 전극의 전해용해 시 생성된 양극슬라임의 주사전자현미경 관찰 사진이다. 양극슬라임은 긴 봉상의 큰 입자 (A)와 둥글고 작은 입자들 (B, C)로 이루어져 있다. 이 입자들의 화학조성을 알아보기 위하여 EDS 분석을 행하였으며 그 결과는 Table 1에 나타내었다. 긴 봉상의 A 입자는 주석과 구리가 주성분으로 은이 3 % 미만으로 함유되어 있다. 반면, 작고 둥근 B와 C 입자들은 은 함량이 60 % 이상으로 주성분이었으며 주석은 각각 약 32 %, 27 %, 그리고 구리는 각각 4 %, 2 % 정도 함유되어 있다. 이와 같은 결과는 폐무연솔더 전극의 전해용해 시 양극슬라임에서 형성 시 A는 억제하고 C가 주된 생성물이 되도록 전해조건을 조절한다면 양극슬라임에서 주석 함유량은 최소화 하면서 은의 농축은 최대화 할 수 있는 가능성을 시사하는 것이다.
Table 1.
The result of EDS analysis of the points in Fig. 7
| Element | A | B | C |
| Ag (mass%) | 2.91 | 62.77 | 70.41 |
| Sn (mass%) | 59.98 | 32.23 | 27.02 |
| Cu (mass%) | 37.43 | 4.04 | 2.11 |
| O (mass%) | 0.05 | 0.96 | 0.46 |
| S (mass%) | - | - | - |
3.3. 황산 전해액내 주석이온의 전해회수 거동
전해용해 시 폐무연솔더 작업전극의 주석은 양극슬라임으로 분배되는 것을 제외한 대부분이 주석이온으로 전해액에 용해된다. 이러한 주석이온은 대전극인 백금판에서 동시에 환원반응에 의해 금속주석으로 회수된다. 인가전류밀도가 주석의 회수거동에 미치는 영향을 조사하기 위하여 25 °C, 1 molL-1 황산 전해액에서 인가 전류밀도를 10~50 mAcm-2로 변화시키면서 폐무연솔더 작업전극으로부터 주석을 전해용해하고 대전극인 백금판에 전착시켜 회수하는 실험을 행하였다. Fig. 8은 인가전류밀도가 10 mAcm-2 일 때 전착된 금속주석의 모습이다. 전착된 주석은 대전극의 아래 면에 집중되어 수지상결정(dendrite) 형태로 성장하였으며, 이는 작업전극과 거리가 가까울 경우 전기적 단락을 유발하는 원인이 될 수 있다. 본 논문에서 논하지는 않았지만 전해액의 온도가 높아질 경우 덴드라이트가 좀 더 짧고 굵어지는 양상을 나타내었으나 이의 성장을 막을 수는 없었다.
Table 2는 인가전류밀도 변화에 따라 대전극에 전착되어 회수된 주석의 양과 전류효율을 나타낸 것이다. 표에 나타낸 인가전류밀도에서 괄호안의 수치는 작업전극에 비해 6배 이상 큰 25 cm2인 백금 대전극을 기준으로 계산된 값이다. 전극전위의 급격한 상승으로 실험이 중단된 50 mAcm-2의 조건을 제외하곤 동일한 인가전하량을 가진다. 본 연구에서는 황산 전해액 제조 시 주석을 첨가하지 않았으므로 폐무연솔더 작업전극으로부터 전해용해되는 주석만이 전착 주석의 공급원이 된다. 표에서 보는 바와 같이 인가전류밀도가 높아짐에 따라 전착전류효율은 점차 낮아졌으며, 10 mAcm-2의 일 때 85.7 %의 전착 전류효율이 얻어졌다.
Table 2.
Current density vs. current efficiency of Sn electrodeposition
|
Current density (mAcm-2) |
Deposit time (hr) |
Deposit amount (g) |
Current efficiency (%) |
| 10 (1.6) | 25 | 1.8982 | 85.7 |
| 25 ( 4 ) | 10 | 1.8722 | 84.5 |
| 50 ( 8 ) | 3.16 | 0.9447 | 67.5 |
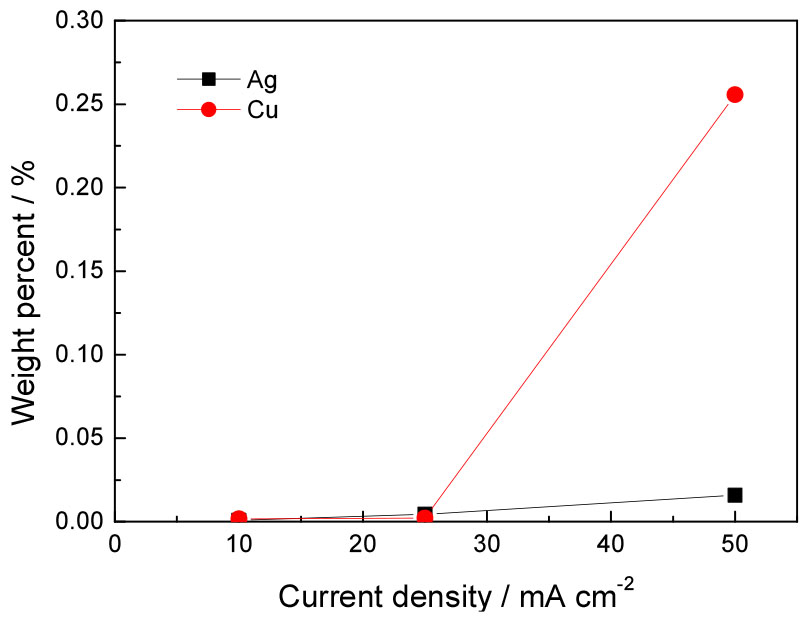
Fig. 9는 Table 2의 인가전류밀도 변화에 따른 대전극의 전착 주석내 은과 구리 함량 변화를 나타낸 것이다. 그림에서 보는 바와 같이 인가전류밀도 25 mAcm-2 이하에서는 전착된 주석에서 은과 구리의 함량이 0.004 % 이하로 미미하였으나, 인가전류밀도 50 mAcm-2에서 은과 구리의 함량은 각각 0.015 %, 0.25 %로 증가하였다. 특히 은에 비해 구리가 두드러지게 급증하였으며 이는 구리가 은보다 표준전극전위가 0.459 V 낮기 때문에 인가전류밀도가 일정 범위 이상으로 상승하면 작업전극 과전압의 증가에 더 큰 영향을 받음을 의미한다. 인가전류밀도가 높아짐에 따라 전착된 주석 내의 은과 구리 함량은 증가하였으며, 특히 구리의 경우 높은 전류밀도에서는 급격히 증가하는 경향을 나타내었다. 이러한 결과는 전해용해에 의해 양극슬라임에 은을 농축, 포집하고 동시에 고순도 주석을 회수하기 위해서는 인가전류밀도를 낮춰야함을 의미한다.
3.4. 전기화학 반응 및 은 농축율에 미치는 염소이온 첨가 효과
전해용해 시 양극슬라임의 은 농축률을 높이기 위해서는 Figs. 5와 7에서 보는 바와 같이 양극슬라임 구성 원소 중 주석의 함량이 상대적으로 낮아져야 한다. 이를 위해서는 폐무연솔더 전극의 주석이 산화주석으로 양극슬라임에 남는 것보다 주석이온으로 전해액에 최대한 용해되도록 하는 것이 중요하다. 앞의 논의에서 전해용해반응의 지속성 유지와 높은 전류효율 확보를 위해서는 인가전류밀도는 10 mAcm-2 정도로 낮아야함을 확인하였다.
주석의 전해용해 과정에서 전극전위가 상승하여 부동태화 영역에 도달하면 주석의 용해는 다음과 같은 과정을 거쳐서 일어나는 것으로 보고된 바 있다18).
전해액으로 황산 용액을 사용하는 경우 황산 농도가 높아지면 주석산화물과 bisulphate(HSO4-) 이온 간에 형성된 표면착물 안정화에 의해 전체 부동태화 전류가 작아진다. 표면 부동태층의 용해는 식 (3), (4)에서 보는 바와 같이 산화주석의 용해는 H+와 HSO4- 이온의 농도에 의해 결정된다. 그러나 전해액의 황산 농도를 전기화학반응을 위해 필요한 범위 밖으로 조절하는 것은 화학물질의 과대사용이나 폐액의 발생 등으로 인해 바람직하지 않다. 본 연구에서는 전해액의 황산 농도 조절 없이 염소이온 첨가를 통해 이 문제를 해결하고자 하였다.
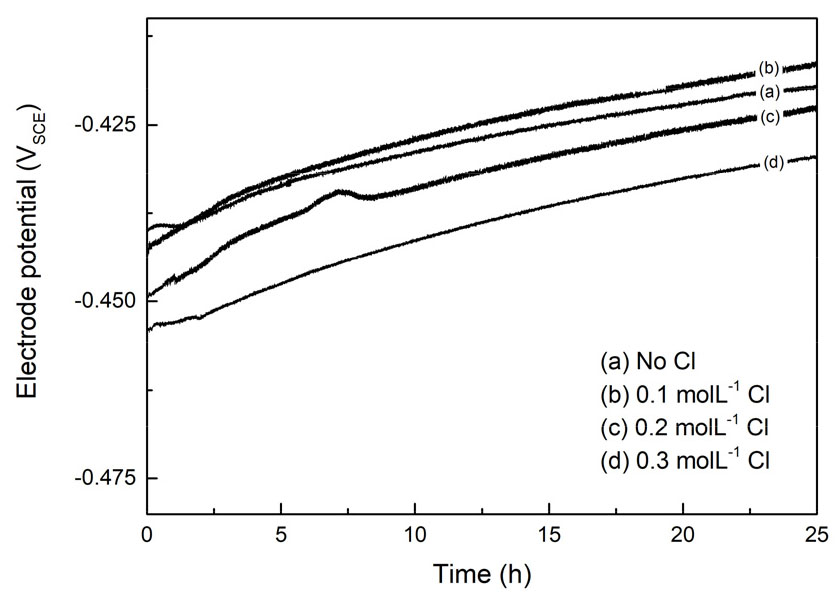
Fig. 10은 40 °C의 1 molL-1 황산 전해액에서 인가전류밀도 10 mAcm-2 조건에서 전해용해 시 염소이온의 첨가가 작업전극의 전극전위 변화에 미치는 영향을 나타낸 것이다. 전해액에 염소이온을 첨가한 경우에도 양극슬라임의 생성에 따라 전극전위가 서서히 높아지는 양상은 Fig. 6에 나타낸 상온에서의 결과와 유사하였다. 전해액에 첨가한 염소이온의 농도가 0.1 molL-1(Fig. 10 (b)) 일 때는 전극전위가 약간 높아지는 것이 관찰되었으나 염소이온 첨가량이 0.2 molL-1(Fig. 10 (c)), 0.3 molL-1(Fig. 10 (d))로 증가함에 따라 전극전위는 다시 낮아졌다. 그림에서 보는 바와 같이 황산 전해액에 0.3 molL-1의 염소이온이 첨가되었을 때의 전극전위는 첨가되지 않았을 때보다 약 10 mV 정도 낮았다. 이것은 주로 염소이온 첨가에 의해 전해액의 이온전도도가 향상되었거나 양극슬라임의 생성이 억제되었기 때문으로 생각된다. 만약 염소이온의 첨가가 전극전위의 상승률에 영향을 주는 양극슬라임의 물성을 변화시켰다면 시간에 따른 전극전위의 상승률이 상이해졌을 것이나 본 실험결과에서는 그러한 현상은 관찰되지 않았다.
Johnson19) 등은 염산 용액에서 주석의 전해용해 거동은 황산에서와 상이하며, 이것은 주석과 염소이온과의 착물 형성에 기인하는 것으로 다음과 같은 용해반응을 제안하였다.
pH< 1 의 염산 용액에서는 부동태 현상이 일어나지 않는데 이는 황산 용액에서와 같은 산화주석 대신 위의 식에 의해 생성된 주석과 염소이온의 착물이 이온형태로 전해액에 용해되기 때문으로 설명하였다.
Table 3은 Fig. 10의 실험에서 얻어진 작업전극 용해량, 대전극의 주석 전착량, 생성된 양극슬라임량, 그리고 전착전류효율의 변화를 나타낸 것이다. 염소이온의 농도가 0.2 molL-1 이하일 때 전착전류효율이나 양극슬라임량의 변화가 뚜렷하지 않지만 염소이온이 0.3 molL-1로 증가하였을 때 염소이온 효과가 뚜렷하게 나타나 전류효율이 92.2 %로 증가하였으며 주석의 전착량이 무첨가에 비해 8.9 % 정도 증가하였다. 이때 양극슬라임의 생성량도 1.5 % 정도 감소하였다. 이와 같은 현상은 Johnson17) 등에 의해 제안된 주석과 염소이온의 착물 형성에 의한 주석산화물의 제거로 설명가능하다.
Table 3.
Experimental results of Sn electrodeposition in Fig. 10
Fig. 11은 Fig. 10의 실험에서 얻어진 양극슬라임으로 농축되는 은의 비율을 염소이온 농도에 따라 나타낸 것이다. 은의 농축율은 용해된 폐무연솔더 작업전극에 존재하는 은이 양극슬라임으로 손실 없이 완전히 이동하였을 때를 100 %로 하였다. 그림에서 보는 바와 같이 전해액에 첨가되는 염소이온의 농도가 증가함에 따라 은의 농축율도 조금씩 증가하였다. 염소이온이 첨가되지 않은 황산 전해액에서 전해용해를 실시하였을 때 81.6 %의 은이 양극 슬라임으로 농축되었으며 전해액에 0.3 molL-1의 염소이온이 첨가되었을 은의 농축율은 94.3 %로 증가하였다. 이는 염소이온을 첨가함에 따라 양극슬라임의 생성량 감소와 염소이온에 의한 염화은(AgCl) 침전물의 석출이라는 두 가지 효과 때문으로 생각된다. 10 mAcm-2의 조건에서 전해용해 시 은이 양극슬라임으로 농축되는 양은 동일하다고 가정하면 염소이온 첨가에 의해 산화주석으로 양극슬라임을 형성하는 대신 주석과 염소이온의 착물로 전해액으로 용해되면 결과적으로 양극슬라임의 생성량이 감소하게 된다. Table 3에서 염소이온 무첨가와 0.3 molL-1의 염소이온 첨가 폐무연솔더 작업전극 용해량의 차이는 0.12 %로 미미하나 양극슬라임의 생성량은 무첨가 대비 0.3 molL-1의 염소이온 첨가 시 1.43 % 낮아지는 결과가 이를 반증한다.
황산 전해액에 염소이온이 첨가되었을 때 전해액의 변화를 육안으로 관찰하여 Fig. 12에 나타내었다. 그림에서 보는 바와 같이 염소이온이 첨가되지 않은 경우 전해용해 시 전해액에서 주석이온의 농도가 높아짐에 따라 콜로이드 입자들의 생성이 관찰되었다. 이것은 황산 전해액에서 폐무연솔더 작업전극의 전해용해를 진행함에 따라 용해된 주석이온들이 불안정해지고 주석산화물로 침전되기 때문이다. 그러나 염소이온이 첨가된 황산 전해액에서 전해용해를 진행하였을 때에는 반응식 (7)에서 나타낸 것과 유사하게 용해된 주석이온과 염소이온이 착물을 형성하여 주석이온이 안정한 이온으로 존재하는 것으로 생각된다. 이에 따라 Fig. 12의 왼쪽 사진처럼 전해용해 종료 후에도 침전물이 없는 투명한 전해액을 유지하는 것으로 보여진다. 이는 전해용해 시 공정 안정성을 위해 중요한 사항이다.
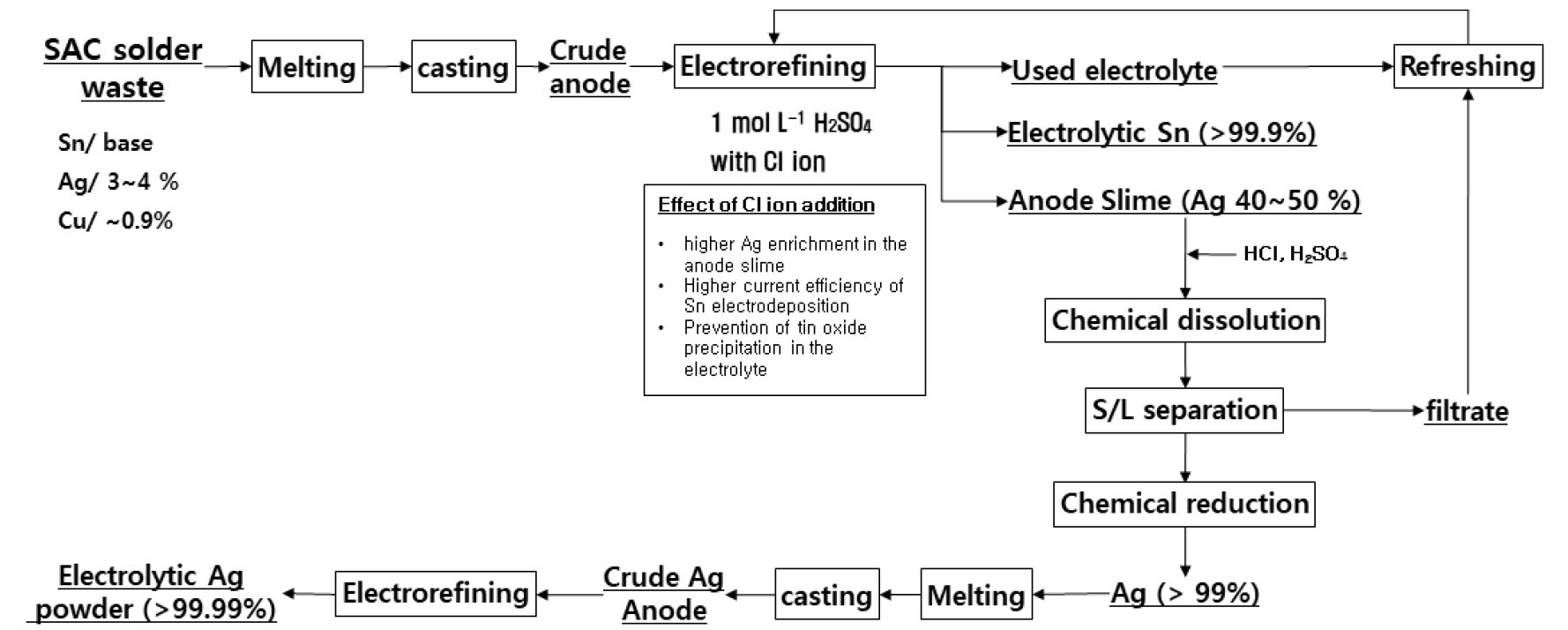
3.5. 본 연구에 기초한 폐무연솔더 재활용 제안 공정
이상의 폐무연솔더를 사용한 전해정련공정의 전기화학적 반응 연구로부터 Fig. 13과 같이 개량된 전해정련기술을 이용하는 고순도 주석과 은의 회수 재활용 공정을 제안하였다. 폐무연솔더는 용융, 주조를 통해 폐무연솔더 조양극을 만들고 염소이온이 첨가된 황산 전해액에서 전해정련을 실시한다. 염소이온은 양극슬라임에의 은 농축율과 주석의 음극전착효율, 그리고 전해액 안정성 향상을 위해 필요하다. 이때 얻어진 양극슬라임은 전해액 조성과 동일한 산을 사용하여 주석 성분을 용해하고 잔사로 남은 은은 고액분리로 회수한다. 이때 양극슬라임에 포함될 수 있는 소량의 금속구리를 용해하기 위해 산화제로 공기를 공급할 수도 있다. 회수된 은은 용융, 주조를 거쳐 조은양극으로 만들고 질산은 전해액에서 전해정련을 통해 고순도 은 분말을 제조한다. 한편 양극슬라임 용해, 고액분리 후 얻어진 주석이온이 함유된 여액은 폐전해액과 함께 전해액 재생공정으로 보내어 순환사용한다.
4. 결 론
본 연구에서는 전기화학적인 방법으로 폐무연솔더로부터 은과 주석을 회수하기 위한 방법을 고찰하였다. 황산 전해액을 사용한 폐무연솔더 작업전극의 전해용해 시 전극표면에 생성되는 양극슬라임 층은 은을 포집하는 중요한 역할을 하지만 전기화학반응에 대한 저항으로 작용해 인가전류밀도를 높이는데 한계가 있었다. 전해액 황산농도 1 molL-1, 온도 40 °C, 인가전류밀도 10 mAcm-2 조건에서 양극슬라임의 은 농축율은 81.6 %, 대전극의 주석 전착전류효율은 84.7 %이었다. 폐무연솔더내 은을 효과적으로 양극슬라임에 농축하고 주석의 전착전류효율을 높이기 위해서는 양극슬라임의 적절한 생성량을 제어를 통해 양극슬라임내 은의 상대적 함량을 높이고 전해액내 주석이온의 농도를 높이는 방법이 필요하였다. 이를 위해 주석과 용해성 착물을 생성하는 것으로 보고된 염소이온을 황산 전해액에 첨가하고 그 영향을 조사하였다. 전해액 황산농도 1 molL-1, 온도 40 °C, 인가전류밀도 10 mAcm-2 조건에서 전해용해 시 전해액에 염소이온이 0.3 molL-1 농도로 첨가되면 전반적인 전극전위의 저하와 함께 염소이온 무첨가에 비하여 양극슬라임내 은의 농축율이 12.7 % 높아졌다. 또한 전해액내 주석이온의 안정성도 높아지면서 주석의 전착전류효율도 향상되었다. 이와 같이 부식성이 낮은 황산 전해액에 소량의 염소이온 첨가를 통해 전해용해 시 양극슬라임내 은의 농축율을 높이는 동시에 전해액내로 용해된 주석이온의 안정성 향상시켜 전착전류효율을 높이는 다양한 긍정적인 결과를 얻을 수 있었다. 이러한 전해액내 염소이온 첨가를 통한 개량된 전해정련기술을 중심으로 폐무연솔더의 재활용 기술을 새로이 제안하였다.