1. 서 론
우리나라에서 석탄 폐석은 약 2억 톤 가량이 적치되어 있으며, 연간 70만 톤이 발생하고 있다고 보고되고 있다1). 이로 인해 석탄광의 주변 환경오염뿐만 아니라 이를 관리하기 위해 막대한 국가 예산이 소요되고 있다. 이러한 사회적 환경 부담을 줄이기 위해 석탄 폐석의 재활용을 위한 산업 원료화 연구가 요구되고 있다.
과거 석탄 폐석의 대량 처리를 위한 연구로 토목·건설 산업의 원료화 연구가 진행되었다2,3,4). 대표적인 연구로 선탄 폐석의 1종 포틀랜트 시멘트 원료화 연구가 있다5,6,7). 이러한 노력으로 현재 국내에서는 일부 석탄 폐석을 1종 포틀랜트 시멘트의 부원료로 사용하고 있다. 그러나 국내 시멘트 생산량이 크게 감소하면서 석탄 폐석의 사용량 역시 감소하고 있다. 따라서 석탄 폐석의 안정적인 재활용을 위해서는 다양한 산업에서의 원료화가 필요하다. 최근 석탄 폐석의 높은 SiO2와 Al2O3 함량을 이용하여 유리 소재나 건축 내장재 등의 고온 세라믹 소재 원료화 연구가 주목받고 있다8). 본 연구에서는 선탄 폐석을 고온 세라믹 중 유리 원료로 활용하기 위해 고온 소성에 따른 상변화 및 Na2CO3의 첨가에 따른 유리질(비정질)화 특성에 대해 고찰하였다.
2. 실험 방법
본 실험에 사용된 선탄 폐석은 태백 K 광업소의 선탄 공정에서 발생되는 것을 사용하였다.
Table 1은 본 실험에 사용된 선탄 폐석의 화학 성분을 나타내고 있다. 화학성분 분석 결과 SiO2와 Al2O3가 91 wt.% 이상 차지하고 있는 것으로 나타났다.
Table 1.
Chemical composition of coal tailing
| Element | SiO2 | Al2O3 | Fe2O3 | CaO | MgO | K2O | Na2O | P2O5 |
| wt.% | 60.18 | 30.88 | 2.96 | 0.12 | 0.26 | 4.41 | 1.10 | 0.11 |
Table 2는 선탄 폐석의 공업분석 결과이다. 분석 결과, 회분 65.99 wt.%와 휘발분 7.0 wt.%, 고정 탄소 24.3 wt.%가 함유되어 있으며, 2,170 kcal/kg의 발열량을 보였다.
Table 2.
Proximate analysis of coal tailing
| Moisture mass (%) | Volatile Mass (%) | Ash (wt.%) | Fixed carbon (%) | cal/g |
| 2.66 | 7.05 | 65.99 | 24.30 | 2,170 |
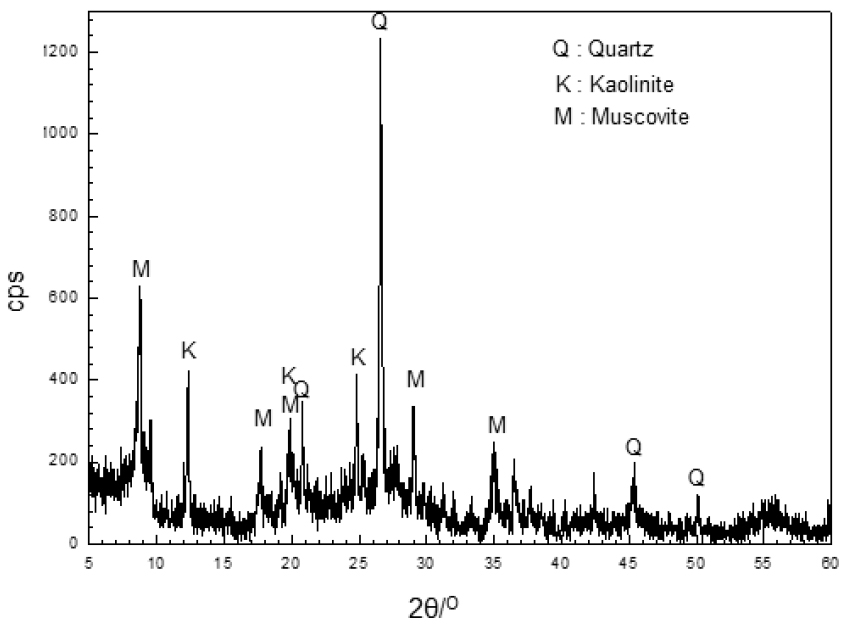
Fig. 1은 본 실험에 사용된 선탄 폐석의 X-선 회절 곡선을 나타내고 있다. 주요 구성 광물로는 α-quartz와 알루미나 실리케이트 광물인 kaolinite와 muscovite로 나타났다.
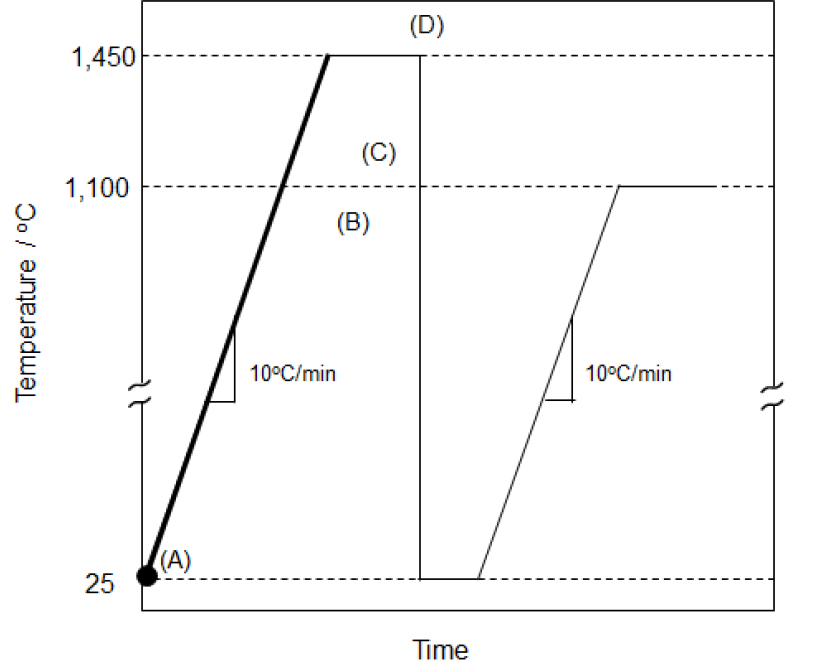
본 실험에서 고온 소성을 위해 선탄 폐석을 200 mesh (74 μm) 이하로 분쇄한 후 알코올을 이용하여 지름 5 cm의 구형체로 성형한 후 전기로에서 소성하였다. Fig. 2는 선탄폐석의 소성 스케줄을 나타내고 있다. 승온 속도는 분당 10 ℃로 하였으며 800 ℃(Fig. 2(B), 1,100 ℃(Fig. 2(C), 1,450 ℃(Fig. 2(D)에서 각각 2시간씩 소성한 후 전기로에서 꺼내어 물에서 급냉하였다. 이렇게 얻어진 선탄 폐석의 소결체를 대상으로 상 전위 거동을 파악하였다. 각각의 소성 온도에서 소성된 선탄 폐석의 구성 광물의 정량 및 정성 분석을 위해 정량 X-선 회절 분석을 실시하였다. 정량 X-선 회절분석은 D8 Advance(Bruker, Germany) 장비를 사용하였다. 스텝 스캔(step scan)방식으로 회절 패턴을 획득하였으며 0.01 °/step의 속도로 스텝 당 1 s 동안 스캔하였다. 분석에 사용한 슬릿의 사이즈는 0.3°(divergence slit)와 2.5°(secondary Soller slit)였다. 광물의 정량분석은 Rietveld법에 기반 한 프로그램인 TOPAS 4.2 (Bruker, Germany)를 사용하였다. 이와 함께 선탄 폐석의 열분해 특성을 관찰하기 위해 시차열열중량측정(TG-DTA)을 실시하였다. 이때 승온 속도는 10 ℃/min로 하였으며, 분위기 가스로는 일반 공기를 사용하였다.
본 실험에서는 선탄 폐석의 유리질화를 위해 소성 첨가제로 Na2CO3를 첨가하였다. Na2CO3는 SiO2-Al2O3계 광물의 고온 반응성을 증진하는데 매우 효과적이라고 보고되고 있다9). Na2CO3는 선탄 폐석의 성구체를 제조하는 과정에 첨가하였으며, 선탄 폐석의 무게 대비 0.5, 1, 1.5, 2 wt.%를 첨가였다. 또한 이렇게 얻어진 소결체를 재분쇄한 후 1,100 ℃에서 2차 소결을 통해 재결정화 과정을 확인하였다(Fig. 2(E)). 이는 Na2O-Al2O3-SiO2의 3성분계에서 1,000 ℃ 이상에서 nepheline의 생성되는 것으로 알려져 있기 때문이다10). 2차 소결은 1,450 ℃에서 1차 소결된 소결체를 1차 소결 때와 같이 조건으로 분쇄와 성형 후 전기로에서 소성하였다. 이러한 과정을 통해 선탄 폐석의 유리질화를 위한 최적의 Na2CO3의 첨가량을 결정하였다.
3. 실험 및 고찰
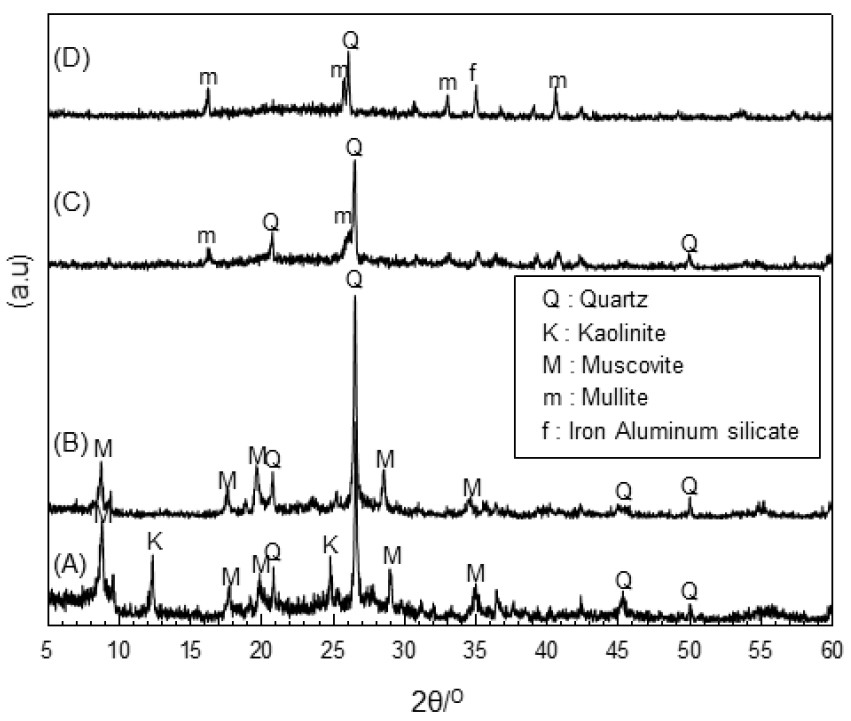
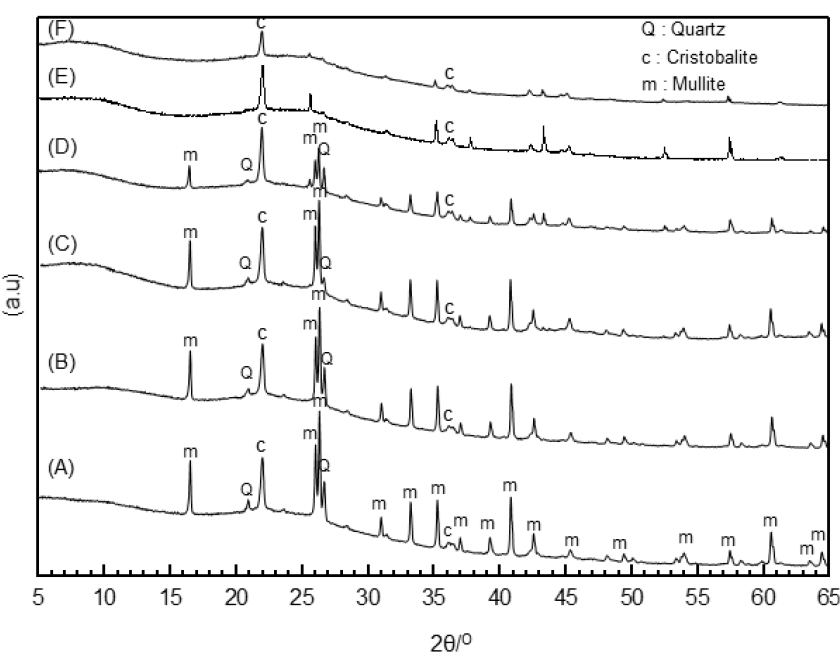
Fig. 3은 각 소성 온도에서 소결된 선탄 폐석의 X-선 회절 곡선을 나타내고 있다. XRD 분석 결과, 800 ℃ 영역에서 kaolinite가 분해되었으며, 소성온도가 1,100 ℃ 이상의 온도에는 mullite와 quartz만이 존재하였다.
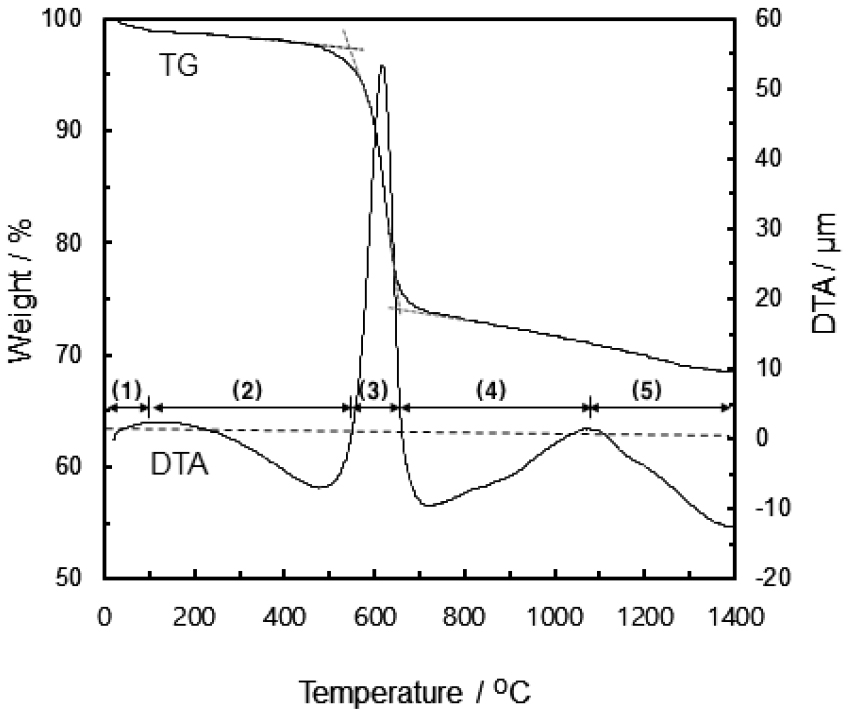
Fig. 4는 1,450 ℃까지 선탄 폐석의 열분해 특성을 나타내는 TG-DTA 곡선이다. 분석 결과, 100 ℃에서 중량 감소가 있었으며, 이후 500 ℃까지 추가적인 중량 감소와 발열이 관찰되었다. 우선 100 ℃의 중량 감소는 선탄 폐석에 흡착된 자유수의 증발에 의한 것으로 판단되며, 500 ℃까지의 중량 감소와 발열 반응은 선탄 폐석에 함유되어 있는 휘발물질이 연소 휘발되면서 나타난 것으로 판단된다. 이후 500 ℃~700 ℃에서 관찰되는 급격한 중량 감소와 흡열 반응은 XRD 분석 결과를 통해 kaolinite의 분해에 의한 것으로 판단된다. 이후 1,100℃까지의 지속적인 중량 감소 및 흡열 반응은 mullite의 생성에 따른 것으로 판단된다. mullite의 SiO2/Al2O3의 비는 0.33로 여분의 SiO2는 quartz의 고온상인 cristobalite로 존재하는 것으로 판단된다.
각각의 소성 온도에서 얻어진 선탄 폐석의 XRD 분석 결과를 통해 TG-DTA 곡선에서의 1,450 ℃까지의 선탄 폐석의 결정상 변화를 다음과 같이 예측할 수 있다.
(1) 25 ~ 100 ℃ : 표면 흡착수(자유수) 증발
(2) 100 ~ 500 ℃ : 휘발 물질 연소
(3) 500 ~ 700 ℃ : kaolinte 분해
(4) 700 ~ 1,100 ℃ : mullite 생성Al2O3·SiO2·nH2O→2Al2O3·3SiO2+SiO2+mH2O
(5) >1,100 ℃ : mullite, quartz의 일부 유리질화2SiO2 + 3Al2O3 → 2Al2O3·3SiO2SiO2 → non-crystalline
위의 실험 결과를 통해 선탄 폐석의 경우, 고온에서 mullite와 quartz가 주요 결정 광물로 생성되며, 이로 인해 완전한 비정질화가 어렵다는 것을 알 수 있다.
본 실험에서는 선탄 폐석을 유리질화시키기 위해 Na2CO3 첨가하였다. Fig. 5는 각기 다른 량의 Na2CO3 첨가된 선탄 폐석을 1,450 ℃에서 소성한 소결체의 X-선 회절 곡선을 나타내고 있다. 분석 결과, Na2CO3 첨가량이 증가함에 따라 선탄 폐석의 유리질화가 증가하는 것으로 나타났으며, 특히 2θ값 15~30 부근의 quartz와 mullite의 X-선 회절 피크가 감소하는 것을 확인할 수 있었다.
Table 3은 Fig. 5의 X-선 회절 곡선을 정량 분석한 결과를 나타내고 있다. 분석 결과, 1,450 ℃에서 Na2CO3 첨가량이 증가됨에 따라 quartz와 mullite은 감소하고 대신에 비정질의 생성량이 증가하는 것으로 나타났다. 특히, Na2CO3 첨가량이 10 wt.% 이상에서 선탄 폐석의 비정질화가 97.9 wt.% 진행된 것으로 나타났다.
Table 3.
The results of mineralogical quantitative analysis for coal gangue sintered with the different amount of added Na2CO3 at 1,450 ℃ (unit: wt.%)
Fig. 6은 Na2CO3 10 wt.% 첨가된 1,450 ℃ 소결체의 미세구조를 나타낸 전자현미경으로 관찰한 사진다. Fig. 5에서 확인한 봐와 같이 10 wt.%의 Na2CO3가 첨가된 소결체의 표면이 치밀한 것으로 보아 유리화가 진행된 것으로 판단된다. 이를 통해 Na2CO3 첨가가 선탄 폐석의 유리질화 반응을 촉진시키는 것으로 나타났다. 그러나 quartz 고온 상인 cristobalite의 완전한 유리하는 이루어지지는 않았다. 이에 대한 추가적 연구가 요구된다.
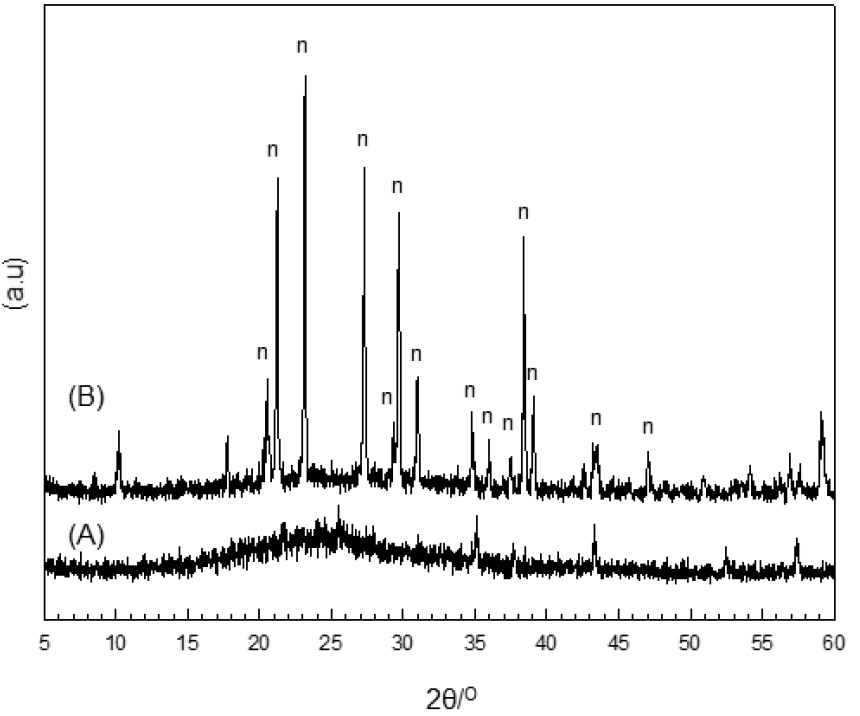
Na2CO3의 첨가로 얻어진 유리질 소결체의 안정성 확인을 위한 상온에서 분쇄 후 1,100 ℃에서 2차 소결을 실시하였다. Fig. 7은 2차 소결체의 X-선 회절 곡선을 나타내고 있다. 실험 결과, Na2CO3가 10 wt% 첨가된 선탄 폐석의 유리화는 재소결에도 안정적으로 유지하였으나, Na2CO3가 20 wt.% 첨가된 선탄 폐석의 시료의 경우, n-nepheline (Na2O·Al2O3·2SiO2)이 생성되었다.
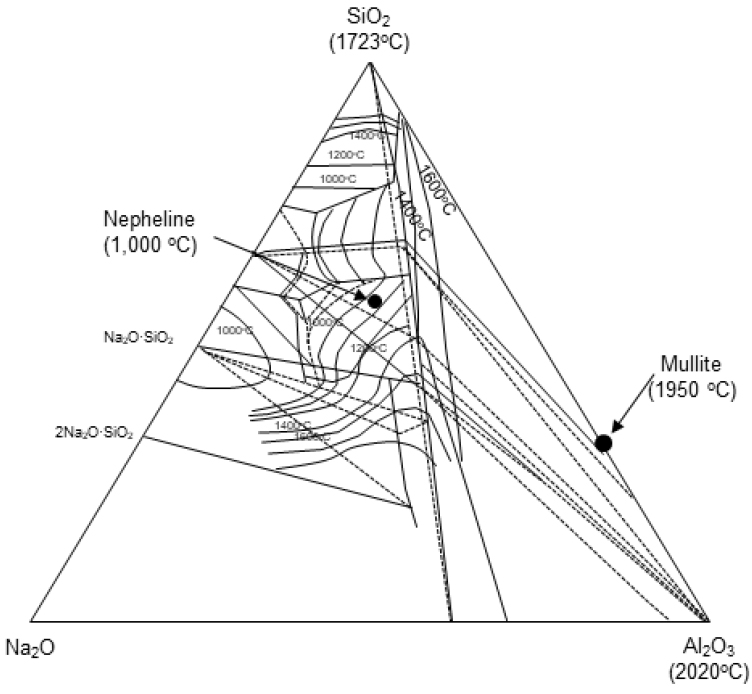
Fig. 8은 Si2O-Al2O3-Na2O의 3성분계를 나타내고 있다. 과량의 Na2CO3의 첨가된 선탄 폐석의 유리상은 재소성 과정에서 nepheline가 생성되는 것을 알 수 있으며, 이로 인해 유리상의 안정성을 저해할 수 있다는 것으로 판단된다. 실험 결과를 종합해 볼 때, 본 실험 조건에서 선탄 폐석의 유리화 원료화를 위한 Na2CO3의 최적 첨가량은 10 wt.%인 것으로 확인되었다.
4. 결 론
본 실험에서는 태백 K 광업소의 선탄 공정에서 발생되는 선탄 폐석을 사용하여 유리 소재 원료화를 위한 선탄폐석의 고온 상 전위 거동 및 Na2CO3의 첨가에 따른 유리질(비정질)화 실험을 실시하였다.
연구 결과, 선탄 폐석의 높은 SiO2와 Al2O3 함량으로 1,450 ℃에서 고온 상의 mullite와 cristobalite가 생성되는 것으로 나타났다. 그러나 Na2CO3 첨가량이 증가됨에 따라 선탄 폐석은 고온에서 유리화가 일어났다. 그러나 유리상의 재소성 실험에서 Na2CO3가 20 wt.% 첨가된 선탄폐석의 시료의 경우, nepheline이 생성되었다. 즉 과량의 Na2CO3의 첨가는 선탄 폐석의 유리상의 고온 안정성을 저해하는 것으로 나타났다. 본 실험에서는 10 wt.% Na2CO3의 첨가된 선탄 폐석을 1,450℃에서 소성한 결과 97.9 wt.%의 유리화가 이루어졌으며, 재소결 과정에서도 유리상의 안정성이 가장 좋은 것으로 나타났다.