1. 서 론
2. 실험재료 및 실험방법
3. 결과 및 고찰
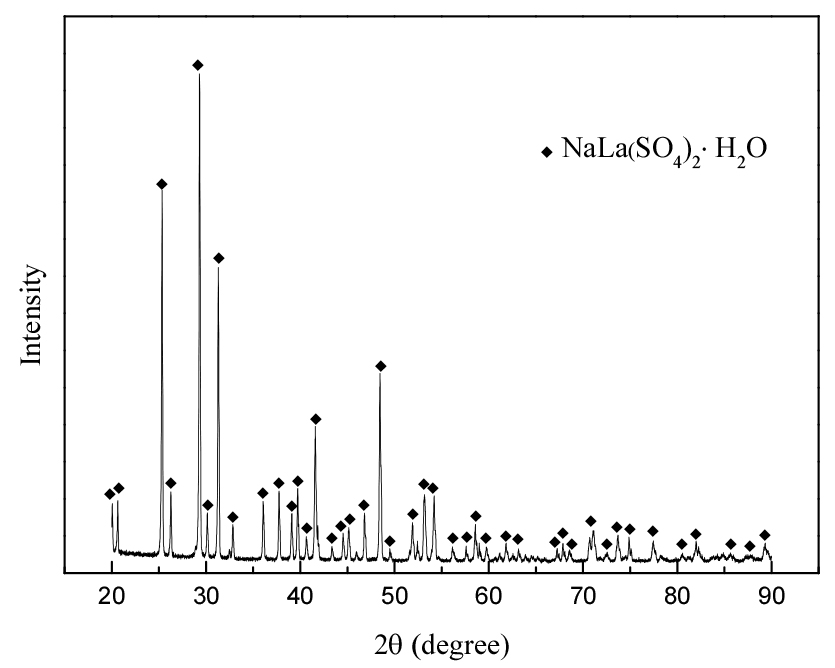
3.1. 침전물의 X선 특성 분석
3.2. Na+ 및 SO42- 농도의 영향
3.3. H2SO4 농도의 영향
3.4. 란타넘(III) 농도의 영향
3.5. 반응온도 및 반응시간의 영향
3.6. 철 농도의 영향
4. 결 론
1. 서 론
Bayer공정에서 보크사이트를 진한 가성소다용액으로 침출시 발생하는 잔사는 대부분이 산화철로 구성되어 있으며, 붉은색을 띄기 때문에 레드머드라 한다. 레드머드는 철 이외에 알루미늄, 타이타늄, 규소, 알칼리 산화물과 함께 미량의 희토류를 포함하고 있다. 평균적으로 보크사이트에서 1톤의 알루미나 생산시 발생하는 레드머드는 1톤에서 1.5톤정도이다. 현재 세계에서 발생하는 1억 5천만톤의 레드머드 중 약 3%에 해당하는 4백만톤만이 재활용되고 있다1). 과거 레드머드는 대부분 강이나 호수, 광산에 매립하는 방식으로 처리해왔으나 강한 알칼리성분을 함유하고 있어 수질과 토양에 심각한 환경오염을 초래한다2,3). 따라서 최근에는 레드머드를 중화처리한 다음 여기서 회수한 가성소다를 Bayer 공정에 재사용하고, 수분 함유량이 높은 레드머드를 건조시킴으로써 부피를 최대한 줄여 야적하는 추세이다4,5,6). 레드머드를 재활용하기 위한 연구는 오랫동안 진행되어 왔지만 처리비용 문제로 인해 경제성이 떨어져 실제 산업에 적용된 사례는 매우 드물다. 특히 매립지가 부족하고 환경규제가 엄격한 국내사정을 감안하면 레드머드를 야적시켜 처리하는 것은 지속하기 어렵다. 레드머드는 스칸듐, 이트륨, 란타늄, 세륨 등과 같이 경희토류 원소를 포함하고 있는데, 국내에서 발생되는 레드머드는 국제 평균보다 적은 양의 희토류를 포함하고 있다7). 따라서 레드머드에서 희토류를 효율적이고 경제적으로 회수하기 위한 연구가 필요하다.
희토류와 비희토류 성분이 혼합된 용액에서 희토류 원소를 분리하기 위한 연구는 꾸준히 진행되었다. 비희토류 성분과 희토류를 분리하기 위한 일반적인 방법으로 용매 추출, 이온 교환, 희토류 복염 침전법 등이 있다8,9,10). 특히 화학적 성질이 매우 유사한 희토류 성분의 분리를 위해 용매추출과 이온교환에 의한 연구결과가 많이 발표되었다11,12,13). 희토류 복염침전법은 비희토류 성분이 혼합된 용액에 침전제를 첨가해 반응시키는 단순한 공정을 통해 희토류를 선택적으로 분리할 수 있다는 장점이 있다. 따라서 희토류 복염 침전을 통해 희토류 성분만을 분리한 다음, 용매추출이나 이온교환 등을 통해 희토류 성분을 분리하면 고순도의 희토류 회수가 가능하다. 희토류 황산염 수용액에 황산나트륨을 첨가하면 희토류 이온이 황산염과 반응해 희토류 복염을 형성함으로써 침전되어 비희토류 성분과 분리가 가능하다14). 따라서 침전법은 희토류 광석이나 폐NdFeB, NiMH 자석과 같은 2차자원에서 희토류의 선택적인 분리에 이용되고 있다15,16,17,18). 또한 Na2SO4에 의한 복염 침전시 경희토류의 복염 용해도가 중희토류보다 작아 침전이 용이하므로 레드머드에 함유된 경희토류의 분리에 효과적이다19). 황산용액에서 희토류 복염의 침전 반응을 다음 식에 나타냈다.
여기서 Me2SO4는 침전제로 Me는 Na, K 및 NH4가 될 수 있다. 또한 x, y 및 z는 침전조건에 의존하는데 복염 농도가 낮은 경우 x, y, z의 값은 각각 1, 1, 2이다14).
본 논문에서는 레드머드에서 희토류를 분리 및 회수하기 위한 기초연구로 레드머드의 주성분인 철(III)과 경희토류인 란타넘(III)을 용해시킨 황산용액을 제조해 두 금속의 분리 가능성에 대해 조사했다. 일반적으로 레드머드에서 철은 4.52~50.6%로 농도가 높은 반면 란타넘족은 0.1~1%에 불과하다1). 이를 실험에 그대로 적용할 경우 상대적으로 높은 철성분으로 인해 수회 희석이 필요하며, 이로 인해 란타넘 분석시 오차가 발생할 수 있다. 따라서 철이 풍부한 조건을 유지하면서 분석의 오차를 줄이기 위해 합성용액에서 철(III)과 란타넘(III) 농도를 각각 0.5, 0.1 g/L으로 설정했다. 침전제로는 희토류에 대해 선택성이 우수한 황산나트륨을 선택했다20). 이러한 목적을 위해 희토류 복염 침전반응에 대해 나트륨 대 란타넘(III)의 몰비와 황산, 란타넘(III), 철(III)의 농도 및 반응온도, 반응시간이 미치는 영향에 대해 조사했다.
2. 실험재료 및 실험방법
철(III)과 란타넘(III)이 혼합된 합성용액은 2차 증류수에 H2SO4(Daejung Co., 95%)를 희석한 다음 시약급 Fe2(SO4)3∙nH2O(Kanto Chemical, Co., Inc., 60~80%)와 LaCl3(Alfa Aesar, 99.9%)를 용해시켜 제조했다. 또한 희토류 복염의 석출 반응을 위한 침전제로 Na2SO4(Daejung Co., 99%)를 사용했다.
침전 실험은 핫플레이트에 30 mL 합성용액이 담긴 100 mL 용량의 3구 비이커형 반응조를 올려놓고, 온도를 조절한 다음 200 rpm 속도로 교반해 수행했다. 이 때 수분의 증발로 인한 부피 변화를 방지하기 위해 비이커형 반응조의 상부 및 하부의 접합부위에 고진공 그리스를 발랐다. 합성용액이 설정한 온도에 도달하면, 황산나트륨을 첨가해 반응시킨 다음 여과지로 침전물과 여액을 분리했다. 침전물을 2% 황산나트륨 용액으로 세척한 다음 60°C 오븐에서 24시간 건조시켰다14,17). 건조된 침전물의 결정상은 XRD(Bruker AXS, Karlsruhe, Germany)로 분석했다. 또한 여액에 남아있는 금속농도는 ICP-OES(Arcos, Spectro, Germany)로 측정했으며, 침전반응에 의한 금속의 침전률은 다음 식으로 구했다.
여기서 mi과 me는 각각 침전 전후 용액에서 금속의 질량을 나타낸다.
3. 결과 및 고찰
3.1. 침전물의 X선 특성 분석
0.1 M 황산용액에 1 g/L 철(III)과 0.5 g/L 란타넘(III)을 용해시켜 제조한 합성용액에 0.35 M의 황산나트륨(5 wt% Na2SO4)을 첨가해 80°C에서 3시간 반응시켜 합성된 침전물을 XRD로 측정했다. 그 결과를 Fig. 1에 나타냈는데, 이는 란타넘(III) 복염 수화물(NaLa(SO4)2H2O)의 X선 회절 패턴과 일치했다.
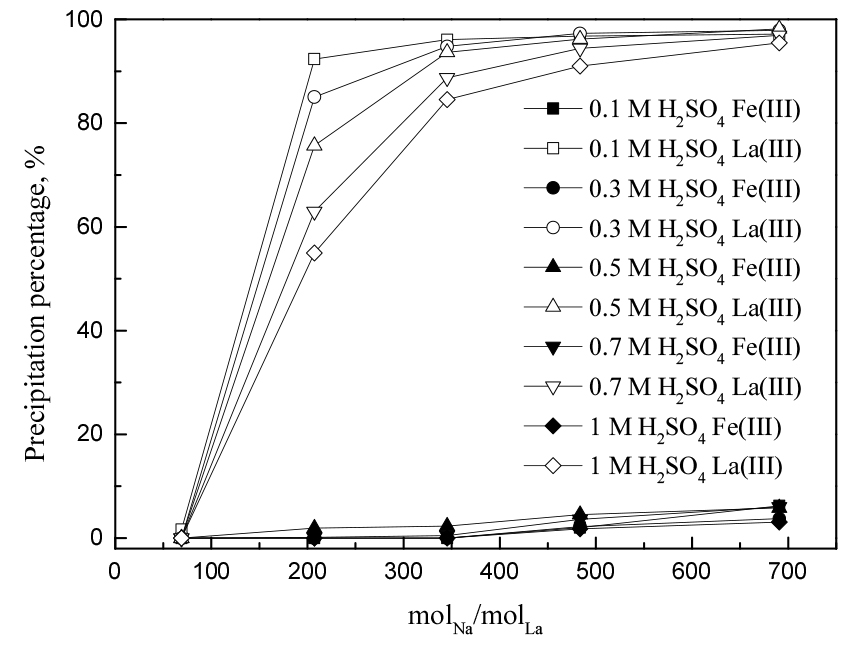
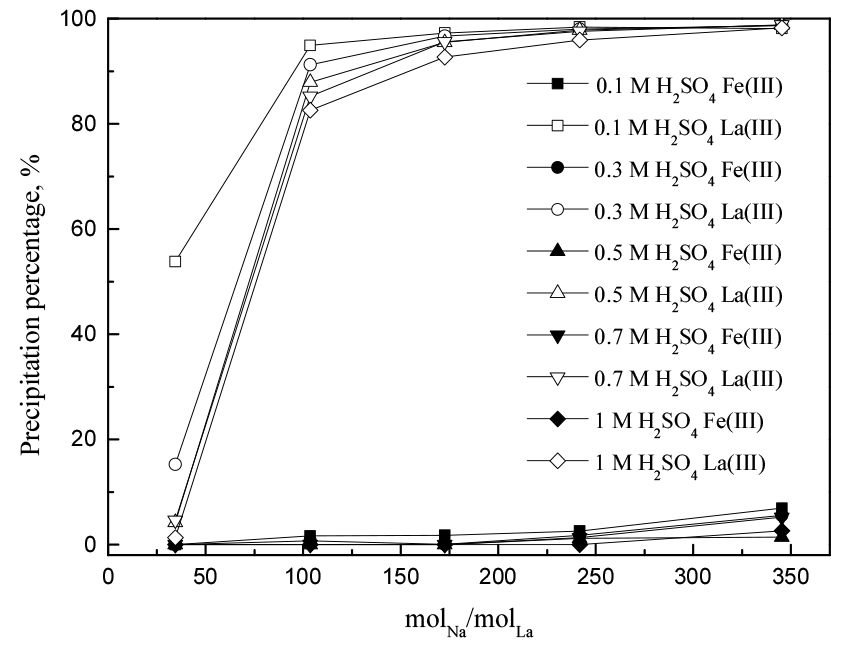
3.2. Na+ 및 SO42- 농도의 영향
Na+와 SO42-는 희토류 복염 형성을 위해 반드시 필요한 이온이다. 본 연구에서 Na+는 오직 황산나트륨으로부터 제공되고, SO42- 이온은 황산나트륨과 황산에서 제공될 수 있다. 일반적으로 용액내 두 이온의 농도가 증가하면 식 (1)에서 희토류 복염 형성 반응을 촉진시킨다21). 따라서 황산나트륨이 복염 침전에 미치는 영향을 알아보기 위해 황산나트륨의 농도를 1에서 10 wt%, 황산농도는 0.1에서 1 M까지 변화시켰다. 이때 철(III) 농도는 1 g/L, 란타넘(III) 농도를 각각 0.5와 1 g/L, 반응온도 80°C, 반응시간을 1시간으로 고정했다. 황산나트륨의 첨가량을 나트륨 대 란타넘의 몰비로 환산해 실험결과를 Fig. 2(0.5 g/L La(III))와 3(1 g/L La(III))에 나타냈다. 란타넘(III) 농도가 0.5 g/L일 때, 철(III)의 침전률은 몰비가 증가함에 따라 약간 증가했으나 최대 10% 미만에 그쳤고, 란타넘(III)의 경우 나트륨농도와 비례해 증가했으며 최대 95%의 침전률을 달성했다. 이러한 경향은 란타넘(III) 농도가 1 g/L일 때에도 유사했으며, 란타넘(III) 농도가 0.5 g/L일 때보다 란타넘(III)의 침전률이 약간 높았다. 란타넘(III) 농도에 대해서는 3.4절에서 더 자세하게 논의할 것이다.
여기서 주의할 점은 황산나트륨을 첨가하면 Na+ 뿐만 아니라 SO42- 이온의 농도 역시 증가한다는 점이다. 란타넘(III)은 황산용액에서 La3+, LaSO4+, La(SO4)2-로 존재할 수 있는데, 이는 용액 내 SO42- 이온 농도의 영향을 받는다. 황산란타넘 이온의 형성반응과 착물형성상수를 식 (3)과 (4)에 나타냈다22).
또한, 황산란타넘 이온의 형태에 따른 복염 침전반응을 비교하기 위해 각각의 침전반응을 식 (5)와 (6)에 나타냈다21).
황산용액에서 란타넘이온이 La3+보다 LaSO4+ 및 La(SO4)2-으로 존재시 황산란타넘 복염의 침전반응이 용이하다. 식 (6)의 평형상수가 식 (5)의 평형상수보다 휠씬 크므로 황산 및 황산나트륨 농도에 따른 나트륨 및 란타넘의 농도분포에 대한 자료의 확보가 필요하다. 특히, 용액내 SO42-이온 농도의 증가는 LaSO4+ 및 La(SO4)2-이온의 분포를 증가시킨다23). 이는 황산나트륨 첨가량이 증가함에 따라 란타넘 복염 침전률이 증가하는 실험결과와 잘 일치한다. 그러나 황산나트륨을 7 wt% 이상으로 첨가하면, 철(III)의 침전률도 함께 증가하므로 희토류 복염의 순도를 떨어뜨린다. 따라서 희토류 복염의 순도를 높이고, 두 금속의 분리성을 향상시키기 위해서는 황산나트륨을 5 wt% 이하로 첨가하는 것이 바람직하다.
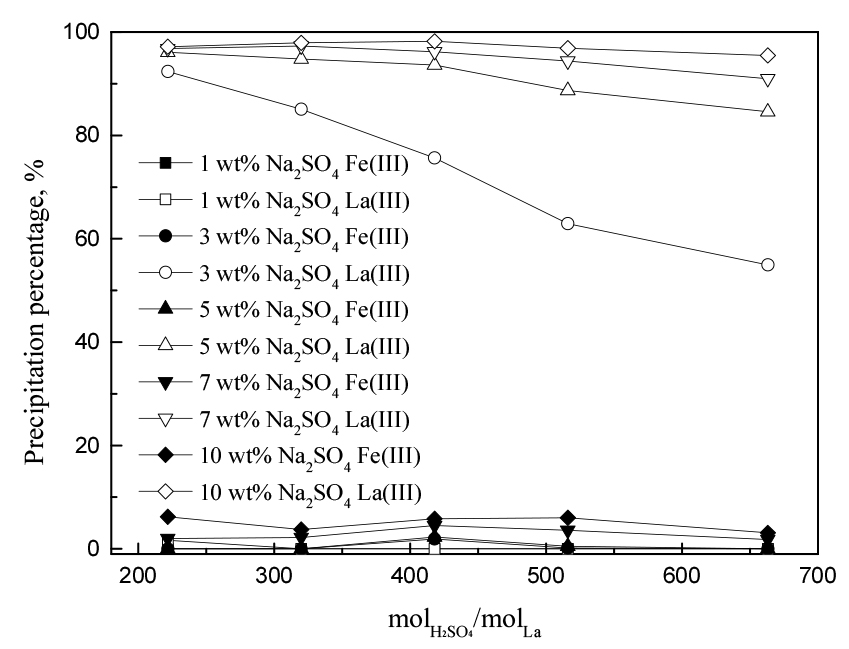
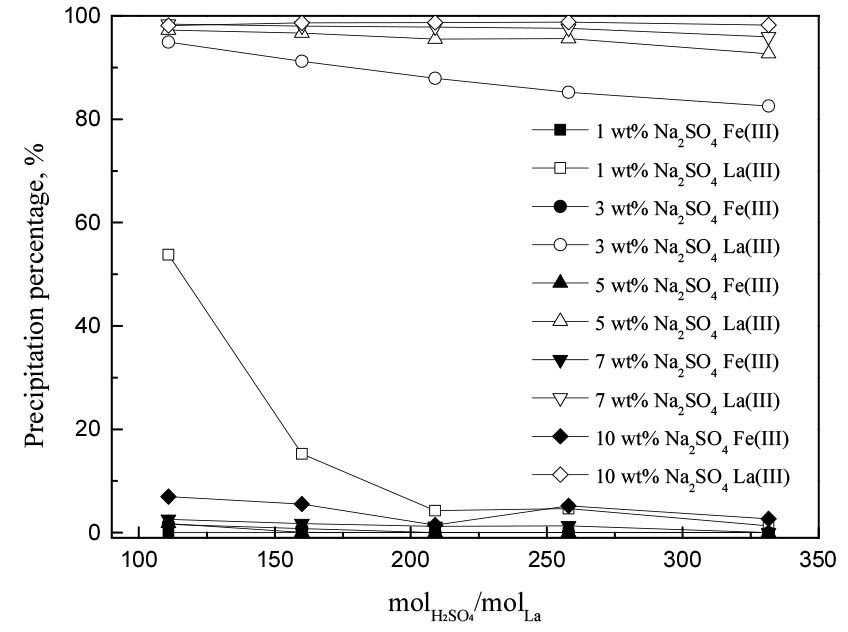
3.3. H2SO4 농도의 영향
금속의 침전반응에 황산이 미치는 영향을 알아보기 위해 Figs. 2, 3의 실험결과를 황산농도 대 란타넘의 몰비로 환산해 Figs. 4(0.5 g/L La(III))와 5(1 g/L La(III))에 나타냈다. 3.2.절에서 SO42- 이온 농도가 증가하면 란타넘(III)의 침전률이 증가한다는 것을 확인했다. 그러나 황산이 황산나트륨과 비교해 더 많은 SO42- 이온을 제공함에도 불구하고, 산농도가 증가함에 따라 란타넘(III)의 침전률이 감소했다. 이러한 경향은 황산나트륨을 3 wt% 미만으로 첨가하거나 란타넘(III) 농도가 낮을수록 두드러졌다. 이는 황산이 SO42- 이온을 제공할 뿐만 아니라 용액의 pH를 감소시키기 때문이다. 용액 중 pH의 감소는 H+ 이온 농도가 증가한다는 것을 의미하며, 이는 H+ + SO42- = HSO4- 반응을 통해 HSO4-가 형성됨으로써 식 (3), (4)의 반응을 어렵게하므로 복염의 침전률이 감소할 수 있다. 반면, 황산의 농도 변화는 철(III)의 침전률에 유의미한 영향을 끼치지 않았다. 본 연구에서 철(III)의 침전률은 황산보다 황산나트륨 농도에 크게 의존한다는 것을 알 수 있다. 따라서 적절한 황산농도를 유지하는 것이 란타넘(III) 침전에 필요하므로 후속실험에서는 황산농도를 0.1 M로 유지했다.
3.4. 란타넘(III) 농도의 영향
0.1 M의 황산용액에서 란타넘(III)의 농도를 0.1에서 1 g/L까지 변화시켜 침전에 미치는 영향을 조사했다. 이 때 황산나트륨의 농도를 5 wt%, 반응온도는 80°C로 고정해 1시간 동안 교반했다. 실험결과 란타넘(III) 농도를 몰수로 변환해 Fig. 6에 나타냈다. 동일한 양의 황산나트륨을 첨가했을 때 란타넘(III) 농도가 0.1 g/L인 경우, 란타넘(III)의 침전률은 20% 미만이었고, 란타넘(III) 농도가 증가함에 따라 란타넘(III)의 침전률은 급격히 증가했다. Na+와 SO42- 이온과 더불어 란타넘(III) 농도의 증가는 식 (1)의 침전반응을 촉진시키는 것으로 생각된다.
Figs. 2, 3에서와 같이 황산나트륨 첨가량이 동일함에도 불구하고 란타넘(III)의 농도가 높을수록 란타넘(III) 복염의 침전률이 높았다. 이는 희토류 농도가 너무 낮은 경우 과량의 황산나트륨이 필요하다는 것을 의미하며, 침전에 의한 분리가 비효율적이라고 생각할 수 있다. 따라서 희토류 복염을 침전시키기 위해서는 희토류의 농도를 일정 값 이상으로 농축하는 과정이 필요할 수 있다.
3.5. 반응온도 및 반응시간의 영향
희토류 복염 침전에 미치는 반응온도와 반응시간의 영향을 알아보기 위해 황산 0.1 M 용액에 1 g/L 철(III), 5 wt% 황산나트륨을 첨가해 반응온도와 반응시간을 변화시켰다. 이 때 미량 존재하는 희토류의 분리 가능성을 조사하기 위해 란타넘(III)의 농도를 1 g/L가 아닌 0.5 g/L로 고정했다. 반응온도는 25-100°C까지, 반응시간은 10분에서 최대 3시간까지 변화시켰다.
3.5.1. 반응온도
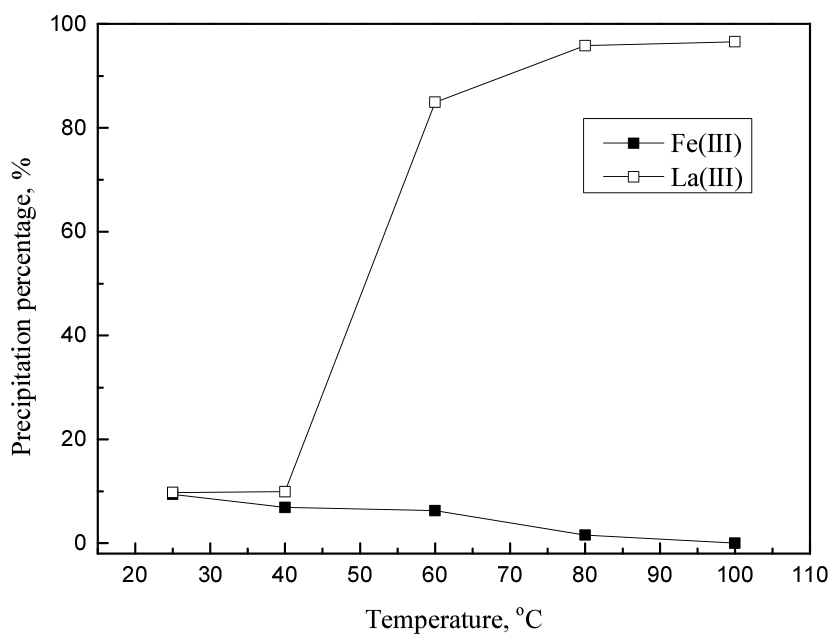
희토류 복염 침전 반응에 온도가 미치는 영향을 Fig. 7에 나타냈다. 25°C의 상온에서 철(III)과 란타넘(III)은 약 10% 가량 동시에 침전됐다. 그러나 60°C에서 란타넘(III)의 침전률이 급격하게 증가했고, 반대로 철(III)의 침전률은 약간 감소했다. 80°C의 경우 95% 란타넘(III)과 1% 철(III)이 침전됐다. 그리고 100°C에서 란타넘(III)은 96%의 최고 침전률을 달성했고 철(III)은 거의 침전되지 않았다.
온도에 따른 황산염의 용해도 및 착물형성상수를 각각 Tables 1과 2에 나타냈다23,24). Table 1을 보면 희토류 황산염은 철 황산염과 비교해 매우 작은 용해도를 가지며, 온도가 증가함에 따라 용해도가 감소하는 것을 알 수 있다. 또한 Table 2에서 온도에 비례해 log K1과 log K2 값이 증가하는 것을 알 수 있는데, 이는 고온에서 란타넘(III) 이온과 황산이온의 착물형성이 용이하다는 것을 의미한다. 따라서 온도가 증가하면 란타넘(III)의 침전률이 증가한다. 80°C 이상에서 온도가 철(III)과 란타넘(III)의 침전률에 큰 영향을 미치지 않으므로 후속 실험에서는 반응온도를 80°C로 고정했다.
Table 1.
Table 2.
The stability constants of sulfate complexes for La3+ at several temperatures23)
| Temperature (°C) | ||||
| 25 | 50 | 75 | 100 | |
| log K1 | 3.62 | 3.93 | 4.30 | 4.68 |
| log K2 | 1.67 | 1.94 | 2.24 | 2.54 |
3.5.2. 반응시간
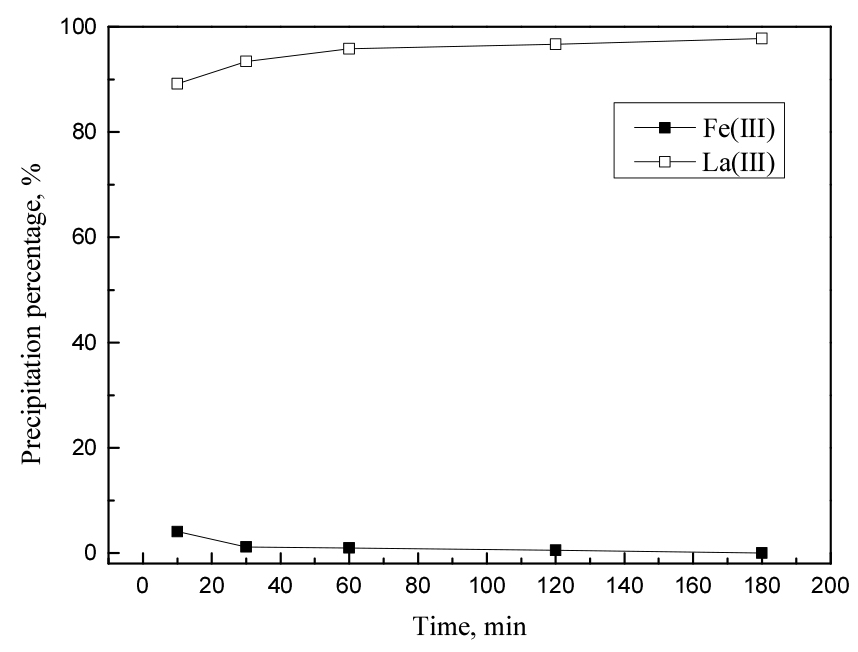
란타넘(III)의 침전률을 증가시키고 철(III)의 침전률을 낮추기 위해 반응시간을 변화시켰다. 반응시간을 10분에서 3시간까지 변화시켜 얻은 실험결과를 Fig. 8에 나타냈다. 황산나트륨에 의한 희토류 복염의 침전반응은 매우 빨라 10분 만에 89% 란타넘(III)과 4% 철(III)이 침전되었다. 반응시간이 점차 증가함에 따라 란타넘(III)은 97% 가까이 침전됐고, 철(III)의 침전률이 서서히 감소해 3시간 뒤에는 거의 침전되지 않았다. 따라서 고순도 란타넘(III) 복염을 침전하기 위해 반응시간을 길게 유지하는 것이 유리하므로, 후속실험에서 반응시간을 3시간으로 고정했다.
3.6. 철 농도의 영향
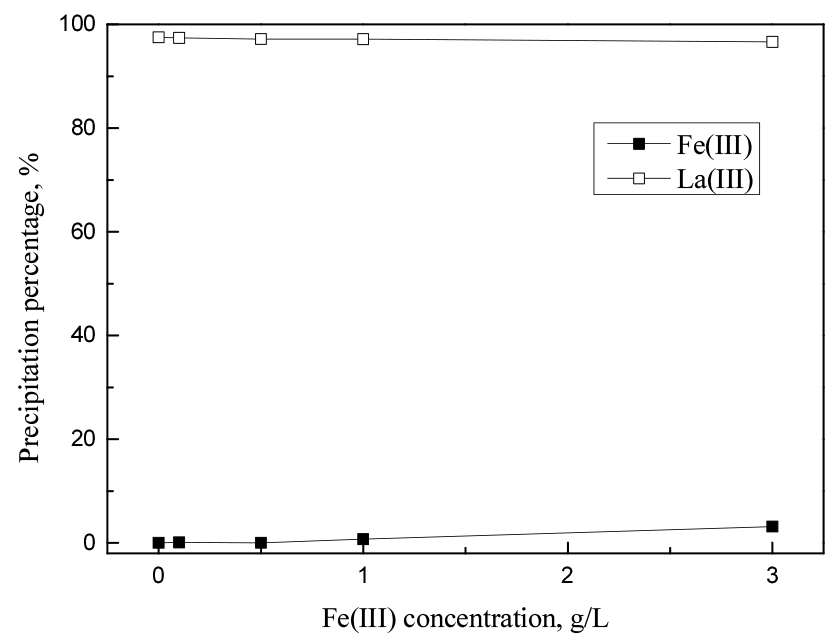
레드머드를 침출한 용액에서 경희토류를 침전시켜 분리하는 경우, 고순도 경희토류를 회수하기 위해서는 철의 공침 또는 흡착을 최대한 억제해야 한다. 따라서 철의 농도가 란타늄(III) 침전에 미치는 영향을 알아보기 위해, 0.1 M 황산 용액에서 철(III) 농도를 0에서 3 g/L까지 변화시켜 실험을 수행했다. 이 때 란타넘(III) 농도는 0.5 g/L, 황산나트륨 5 wt%, 반응온도 80°C, 반응시간은 3시간으로 고정했으며, 실험결과를 Fig. 9에 나타냈다. 본 실험조건에서 철(III) 농도가 미치는 영향은 크지 않았으나, 용액 내 철(III) 농도가 증가함에 따라 란타늄(III) 침전률이 약간 감소했고, 철(III)의 침전률은 약간 증가했다.
일반적으로 Fe3+의 이온반경이 La3+의 반경보다 작기 때문에, Fe3+는 SO42- 이온과 착물을 형성하려는 경향이 강하므로 La3+보다 높은 평형상수를 갖는다25,26). 이는 란타넘(III)이온의 황산염 착물 형성을 방해해 복염 석출을 어렵게하므로 란타넘(III)의 침전률을 감소시키고, 철(III)의 침전률을 증가시켰을 것으로 생각된다.
4. 결 론
본 논문에서는 철(III)과 란타넘(III)이 혼합된 황산용액에서 황산나트륨에 의한 란타넘(III)의 선택적인 침전에 미치는 다양한 요인들에 대해 조사했다. 먼저 용액내 Na+ 및 SO42- 이온과 란타넘(III) 농도의 증가는 복염 침전 반응을 촉진시켜 희토류 복염의 용해도를 감소시키고, LaSO4+ 및 La(SO4)2- 종의 분포를 증가시켜 안정한 복염을 형성함으로써 란타넘(III)의 침전률을 증가시켰다. 그러나 란타넘(III) 농도가 너무 낮은 경우, 과량의 황산나트륨을 필요로 하므로 침전효율이 감소했다. 따라서 레드머드에 함유된 희토류의 농도가 낮은 경우에는 희토류의 농축이 필요하다. 황산용액에서 온도의 증가 역시 LaSO4+ 및 La(SO4)2- 종의 분포를 높이는 요인 중 하나로 80°C 이상의 온도에서 3시간 동안 반응시키면 란타넘(III)이 97% 가까이 침전되고 철(III)은 거의 침전되지 않는다. 또한, 복염 침전 반응시 철(III) 농도는 두 금속의 침전률에 큰 영향을 미치진 않았지만, 철(III) 농도가 증가함에 따라 란타넘(III)의 침전률은 약간 감소하고, 철(III)의 침전률은 약간 증가했다. 본 연구를 통해 0.5 g/L 란타넘(III)을 함유한 황산용액에서 97%의 란타넘(III)과 1% 미만의 철을 침전시키기 위한 최적 조건은 5 wt% 황산나트륨 첨가, 0.1 M 황산 농도, 반응온도 80°C 및 반응시간은 3시간으로 밝혀졌다.