1. 서 론
2. 니켈의 생산량과 용도
3. 니켈 자원과 제련 개요
4. 니켈 황화광의 제련
4.1. 매트 용련(matte smelting)
4.2. 매트로부터 구리 제거
4.3. 금속 Ni의 제조
4.4. 니켈 황화물의 침출
5. 니켈 산화광의 제련
5.1. 페로니켈의 제조
5.2. Ni 매트 제조
5.3. Caron(or Nicaro) Process
5.4. 고압 침출법
6. 종 합
1. 서 론
순수한 금속 니켈은 1751년 스웨덴의 화학자인 크론스테트(Axel Fredrik Cronstedt, 1722~1765)에 의해 처음으로 분리되었으며, 1754년에 크론스테트는 이 새로운 금속원소를 ‘Kupfernickel’(악마의 구리)에서 구리(kupfer)를 빼고 니켈(nickel)이라 명명하였다1). 그러나 니켈(nickel, Ni)은 수천 년 전부터 합금으로 사용되어 왔다. 천연 니켈-철 합금인 철 운석으로 제조한 단검(10.9 % Ni 함유)이 B.C. 3100년경의 유물에서 발견되었다2). 청나라 초기에 송응성이 지은 산업기술서인 ‘천공개물(天工開物)’에 의하면 구리 광석에 비상(砒霜, arsenic poison) 등의 약제를 넣어 제련하면 백동이 만들어 진다고 기록되어 있다.
이러한 Ni은 생산 규모에서는 범용금속에 못 미치지만, 구조재료, 전자재료, 기능성재료 등의 중요한 합금성분으로 대량 사용되고 있는 금속이다. 특히 Ni은 Co와 함께 2차전지의 양극 재료로 사용되고 있지만, Ni의 지각 중 원소 존재도는 23위(84 ppm)로3) 대표적인 희소금속이며, Ni 자원은 지역적으로 편재되어 있다.
한편 Ni은 융점이 1,453 °C로 비교적 높으며, 내식성과 내산화 특성을 가지고 있다. 또한 연성이 매우 높고 합금화가 용이하며, 전기도금으로 피복이 가능하다. 그리고 실온에서 자성을 띠며, 촉매 특성도 가지고 있다. 이러한 니켈은 연간 약 270만 톤(2019년 기준)이 생산되어 소비재, 산업, 군사, 수송, 항공우주, 해양, 건축 등 30만 개 넘는 제품에 폭넓게 이용되고 있다. 니켈의 최대 용도는 합금용으로 생산량의 약 70 %는 스테인리스강의 제조에 이용되고 있다4).
한편 Ni은 Co와 함께 2차 전지의 필수적인 양극 재료로써 향후에도 수요량의 증가가 예상되므로 필히 리사이클링 하여야 하는 재료이다. 특히 Ni은 다양한 광석에서 산출되며, 광석 종류에 따라 여러 가지 제련법을 적용하여 금속으로 추출하고 있다. 특히 폐 리튬이온전지(LIBs, lithium ion battries)를 비롯한 2차 자원으로부터 Ni과 Co를 추출하는 리사이클링에서도 유사한 공정에서 처리하여야 하므로, 본 연구에서는 Ni 제련기술에 대해 고찰하였다.
2. 니켈의 생산량과 용도
Ni 자원의 전체 매장량은 약 2억 톤 정도로 추정되고 있으며, 호주, 브라질, 러시아, 뉴칼레도니아 등의 일부 한정된 국가에 편재되어 있다. 2017년 기준으로 Ni 광석의 생산량은 아시아 지역이 약 39 %로 가장 많다5).
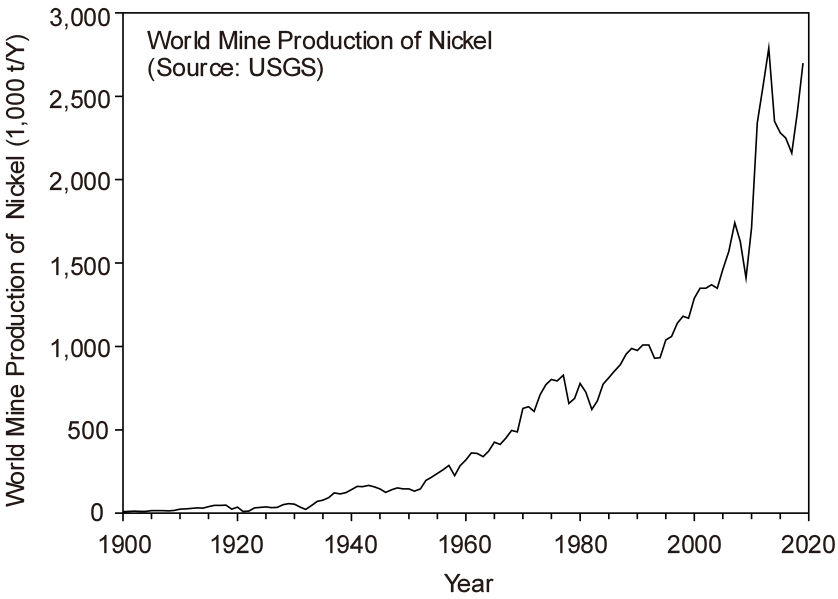
Fig. 1에는 1900년부터 Ni의 전 세계 생산량 변화 추이를 나타내었다6). 1900년의 Ni 생산량은 1만 톤 미만이었으나, 꾸준히 증가하여 1920년대 말에 5만 톤을 초과하였으며, 1937년에는 10만 톤을 초과하였다. 그리고 1950년대에 들어서 비교적 급격하게 증가하여 1975년에 약 80만 톤까지 생산하였으며, 그 이후 증감이 있었지만 1982년부터 다시 급격하게 증가하기 시작하였다. 특히 2000년대에 중국의 철강특수에 의해 다시 급격하게 증가하여 2013년에 최대 생산량을 나타낸 후 감소하였으나, 2017년부터 다시 회복세를 보이고 있다. 2017년 기준으로 중국을 비롯한 인도네시아, 일본 등 상위 10 개국의 생산량(177만 톤)이 전 세계 생산량의 약 80 %를 차지하고 있다. 특히 중국은 62.4만 톤을 생산하여 전 세계 생산량의 약 28 %를 차지하고 있으며, 뒤이어 인도네시아의 생산량이 비약적으로 증가하여 전 세계 생산량의 약 10 %에 가까운 양을 생산하고 있다7).
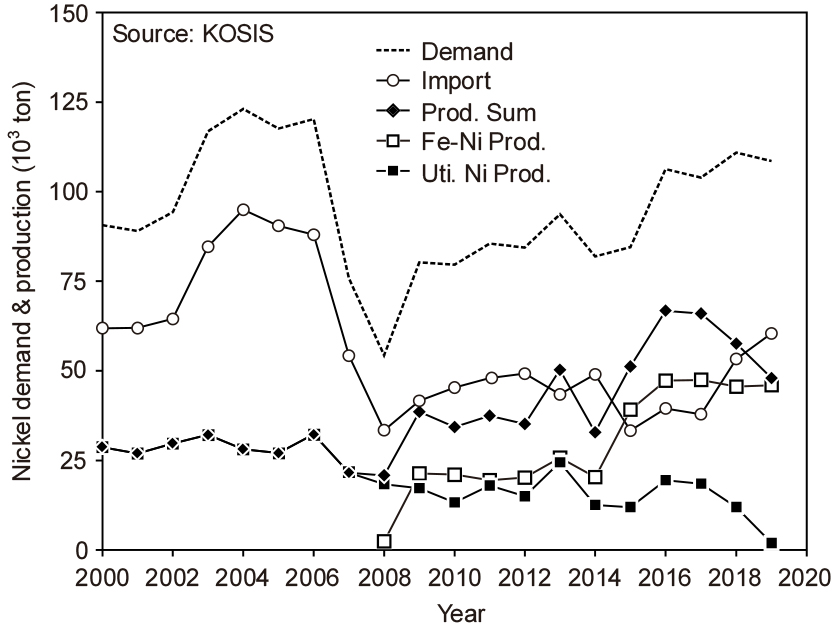
Fig. 2에는 국내의 Ni 수요와 공급량 추이를 나타내었다8,9). 그림 중의 Fe-Ni(페로니켈)은 Ni 함량 20 %를 기준으로 환산한 것이다. 최근의 국내 수요는 11만 톤 전후이며, Fe-Ni을 포함한 2019년도 기준의 국내 Ni 생산량은 48,000 톤 정도이며, 나머지는 수입에 의존하고 있다.
Fig. 3에는 2016년 기준 Ni의 1차 용도를 나타내었다.4) 생산량의 약 70 %가 스테인리스강의 합금용으로 사용되는 등, 비철금속이나 특수강의 합금용으로 사용되는 비율이 가장 높으며, 그 외 도금이나 배터리용 등으로 사용되고 있다. 향후에도 이러한 경향에는 큰 차이가 없을 것으로 보이나, 전기 자동차의 보급이 급격히 활성화되면서 리튬이온전지용의 Ni 용도도 점차 증가할 것으로 예상된다.
3. 니켈 자원과 제련 개요
Ni 제련의 원료 광석에는 황화광과 산화광이 있다. Ni 황화광의 대부분은 pentlandite((Ni,Fe)9S8)이며, 일부 millerite (NiS), volerite(Ni2FeS4) 등이 있다. 그 외에 pyrrhotite (Fe1-xS), arenopyrite(FeAsS), pyrite(FeS2), chalcopyrite (CuFeS2) 등에도 소량의 Ni이 함유되어 있다. 원광의 Ni 품위는 0.2~4 % 정도이며, Cu도 같은 정도가 함유되어 있으나, 산화광과 달리 선광에 의해 Ni 정광과 Cu 정광으로 농축하여 분리할 수 있다10).
대표적인 산화광에는 laterite((Ni, Co)SiO3·(Fe, Al, Cr)2O3·xH2O)계와 SiO2, MgO 등이 많은 garnierite ((NiMg)6Si4O10(OH)8)계의 두 종류가 있다. Table 1에는 Ni 제련 원료로 많이 사용되고 있는 라테라이트 광석의 종류와 주요 원소의 품위를 나타내었다11). 라테라이트 광은 표층으로부터 ferricrete, limonite, nontronite, saprolite로 광석의 종류가 변하며, 그에 따라 Ni의 함량도 지표로부터 심도에 따라 연속적으로 변화한다. 리모나이트는 주성분이 철(Fe)이며, 그 외에 알루미늄이나 크롬의 품위도 높은 편이다. 사프로라이트에는 마그네슘이나 실리카가 철과 같은 정도로 높게 함유되어 있다. 따라서 건식정련 공정에서는 사프로라이트를, 습식 공정에서는 리모나이트 광석을 주로 사용한다.
Table 1.
Typical assay of nickel laterite ore
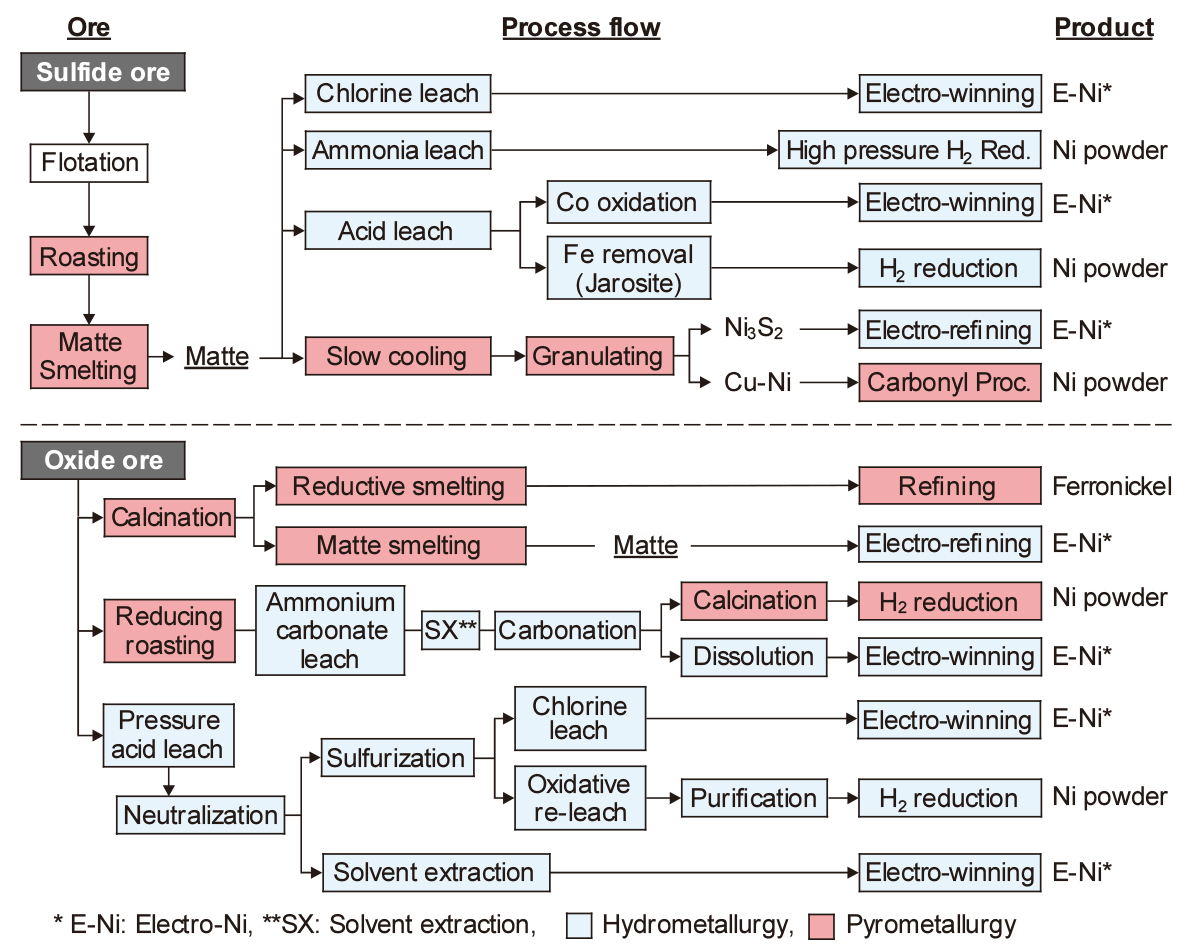
Fig. 4에는 Ni 제련 프로세스의 대표적인 예를 원료 광석별 제련 프로세스와 금속 Ni의 제품 형태를 대응시켜 나타내었다12,13). Ni 제련의 제조 공정은 원료 광석에 따라 매트(matte, 황화물), 수산화물, 황화물 등의 중간제품을 거치는 경우가 많다. 최종 제품에는 금속 Ni과 Fe-Ni 합금철(ferro-nickel)의 두 종류로 구분할 수 있으며, 금속 Ni은 정제방법에 따라 판상이나 분말, 브리켓트 등 다른 형상으로 만들어지고 있다. 제련방법에는 황화광의 건·습식제련, 산화광의 건·습식제련이 있으나, 회사나 광석 종류에 따라 복합적인 제련방법을 적용하고 있다.
4. 니켈 황화광의 제련
4.1. 매트 용련(matte smelting)
Ni 황화광의 제련에서는 정광 중의 Ni을 농축하기 위해 매트 용련을 한다. Fig. 5에는 니켈 황화광을 건식제련으로 처리하여 고품위 매트를 제조하는 프로세스의 예를 재구성하여 나타내었다14). 원료 광석을 직경 50 μm 이하로 파쇄한 후 부유선별로 Ni이 농축된 정광(concentrate)을 얻는다. 정광을 건조하여 자용로(flash smelting furnace)나 전기로에서 용련하면 Ni보다 Fe의 산소 친화력이 높으므로15) 철의 일부를 산화시켜 슬래그로 분리할 수 있다. 자용로에서 일어나는 정광의 산화 반응은 다음과 같다.
자용로의 샤프트(shaft)부에서 완전히 산화된 작은 입자들은 슬래그층을 통과하면서 아래와 같은 Ni의 황화반응이 일어나기도 한다.
전기로에서 용련하는 경우, 약 700 °C에서 미리 공기를 이용하여 부분 산화배소를 하며, 이때의 반응은 식 (1) 및 식 (2)와 동일하다. 전기로에서는 배소광(calcine)을 SiO2 플럭스와 함께 용융하여 Ni이 많은 매트와 슬래그로 분리한다.
자용로나 전기로에서 Ni을 약 40 %까지 농축한 후, 전로(converter)에서 철과 유황을 산화 제거하면 약 70 % Ni의 고품위 매트가 얻어지며, 이것을 분쇄하여 정제공정에 보낸다. 매트 중 철의 산화반응은 다음과 같다.
4.2. 매트로부터 구리 제거
Ni 황화광은 물론 Ni+Cu의 혼합 정광인 경우에도 자용로-전로를 거치면 Ni 50~60 %, Cu 25~30 % 정도의 고품위 매트가 얻어진다. Ni이 농축된 매트를 Cu와 분리하는 방법에는 매트 서냉법(slow cooling)과 침출 탈동법이 있다.
매트는 Ni3S2와 Cu2S의 혼합물로 용융 상태에서는 완전히 혼합되어 있으나, 상온에서는 상호 용해도가 거의 없다. 따라서 서냉법으로 Ni3S2와 Cu2S를 분리할 수 있다. Ni과 Cu가 농축된 매트를 응고 개시 온도 부근에서 서서히 냉각하면 Ni3S2와 Cu2S 외에 금속 Ni 합금(Ni 65 %, Cu 20 %)의 3상 입자가 각각 크게 성장하여 기계적인 상호 분리가 가능하게 된다. 실제 조업 예로는 1,250 K에서 주조한 후에 4 일간에 걸쳐서 470 K까지 냉각한다. 이것을 분쇄하여 자력 선별에 의해 금속 부분을 분리한다. 금속 중에는 매트 중으로 분배된 백금족 원소가 농축되므로 별도 처리를 한다. 비자성 부분은 부유선별하여 Ni 정광(Ni 73 %, Cu 0.6 %)과 Cu 정광(Cu 73 %, Ni 5 %)으로 분리하여 Ni 제련과 Cu 제련의 원료로 사용한다16).
한편 Ni이 농축된 매트를 산화 배소하면 Cu는 산 침출이 용이한 산화물이 되므로 Cu의 전해 미액으로 Cu를 침출하고, 침출 잔사를 완전히 탈황한 후 환원하면 조Ni을 얻을 수 있다.
4.3. 금속 Ni의 제조
전로에서 얻어진 고품위 매트로부터 최종 제품을 얻기 위한 정련에는 건식법과 습식법이 있다. 건식법에서는 매트를 산화 배소하여 산화물로 만든 후, 다시 환원배소나 환원용련으로 조Ni을 만든다. 조Ni은 CO가스로 Ni(CO)4를 만든 후 다시 열분해시켜 고순도 Ni을 얻는 Mond법(carbonyl법)이나 전해정련에 의해 전기 Ni을 얻는 Hybinette법으로 정제한다.
(1) Mond법
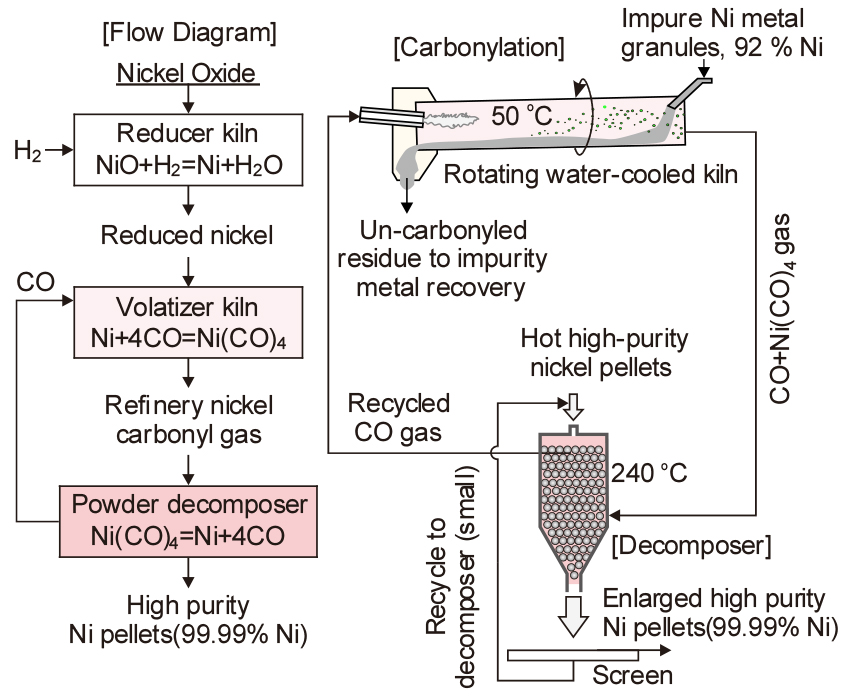
Fig. 6에 Vale Clydach refinery에서의 Ni 분말 제조 공정과 Mond법 공정도를 나타내었으며, 년간 45,000 톤의 고순도 Ni을 제조하고 있다17). 조금속 Ni을 다음식과 같이 CO가스와 반응시켜 니켈카보닐(Ni(CO)4)로 만들고 불순물은 고체로 남긴다.
열역학적으로 이 반응은 약 395 K 이하에서 일어나며, 그 이상의 온도에서는 역반응이 일어난다. 따라서 일반적으로는 다음식과 같이 반응시켜 고순도 Ni을 제조한다18).
이 반응은 온도에 따라 반응의 진행 방향이 좌우로 변한다. Ni(CO)4의 융점은 248 K(-25 °C), 끓는점은 316 K(43 °C)로 매우 휘발하기 쉽다. 더욱이 453 K(180 °C) 이상에서는 분해하여 다시 Ni과 CO가 되므로, 이 성질을 이용하여 Co나 그 외의 불순물을 제거하고, 고순도 Ni을 제조하며, CO 가스는 리사이클링 한다. Vale Clydach에서는 니켈카보닐을 약 240 °C에서 분해시키고 있다. 다만 니켈카보닐과 CO 가스는 맹독성 가스이므로 대기 중으로 유출되지 않도록 주의하여야 한다.
(2) Hybinette법
고품위 Ni 매트(Ni 48 %, Cu 27 %, S 22 %)를 산화 배소한 후, 탈동 전해 미액으로 Cu를 침출하여 제거하고, 침출 잔사를 전기로에서 환원 용융하여 조 Ni(Ni 76 %, Cu 17 %)로 만든 후 전해정련을 하는 방법이다.
(3) 습식법
황산, 염소, 암모니아 등을 이용하여 매트 중의 Ni을 침출시키며, 4.4절에서 설명한다. 그리고 니켈과 함께 침출된 Co를 용매추출법으로 분리하고, Co를 정제하여 회수하는 경우가 많다. 금속 Ni은 전해 채취법으로 판상의 전기 Ni이나 수소 환원하여 Ni을 분말로 회수하기도 한다.
4.4. 니켈 황화물의 침출
황화광의 습식제련법으로 암모니아를 침출제로 이용하는 Sherritt법이 있으나, 광석의 고갈로 인해 Ni-Cu 매트 등 다양한 황화물을 원료로 사용하고 있다. 특히 황화광의 습식제련에서는 정광을 직접 침출하거나, 매트 용련으로 Ni을 농축시킨 고품위 매트를 침출하여 Ni을 추출한다.
(1) 암모니아 침출
귀금속의 함유량이 적고 Co가 함유된 정광을 오토클레이브(autoclave)에서 70~88 °C, 7~10 기압 정도의 산소를 취입하면서 강 암모니아수로 침출하면 Ni과 Cu는 가용성의 아민착체인 와 로 용해된다. Ni 함량이 높은 복합 황화물을 원료로 사용하는 캐나다의 Fort Saskatchewan에서는 약 120 °C에서 침출하고 있으며, Ni의 용해 반응은 다음과 같다.
침출 종료 후, 여액을 227 °C 정도의 오토클레이브 중에서 Cu의 대부분을 S나 SO2 등을 사용하여 CuS로 침전시키며, 남은 Cu는 다음 식과 같이 H2S(g)로 처리하여 제거하기도 한다.
뒤이어 FeSO4를 촉매로 첨가하여 180~200 °C의 오토클레이브에서 수소압력 35 atm으로 가압 환원하면 99.87 %의 Ni 분말이 얻어진다. Ni을 회수한 후의 여액에 H2S를 취입하면 Co와 나머지 Ni이 혼합 황화물로 침전되며, Co 회수공정에서 처리한다19).
(2) 염소 침출
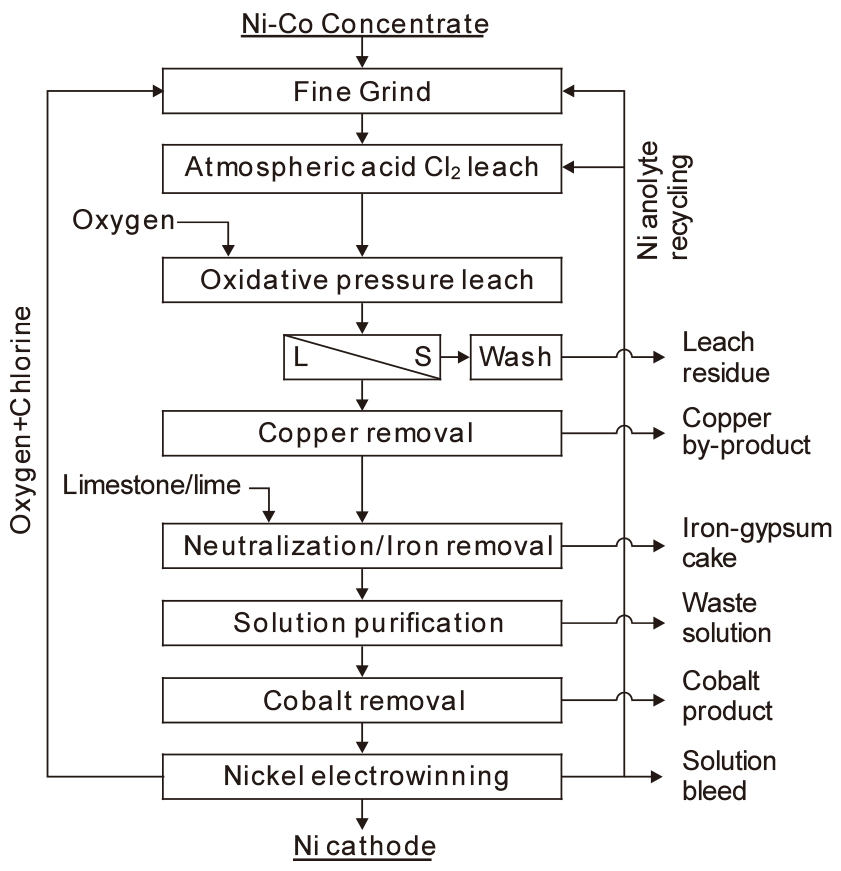
캐나다의 Voisey Bay에서는 염소를 이용하여 Ni, Co, Cu와 함께의 소량의 귀금속이 함유된 정광을 침출한다. Fig. 7에는 Voisey Bay의 황화광 처리 공정도를 나타내었다20). 20~30 μm 크기로 분쇄한 정광을 대기압 하에서 염소로 침출하고, 뒤이어 산소에 의한 가압 침출을 하며, 각각의 반응식은 다음과 같다.
황화철(pyrrhotite)도 동일한 반응으로 침출되며, 염소 침출에서 제거된 S는 산소 침출에서 황산이 되어 침출 반응에 사용된다.
고액 분리한 여액 중의 Cu는 H2S(g)나 용매추출로 제거한다. 이후 정액 공정과 용매추출에 의해 Co를 회수한 후, 전기 분해로 Ni을 회수하고 있다.
(3) 황산 침출
황화광을 매트 용련한 고품위 매트나 산화광을 황화시킨 황화물을 산소를 이용하여 황산으로 침출하며, 반응식은 다음과 같다.
광석이나 황화물 중에 Cu 농도가 높으면 Cu와 Ni의 상호반응에 대한 검토도 필요하다. 한편, 황산+산소에 의한 황화물 침출은 저가의 용매를 사용할 수 있고, 부식성 가스의 발생이 없으므로 향후 많은 연구가 필요할 것이다. 특히 고압침출(HPAL)법 등에서 후속 공정에 의한 Ni 회수 공정이 잘 정립되어 있으므로 이를 활용한다면 향후 많은 발전이 기대된다.
5. 니켈 산화광의 제련
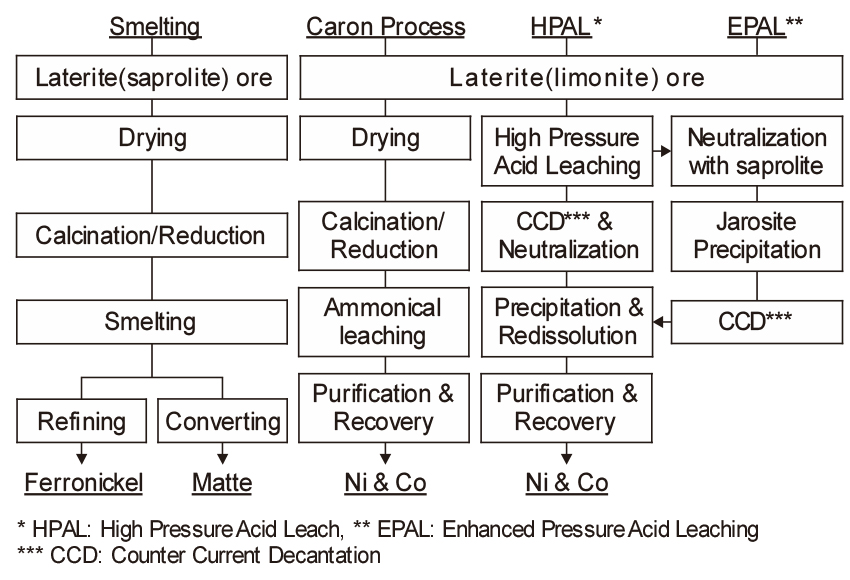
Ni 산화광은 2 % Ni 전후의 저품위광으로 상당량의 산화철을 함유하고 있으므로, 약 90 %는 환원 용련에 의한 페로니켈의 제조에 사용되고 있으며, 나머지는 Ni-Fe-S 황화물인 매트로 만들어 Ni을 회수하고 있다. 특히 Ni 산화광은 황화광과 달리 유효한 선광법이 없으므로 저품위 광석을 직접 처리하고 있다. Fig. 8에는 Ni 산화광을 처리하는 공정을 비교하여 나타내었다.
5.1. 페로니켈의 제조
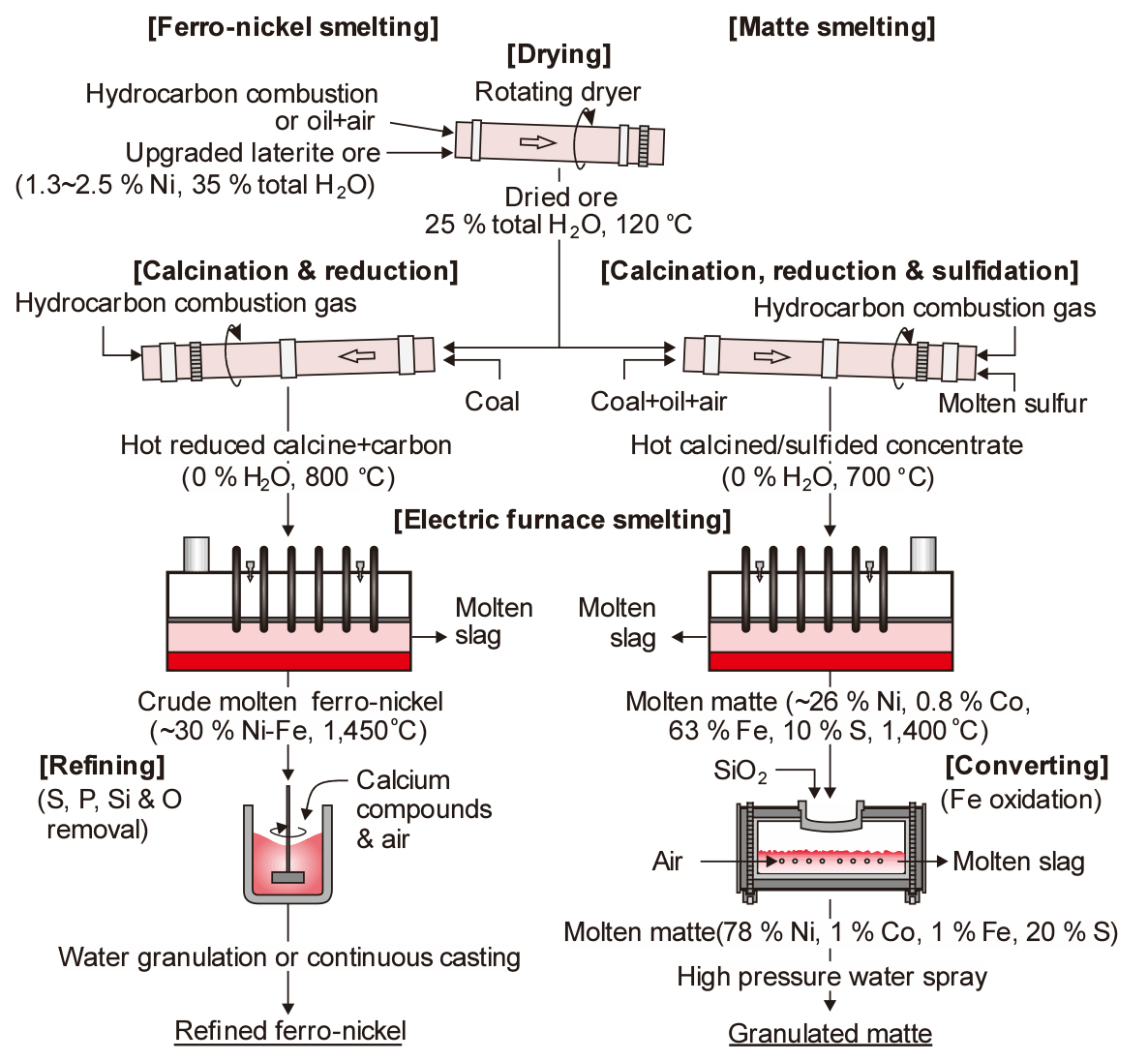
Fig. 9에 Ni 산화광으로부터 스테인리스강의 원료인 페로니켈(Fe-Ni, ferro-nickel)을 제조하는 공정과 매트 제조 공정의 예를 비교하여 나타내었다. 페로니켈의 경우 우리나라의 SNNC에서도 유사한 공정을 적용하고 있다. 길이 30 m, 직경 4 m 정도의 로터리 킬른에서 광석 중에 물리적으로 결합되어 있는 수분을 제거한 후, 길이 100 m, 직경 5 m 정도의 하소(calcination)용 킬른으로 보내어 화학적으로 결합되어 있는 수분의 제거와 부분적인 환원을 한다. 하소 공정에서는 다음과 같은 열분해 반응이 일어난다.
그리고 열분해 반응에 의해 생성된 산화물은 약 800 °C에서 환원제인 석탄에 의해 아래와 같은 환원 반응이 일어난다.
전기 아크로에서는 다음의 세 가지 반응에 의해 페로니켈이 만들어진다.
전기로에서 얻어진 조페로니켈을 레이들로 출탕시켜 P, S 등을 제거하여 정제하고, 전기로에서 발생하는 슬래그(SiO2 54 %, MgO 36 % 등)는 공냉하거나 수쇄하여 노반재나 아스팔트용 골재 등으로 사용하고 있다21).
5.2. Ni 매트 제조
Ni 산화광의 대부분은 페로니켈 제조에 사용되고 있으나, 일부에서는 Ni-Fe-S 매트로 만들어 합금용 Ni로 만들거나 습식제련의 원료로 사용하고 있다. Fig. 9에서처럼 Ni 매트 제조는 페로니켈 제조공정과 유사하다. 다만 하소 및 환원용 킬른에 유황(S)를 첨가하여 기화된 S가 광석 중의 Ni, Fe와 반응하여 Ni3S2와 FeS가 주성분인 매트를 만든다.
황화물 소광은 전기로에서 용융 매트가 되면서 불순물은 슬래그로 제거되어 Ni은 약 26 % 정도로 농축된다. 농축된 매트는 다시 전로에서 산화정련으로 Fe를 저융점의 fayalite 슬래그(Fe2SiO4)로 제거시키면 약 78 % Ni의 고품위 매트가 만들어진다. 고품위 매트는 수쇄하여 NiO를 만들기 위한 산화배소 공정이나 전해 Ni을 만들기 위한 습식제련공정으로 공급한다.
5.3. Caron(or Nicaro) Process
Ni 산화광 중 Mg이 많으면 경제성이 낮은 문제점이 있어서, 1924년에 Caron이 환원배소 후 탄산암모니움으로 침출하는 방법을 개발하였으며, 쿠바의 Nicaro에서 조업을 시작하여 Nicaro법이라고도 불린다. 광석을 로터리 건조기에서 건조하고 75 μm 이하로 분쇄한 후, 다단 배소로에서 석유를 공기로 연소하여 생성된 CO+H2 혼합가스로 환원하며, 반응식은 다음과 같다.
환원배소를 하면 Ni과 Co는 금속상이 되고, Fe는 암모니아성 탄산암모니움 용액에서 침출되지 않는 산화물이나 규산염으로 된다.
환원배소한 소광을 암모니아성 탄산암모니움 용액에 투입하여 냉각하고, 공기를 취입하면서 침출한다.
고액 분리한 여액에 황화 암모니움을 첨가하여 Co 전부와 약 10 %의 Ni을 황화물로 침전시켜 고액 분리한다. Co가 제거된 여액을 수증기로 가열하여 암모니아를 제거하고 염기성 탄산니켈(3Ni(OH)2·2NiCO3)을 침전시킨다. 염기성 탄산니켈을 약 900 °C에서 하소하면 Ni이 약 77 %인 NiO가 만들어 진다.
NiO를 수소로 환원하여 Ni 85, 88, 90 %의 산화 Ni을 만들어 시판한다. 또 탄산니켈을 용해하여 가압 수소환원이나 전해채취로 금속 Ni을 얻고 있다. 한편 고액 분리된 황화물은 Co 제조용 원료로 사용한다.
5.4. 고압 침출법
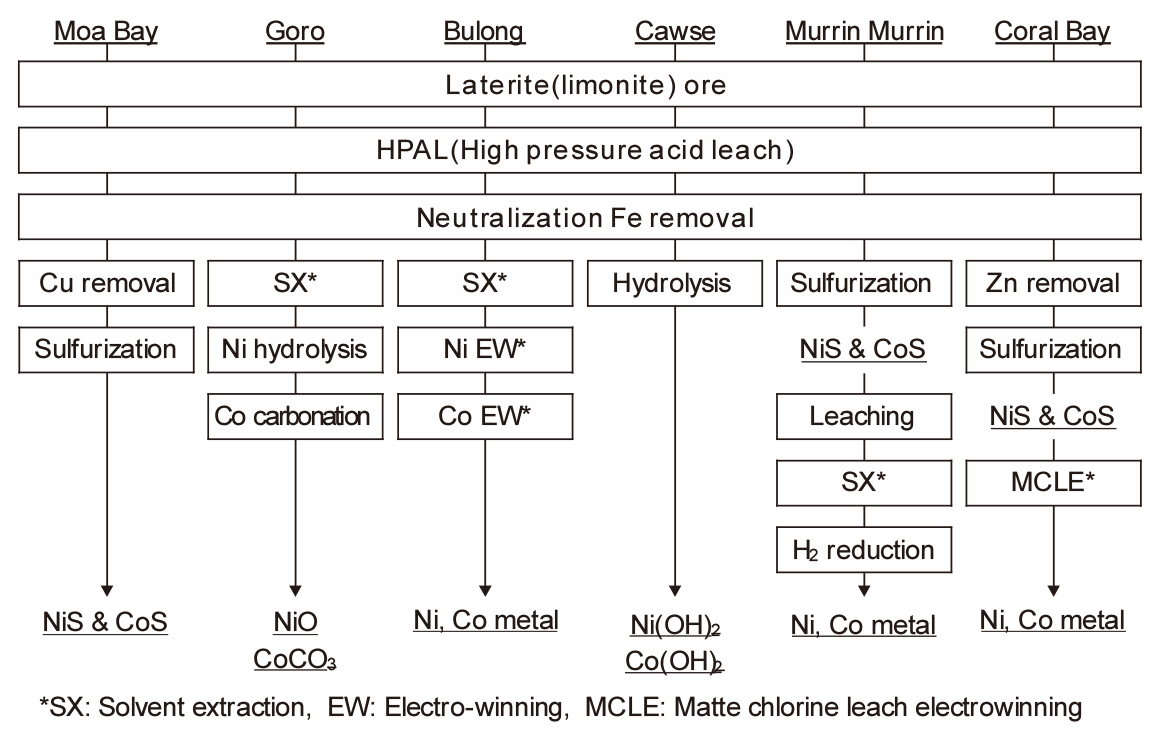
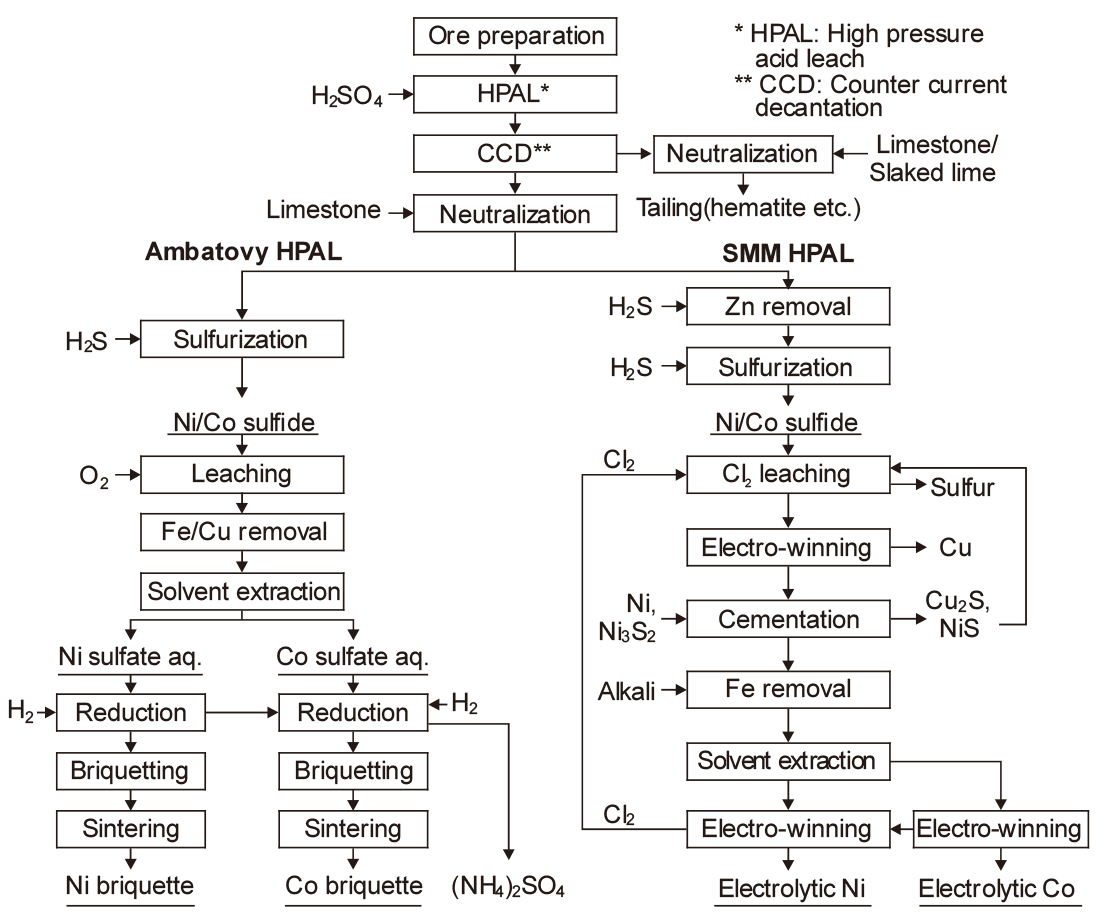
대표적인 Ni 산화광의 습식 제련법으로 HPAL(high pressure acid leach)법이 있다. HPAL법에는 Moa Bay, Murrin Murrin, Cawase, Ravensthorpe, Ambatovy, CBNC-SMM 프로세스 등 여러 가지가 있으며, 환원 방법에 따라 생산제품도 다르다. Fig. 10에 여러 회사의 HPAL 공정을 비교하여 나타내었다.
Fig. 11에는 여러 가지 HPAL 프로세스 중 Ambatovy와 CBNC-SMM(Coral Bay Nickel Corporation-Sumitomo Metal & Mining)의 공정도를 비교하여 나타내었다22,23). HPAL 프로세스의 기본은 광석 중의 유가금속인 Ni과 Co를 200 °C 이상, 3 MPa 이상의 고온·고압에서 오토클레이브를 이용하여 침출하는 것이다. 황산에 의한 Ni과 Co의 침출반응은 다음과 같다.
그리고 광석의 주성분인 괴타이트(FeOOH)는 다음 식으로 침출된 후, 200 °C 이상의 고온에서 헤마타이트(Fe2O3)로 다시 침전되면서 황산이 재생된다.
이와 같이 HPAL법에서는 황산을 소비하지 않으면서 철을 헤마타이트로 분리할 수 있으므로 경제성이 높은 제련법으로 알려져 있다.
한편 광석 중의 불순물로 철 이외에 Mg 등이 존재하며, 황산에 의해 침출되므로 황산의 소비량이 많아진다. 그 외에도 Al, Mn 등의 불순물도 황산에 의해 침출된다. 침출액을 정제한 후에 H2S를 첨가하면 Ni-Co의 복합 황화물로 침전된다. SMM법에서는 이 복합 황화물을 MCLE (Matte Chlorine Leach Electro-winning)법으로 보내어 염소로 침출한 후, 용매추출법을 이용하여 Ni과 Co를 각각 분리하고 전해 채취한다.
한편 EPAL(Enhanced Pressure Acid Leaching)은 BHP Billiton에서 상압 침출을 할 때, Ni과 Co의 실수율이 HPAL에 비해 낮은 문제점을 해결하기 위해 실시하는 방법이다24). 즉, HPAL에서 생성된 고농도의 산을 함유한 슬러리 중에 사프로라이트광을 투입하여 중화와 함께 상압 침출하고 있다. 그리고 침출액 중의 Fe를 자로사이트로 제거한 후 HPAL 공정에서 처리하는 방법이다.
6. 종 합
Ni은 대표적인 희소금속이지만 년간 생산량이 약 270만 톤에 달하며, 전 세계 생산량의 약 70 %는 스테인리스강 등의 합금용으로 사용되고 있다. 비록 아직 사용량은 적으나 2차 전지나 커패시티의 주요 구성 원소이다. 이러한 Ni은 황화광, 산화광 등 광석 종류에 따라 매우 다양한 제련방법에 의해 추출되고 있다. 황화광의 경우 1차적으로 매트 용련을 거친 후 습식법으로 전해 Ni이나 Ni 분말을 제조하고 있다. 산화광의 경우 광석 품위에 따라 페로니켈을 제조하거나 Ni 매트를 만들어 전해정련을 하기도 하며, 고압 산 침출, 용매추출, 전해채취 등의 공정으로 Ni을 회수하고 있다. 이와 같이 다양한 Ni 제련법을 응용하면, 2차 전지나 커패시티, 도금 슬러지 등의 Ni 2차 자원으로부터 Ni을 회수하는 새로운 리사이클링 공정의 개발에 큰 기여를 할 수 있을 것으로 기대된다.