1. 개 요
알루미늄은 대표적인 경량금속으로서 건축 기자재, 자동차 부품, 우주 항공 부품, 전자 부품, 식음료 포장재, 스포츠 레저 등의 다양한 산업에 사용되고 있으며, 알루미늄 소재 시장은 아시아 국가들을 중심으로 꾸준히 성장하는 추세이다. 국내의 경우 알루미늄 총 소비량은 2017년 기준 약 2,094 천 톤으로서 높은 수급 성장률을 보이고 있으며, 세계 알루미늄 소비량의 5위를 차지하고 있다. 국내에서 소비되는 알루미늄은 국내 1차 지금 생산이 전혀 없기 때문에 재활용 공정을 통해 생산된 2차 지금의 소비량이 비교적 높으며, 2차 지금은 국내 알루미늄 산업 전반에 걸쳐서 폭넓게 활용되고 있다. 2차 지금 산업은 경제적 환경적 이점에 따라 지속적으로 증가할 것으로 예상되며1,2,3), 이에 따른 알루미늄 재활용 연구가 꾸준히 이루어지고 있다.
알루미늄 스크랩 용해 시 금속의 산화 방지 및 게제물 포획을 위하여 flux가 사용되며4,5), 용탕 상부에 짙은 회색의 드로스가 발생된다. 이러한 블랙 드로스(Black dross)는 금속(Al 합금), Salt flux(NaCl, KCl), 세라믹(Al2O3, MgO)등이 포함되어 있으며, 물질별 함량은 공정마다 차이가 있으나 UBCs(used beverage can) 재활용 공정 중에 발생하는 블랙 드로스의 경우 약 3 % 금속과 약 50 % Salt flux가 함유되어 있는 것으로 보고된바 있다6,7).
블랙 드로스 내에 다량 함유되어 있는 Salt flux는 파분쇄-용해(Dissolution)-고액분리-감압증발 공정을 이용하여 90.8 % 회수가 가능하며7), 금속은 파쇄공정에서 약 97.3 % 회수가 가능하다6). 금속과 Salt flux를 회수한 후 발생되는 세라믹 물질에는 Al2O3가 50~70 wt.% 함유되어 있어 Al2O3를 이용한 소재화 연구가 꾸준히 이루어지고 있으며, 블랙 드로스와 유리분말을 혼합한 후 수열합성을 이용하여 zeolite를 합성한 연구, 블랙 드로스로부터 습식 공정(Leaching, precipitation, Selective dissolution 등)을 이용하여 Al(OH)3를 회수한 후 하소하여 Mesoporous alumina를 제조하는 연구, 블랙 드로스 내 Al2O3와 철 용탕과 반응 시켜 Hercynite (FeAl2O4)를 합성한 연구7,8,9,10,11) 등이 보고된바 있다. Mayenite는 칼슘 알루미늄 산화물로서 블랙 드로스를 이용하여 합성이 가능하다. Mayenite는 Ca12Al14O33으로 시멘트 경화 가속 특성, 산소 이동도, 이온 전도도 등의 특징을 가지고 있으며, 시멘트 가속제, 이온 흡착제, 촉매제, 열화학 에너지 저장체(thermochemical energy storage) 등 다양한 분야에 적용이 가능하다12,13,14,15,16). 본 연구에 사용되는 블랙드로스의 경우 Al 이외에 Mg, Fe. Mn, Cu 등의 불순물이 존재하여 고순도가 요구되는 분야에는 적용이 힘드나, C12A7(Mayenite)계 슬래그(Fe2O3. MnO, CuO 함유)를 바닥용 모르타르 수축 저감재로 사용한 문헌을 바탕으로 판단하였을 때, 내화제 및 시멘트에는 불순물 제거 없이 적용이 가능할 것으로 판단된다17).
본 연구에는 블랙 드로스의 고부가가치화를 위하여 Mayenite를 합성하였으며, CaCO3를 추가로 첨가하여 Ca의 소스로 사용하였다. 합성 조건 최적화를 위하여 조건에 따른 합성 실험을 진행 하였으며, 배합 조건 및 온도에 따라 합성된 분말을 XRD, SEM 및 BET를 이용하여 특성을 평가하였다.
2. 실험 방법
본 연구에서는 UBCs 재활용 공정에서 발생하는 블랙 드로스를 이용하였으며, 구형의 블랙 드로스는 컷밀(Cut Mill, Pulverisette 19, Fritsch)을 이용해 파쇄 후 증류수를 이용하여 Salt flux를 용해(Dissolution) 제거 시켰다. 불용해성 물질(Al2O3, MgO 등)은 필터프레스를 이용하여 고액분리 하였으며, 최종 회수된 분말은 Mayenite 합성을 위한 Al 전구체로 사용하였다. Salt flux 제거 블랙 드로스의 XRF(X-ray fluorescence, Shimadzu XRF-1800)분석 결과(Table 1) 54.7 wt.% Al2O3가 함유되어 있으며, 나머지 MgO, Fe2O3, MnO 등으로 구성되어있다. Ca 전구체의 경우 CaCO3(DAE JUNG, 96%) 분말을 사용하였다.
Table 1.
Chemical composition of Al black dross
| Oxide | Al2O3 | MgO | Fe2O3 | MnO | CuO | ZrO3 | Cr2O3 | ZnO | NiO |
| wt.% | 54.7 | 33.4 | 7.3 | 2.3 | 0.9 | 0.6 | 0.5 | 0.2 | 0.1 |
Mayenite 합성을 위하여 우선 블랙 드로스와 CaCO3를 일정 비율(드로스 분말: CaCO3 분말=1:0.3, 1:0.4, 1:0.5, 1:0.6)로 볼밀링을 이용하여 12시간 동안 혼합 및 분말화 하였다. 혼합 및 분말화 시간의 경우 전체분말이 300 µm 이하가 되는 시점을 기준으로 선정하였다. 혼합된 분말은 알루미나 도가니를 용기로 이용하여 전기로(Box furnace)에서 합성하였으며, 합성 온도 조건별(600, 700, 800, 900, 1,000 ℃)로 분위기 제어 없이 실험을 실시하였다. 합성 시간은 300 ℃/hour로 목표 온도까지 승온 시킨 후 2시간 유지시켰으며, 전기로 내부온도가 상온이 될 때까지 로냉 시켰다.
혼합 분말의 합성 열적 특성을 확인하기 위하여 TGA (thermo gravimetric analysis, DTG-60H, SHIMADZU), DTA(Differential Thermal Analysis, DTG-60H, SHIMADZU)를 이용하여 10 ℃/min으로 1,000 ℃까지 분석하였으며, 합성된 분말의 상 분석을 위하여 XRD(X-ray diffractometer, SmartLab, Rigaku)를 이용하여 분석하였다. Mayenite 형상을 확인하기 위하여 FE-SEM (Field Emission Scanning Electron Microscope, JSM –7100F, JEOL)를 이용하여 관찰하였으며, 분말의 비표면적은 BET (Brunauer–Emmett–Teller, Micromeritics TriStar II 3020)을 이용하여 측정하였다.
3. 결과 및 토론
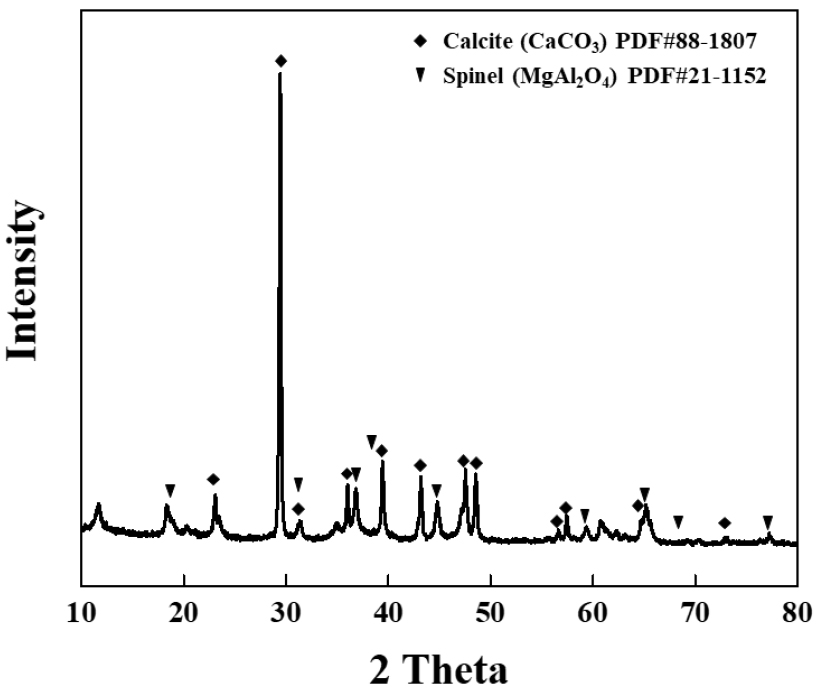
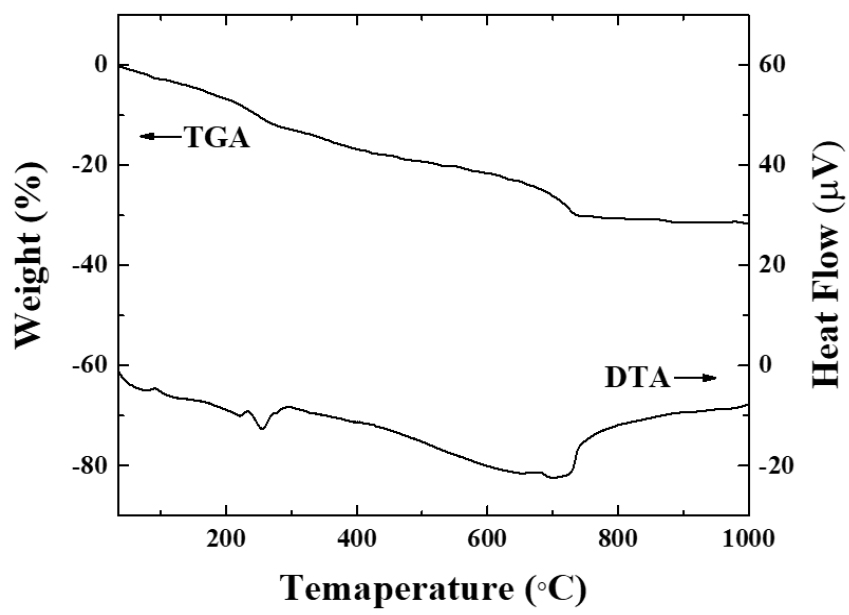
혼합 분말의 상분석 및 열적 특성을 확인하기 위하여 합성율이 가장 높을 것으로 예상되는 혼합 비율 1:0.6을 대표로 이용하여 분석을 실시하였다. Fig. 1에 XRD 분석 결과를 나타냈으며, 혼합분말에는 MgAl2O4 Spinel과 CaCO3가 혼재되어 있는 것을 확인할 수 있다. 혼합 분말의 열적 특성을 확인하기 위하여 TGA, DTA를 분석하였으며, Fig. 2에 나타냈다. TGA 분석결과 약 730 ℃를 기준으로 구분되며, 730 ℃까지 질량이 약 30 % 감소 후 질량이 유지 되었다. DTA 분석 결과 80 ℃, 221 ℃, 256 ℃, 730 ℃에서 피크가 확인되었다. 300 ℃이하에서 발생되는 흡열 피크의 경우 MgAl2O4의 표면에 흡착되어 있는 물(surface, interlayer water) 증발에 따른 것으로 사료되며, 약 9% 질량이 감소하였다. 300~500 ℃ 범위에서 DTA 특별한 피크는 확인되지 않았으나 무게는 감소하는 것을 확인할 수 있다. 관련 문헌에 따르면 이는 수산화 층의 탈수산화(dehydroxylation)와 음이온(CO32-,OH-)의 교환에 의해 발생하는 것으로 보고된바 있으며18,19), 본 연구에서는 무의미한 피크로 판단된다. 그 외 혼합분말에 다량 존재하는 CaCO3의 열적특성 관련 논문에 따르면 CaCO3가 CaO와 CO2로 열분해됨에 따라 약 690 ℃에서 무게 감소가 일어나고 830 ℃에서 흡열 픽과 함께 무게감소가 멈추는 것으로 보고되었다20). 본 연구에서는 무게의 급격한(약 4.2%) 감소 온도는 약 690 ℃로 유사하나, 종료 온도가 730 ℃로 문헌과 상이하게 나타났다. 본 연구에서는 730 ℃에서 CaCO3와 블랙 드로스의 반응이 일어났을 것으로 판단하였으며, TGA/DTA 분석결과와 mayenite 합성 관련 문헌을 바탕으로 합성 온도 변수를 600, 700, 800, 900, 1,000 ℃로 설정하였다.
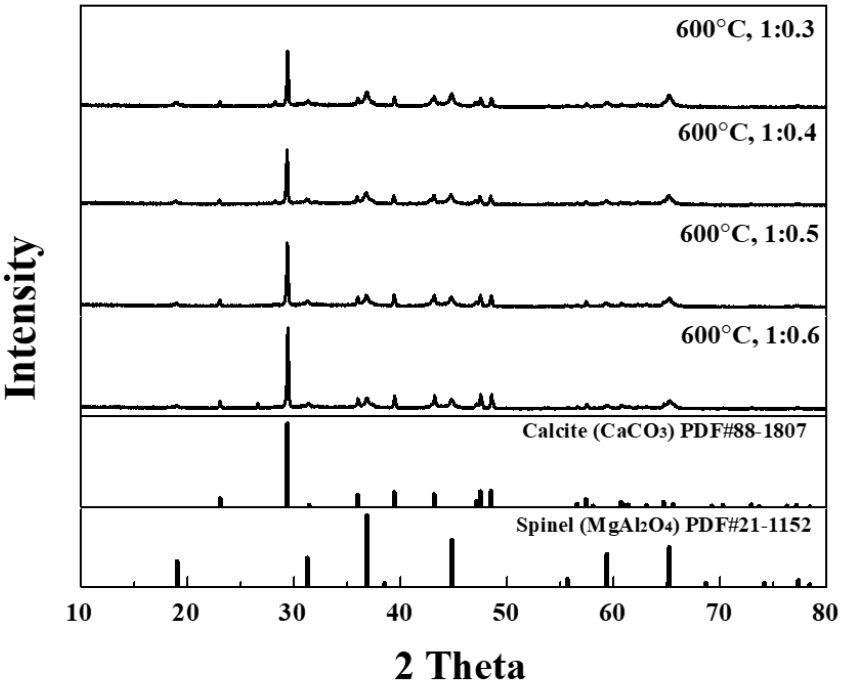
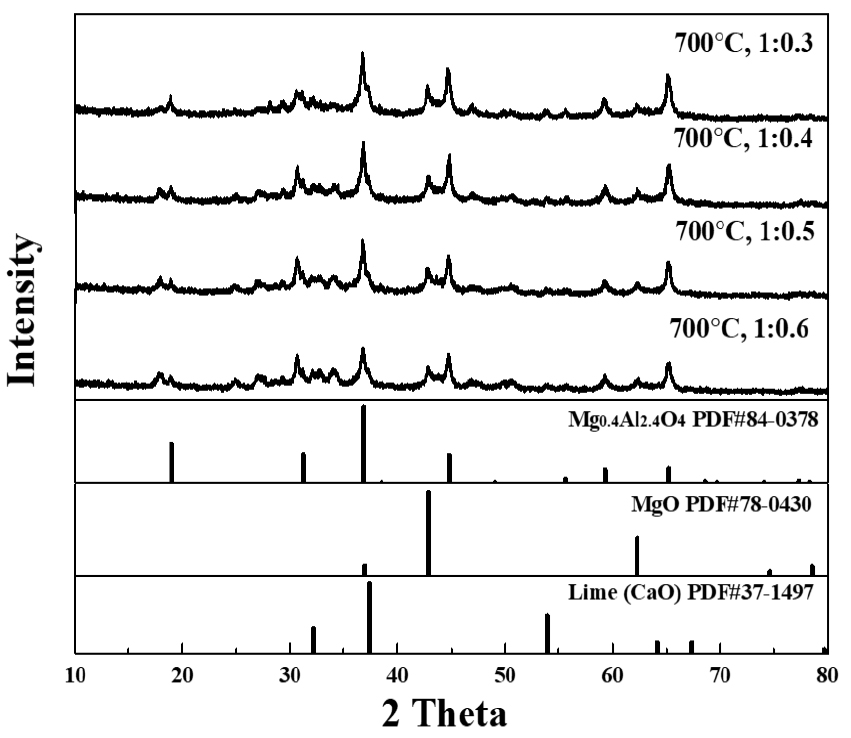
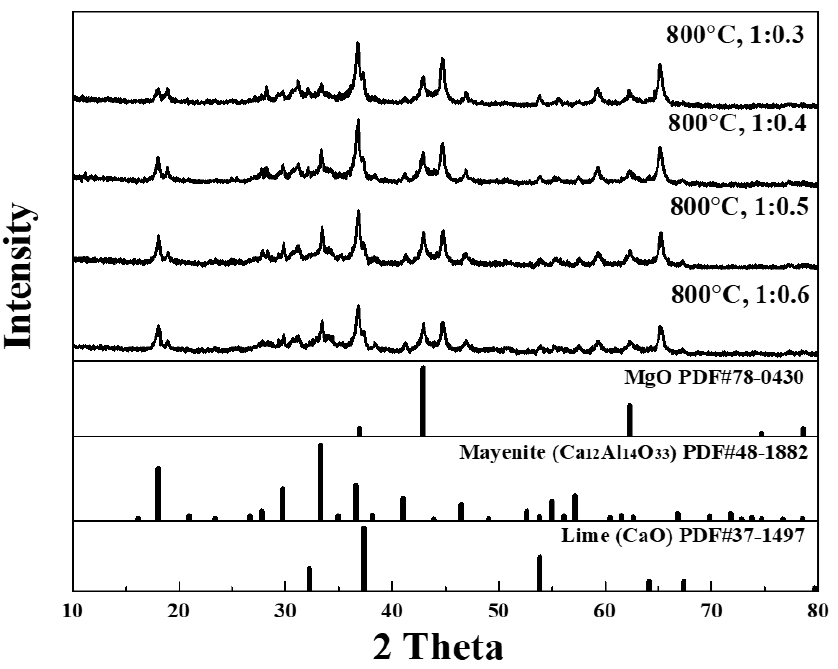
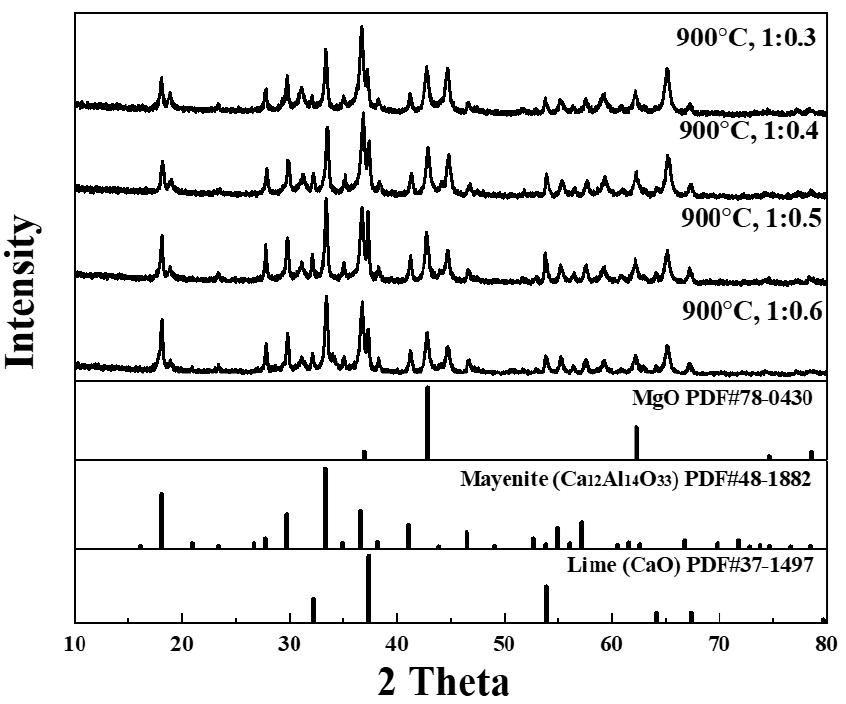
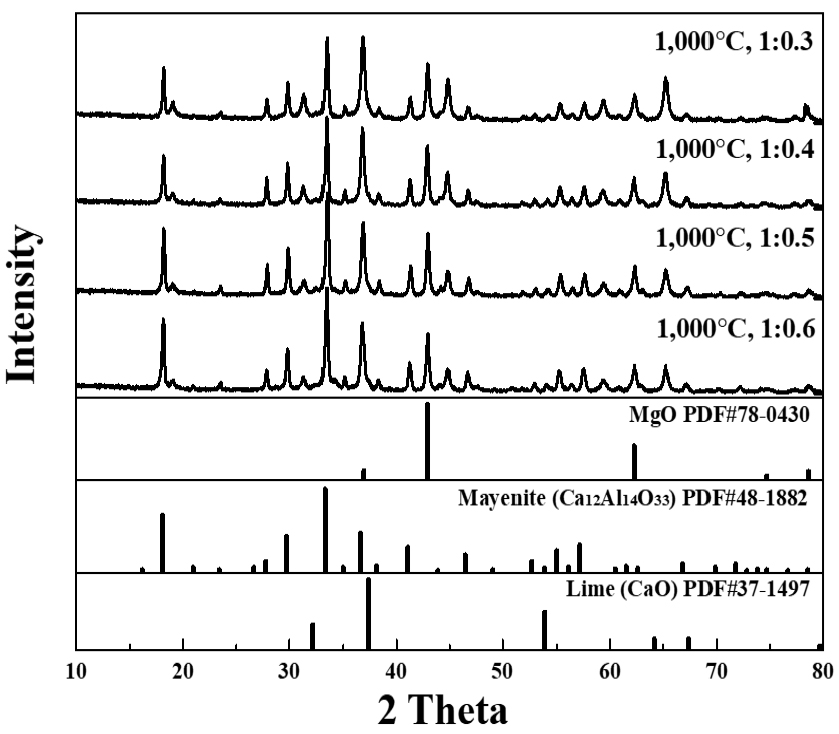
Figs. 3, 4, 5, 6, 7는 혼합 비율별 온도별 합성 시료의 XRD 분석결과를 나타냈다. Fig. 3 600 ℃의 경우 합성 후 분말의 색상이 백색으로 변화는 것을 확인할 수 있으나, XRD 결과 여전히 CaCO3와 MgAl2O4로 나타났다. 블랙 드로스 분말을 단독으로 하소하였을 때 역시 백색의 분말로 변하며 XRD 피크는 변화 없는 것을 확인하였으며, 이를 바탕으로 보았을 때, 600 ℃에서 색상 변화는 합성에 의한 것이 아닌 블랙 드로스 내 일부 금속 분말 산화 또는 유기물 제거에 의한 것으로 판단된다. Fig. 4 700 ℃에서는 Mg0.4Al2.4O4, CaO, MgO가 합성된 것을 확인 할 수 있다. 일반적으로 Mg0.4Al2.4O4는 MgAl2O4 합성에서 Mg 부족으로 생성되는 것으로 알려져 있다. MgAl2O4, CaCO3에서 CaCO3가 CaO와 CO2로 열분해 되는 과정에 MgAl2O4에 영향을 미치면서 Mg0.4Al2.4O4와 MgO로 열분해 된 것으로 판단된다. 이를 확인하기 위하여 블랙 드로스 분말을 단독으로 700 ℃ 이상에서 하소한 후 상 분석을 하였을 때 상변화는 없이 MgAl2O4로 존재하는 것을 확인하였다. Fig. 5 800 ℃에서는 Mayenite와 MgO, CaO, Mg0.4Al2.4O4가 확인되었다. Mayenite 형성에 Al, Ca가 참여함에 따라 Mg0.4Al2.4O4, CaO의 피크 세기 감소 및 MgO의 피크 세기 증가에 영향을 미쳤을 것으로 판단된다. Fig. 6 900 ℃에서 역시 Mayenite와 MgO ,CaO, Mg0.4Al2.4O4가 확인되었으며, 800 ℃ 비해 Mayenite의 피크 세기가 증가한 것으로 나타났다. 800 ℃에 비해 900 ℃ 합성 물질의 Mg0.4Al2.4O4는 감소하고 MgO 피크는 증가하는 것으로 확인되었다. 마지막 Fig. 7 1,000 ℃에서의 경우 Mayenite, MgO, Mg0.4Al2.4O4 피크가 존재하며, CaCO3 함량 높은 조건에서 CaO 피크가 낮게 확인되었다. 그 외 Fe2O3, MnO, CuO와 같은 기타 원소의 경우 상대적으로 미량 함유되어 있어 반응에 큰 영향을 미치지 않은 것으로 예상하였다. 가장 함량이 높은 Fe2O3의 경우 문헌에 따르면 CaCO3와 1175 ℃에서 반응하여 CaFe12O19가 되는 것으로 보고되었으며21), 본 연구에서는 XRD 피크 세기는 매우 약하지만 모든 조건에서 Fe2O3로 존재하는 것을 확인하였다. MnO, CuO의 경우 상변화가 일어났을 수 있으나 XRD로 상변화는 확인하기 힘들며, 미량인 만큼 전체 반응에 미치는 영향은 미미할 것으로 판단된다.
합성 비율에 대한 결과에서는 CaCO3함량이 높을수록 Mayenite 피크 세기가 높고 Mg0.4Al2.4O4 피크 세기는 낮게 나타나는 것으로 보이나 정량적 비교는 힘들 것으로 판단되었다. Mayenite합성에 있어서 온도가 주요 인자로 작용 하는 것으로 판단되며, MgAl2O4에서 Mayenite가 형성되는 과정에 Mg0.4Al2.4O4가 중간물질로 작용하여 Ca와 반응을 통해 Mayenite와 MgO를 형성하는 것으로 판단된다. 추후에 합성 온도 범위의 세분화와 물질들과의 반응에 대한 추가 고찰이 필요할 것으로 판단된다.
본 연구에서 합성 비율이 가장 높은 1:0.6 조건의 온도별 시료를 이용하여 형상 비교를 하였으며, Fig. 8에 나타내었다. 하소 전 드로스, CaCO3 분말은 특정한 형상을 지니고 있지 않았으며, 분말의 사이즈 역시 매우 불규칙하게 확인 되었다. 600 ℃하소 시료의 경우 하소 전 분말과 비교하였을 때 뚜렷하게 형상 변화를 확인하기 힘들었다. XRD결과에서는 600 ℃에서 여전히 MgAl2O4와 CaCO3가 존재하는 것으로 나타나며, 형상 분석에서 역시 비슷하게 나타난 것으로 판단된다. 700 ℃에서 역시 600 ℃와 뚜렷하게 형상 차이는 확인하기 힘들었으며, XRD 결과에서는 Mg0.4Al2.4O4, CaO, MgO가 확인되었다. 800 ℃의 하소 조건에서는 대부분 Mayenite 합성이 안 되었으나, 일부 작은 사이즈의 입자에서 문헌과 유사한 Mayenite 형상이 나타나는 것을 확인 할 수 있었다. 900 ℃에서 전체적으로 Mayenite가 확인되나 일부 미반응 물질이 확인되었다. 900 ℃합성 분말의 EDX Mapping 결과(Fig. 9), Mayenite 합성 물질(좌측 입자)의 경우 Al, O와 함께 Ca가 높게 나타나는 반면, 미반응 물질(우측 입자)의 경우 Ca가 상대적으로 낮게 나타나는 것을 확인할 수 있다. 1,000 ℃ 온도 조건에서는 Fig. 10과 같이 전체적으로 Mayenite가 확인되었으며, 입자 사이즈 역시 매우 다양하게 나타났다.
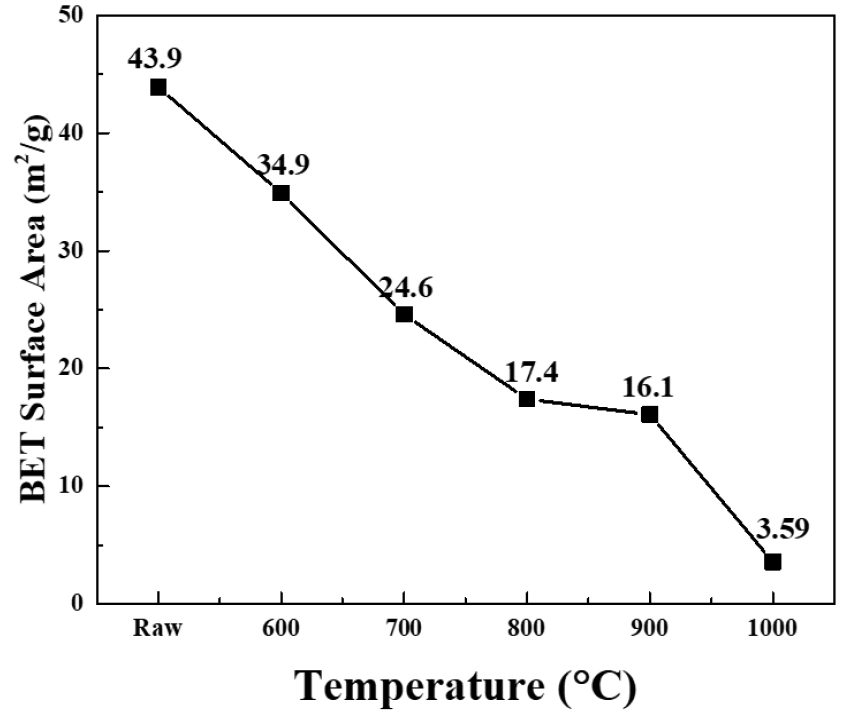
합성 온도에 따른 비표면 분석을 위하면 BET 분석을 실시하였으며, Fig. 11에 나타내었다. 합성전 혼합 분말의 경우 43.9 m2/g의 비표면적을 가지며, 합성온도가 증가함에 따라 34.9, 24.6, 17.4, 16.1, 3.59 m2/g로 감소하는 경향으로 확인되었다. Mayenite가 공극이 있음에 따라 비표면적이 증가 할 것으로 예상하였으나, 온도가 증가함에 따라 비표면적이 감소하는 경향을 보였다. 기존의 미세한 입자가 다른 상으로 합성됨에 따라 입자가 성장되고 이와 동시에 주변 입자와 응집으로써 전체적인 비표면적이 감소했을 것으로 판단된다. Mayenite 합성 관련 논문에서 역시 68.9 m2/g(600 ℃)에서 4.2 m2/g(1,000 ℃)로 감소하는 거동을 보였다22). 900 ℃와 1,000 ℃의 비표면적이 급격하게 감소하는 이유는 Mayenite의 합성율에 영향을 받았을 것으로 판단되며, 향후 합성율에 정량적 연구가 필요할 것으로 판단된다.
마지막으로 합성 분말(1:0.6)로부터 안전성을 판단하기 위하여 용출실험을 진행하였으며, 국내 폐기물 공정 시험기준에 따라 용출 시험 및 분석한 결과, 6가 Cr은 검출되지 않았다. 한편, Mayenite는 독성 중금속의 고정화 및 고형화/안정화(S/S) 특성이 높은 것으로 보고된 바 있다23).
4. 결 론
알루미늄 재활용 공정중 Flux 사용으로 인해 발생되는 블랙 드로스 내 산화물의 고부가가치화를 위한 내화재를 비롯한 기능성 세라믹 소재 합성 연구를 진행하였다. 내화재용 소재 Mayenite를 합성하기 위하여 블랙 드로스와 CaCO3를 혼합하여 조건별(배합 비 및 온도) 실험을 실시하였다. Mayenite는 800 ℃에서부터 생성되었으며, 온도가 증가함에 따라 Mayenite XRD 피크 세기가 증가하는 것을 확인하였다. SEM확인 결과 800℃에서 미세한 입자부터 Mayenite로 합성되기 시작하여 1,000 ℃에서 대부분의 입자가 Mayenite 형상을 띄는 것을 확인 할 수 있었다. 또한, 블랙 드로스와 CaCO3를 이용한 Mayenite 합성 시 Mg0.4Al2.4O4, CaO의 중간물질이 존재하는 것을 확인하였으며, 700 ℃부터 생성되어 합성에 참여하고 이는 MgO 형성에도 상호 영향을 주는 것으로 판단되었다. 비표면적 분석 결과 합성이 됨에 따라 43.9 m2/g(합성전 분말)에서 3.59 m2/g(1,000)으로 감소하였으며, 이는 입자 성장 및 입자간 응집에 의한 것으로 확인되었다. 합성 비율별 실험에는 CaCO3 함량이 증가함에 따라 Mayenite XRD 피크 세기가 증가 하였으나, 그 정도가 미비하였다. 블랙 드래스내 Al2O3의 함량 54.7 wt.%를 고려하였을 때 CaCO3 함량은 낮은 것으로 판단되었으며, 당량비로 계산하였을 때 블랙 드로스:CaCO3는 1:0.9의 비율이 적합할 것으로 계산되었다. 본 연구를 통하여 블랙 드로스내 산화물의 고부가가치화가 가능함을 확인하였다. 고순도가 요구되는 이온 흡착제, 촉매제 등에 적용하기 위해서는 불순물 제거 전처리 공정이 필요할 것으로 판단되며, Fe2O3, MgO, MnO 등이 상용 제품에도 함유되어 있는 시멘트, 내화제에는 적용이 가능할 것으로 판단된다. 향후 합성 조건 최적화 및 적용처에 따른 특성평가 연구가 이루어 질 예정이다.