1. 서 론
2. 연구방법
3. 실험결과 및 고찰
3.1. 폐형광체의 성상
3.2. 폐형광등 유리를 사용한 글래스비드의 제조 실험
3.3. 폐형광체의 산 침출 특성
3.4. 폐형광체로부터 희토류의 용매추출
4. 결 론
1. 서 론
희토류는 Table 1에서 보듯이 원자번호가 57(Lanthanum)부터 71(Lutetium)까지인 원소계열을 말하며, ⅢA 족의 원소군(La족 15가지 원소와 및 Scandium와 Yttrium)을 포함하여 총 17종이 희토류 원소(Rare earth element)로 총칭되고 있다1).
Table 1.
Periodic table
 *Source: IUPAC Recommendations, 2005, “NOMENCLATURE OF INORGANIC CHEMISTRY”2,3)
*Source: IUPAC Recommendations, 2005, “NOMENCLATURE OF INORGANIC CHEMISTRY”2,3)희토류는 자성재료, 전자 재료 등 첨단산업용 소재로 광범위하게 사용되고 있어 지속적으로 수요가 증가하고 있으며 그 내용을 Table 2에 나타내었다. 희토류 원소중 형광등 및 LED와 같은 조명용 광원에는 Y, La, Ce, Eu, Tb 등과 같은 물질들이 Phosphors 조성물질로 주로 사용되고 있다4,5,6). 희토류가 생산되는 지역은 매우 한정적이며 최근 들어 중국을 비롯한 희토류 생산국가에서 광물자원을 국가발전 전략을 수립하는 중요한 요소로 사용하고 있다. 희토류 자원은 확정매장량 기준으로 중국 36.5%, 독립국가연합 19.3%, 미국 13.2%, 호주 5.5% 등에 주로 분포되어 있다.
Table 2.
Rare earth applications
특히 경희토류인 네오디뮴(Nd)과 중 희토류인 디스프로슘(Dy)과 터븀(Tb)은 중국에서 거의 전량이 생산되고 있다.
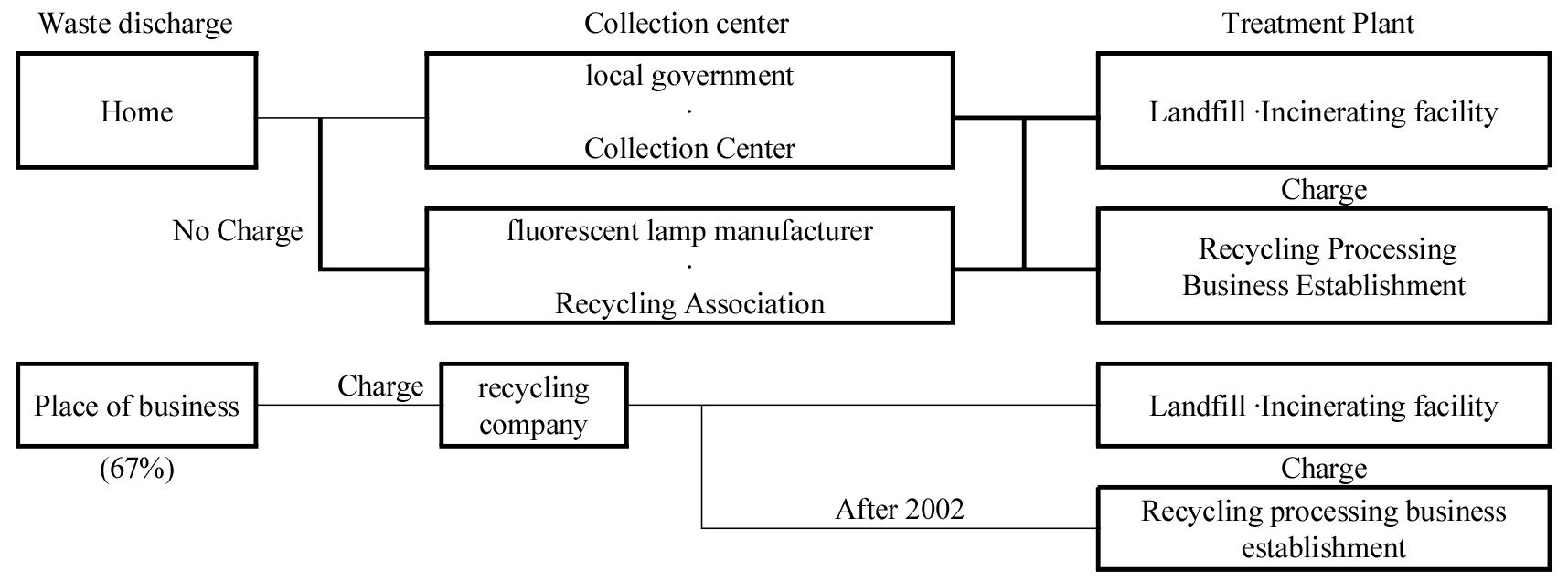
중국 외의 국가에도 희토류가 적지 않게 매장되어 있음에도 불구하고 생산량을 늘리지 못하는 이유는 희토류 원광의 추출 및 분리과정에서 발생하게 되는 환경오염 때문이다. 희토류 1톤 생산 시 약 8.5kg의 불소와 13kg의 분진, 그리고 960만~1,200만 리터의 폐수를 배출한다. 또한 분진, 폐가스, 플루오르화수소산, 이산화황, 황산, 약 75,000리터의 산성 폐수, 그리고 방사성 폐기물이 포함되어 있다. 특히 산성 폐수에는 다량의 중금속과 미량의 희토류 금속이 존재 한다7,8). Fluorescent lamp는 Light source인 자외선을 가시광선으로 바꾸어 주는 형광체가 유리관 내부에 도포하게 되는데, 1회에 6~7㎛ 씩 30㎛ 이상 될 때까지 6회 이상 반복적인 도포 작업 과정을 거친 후 600℃로 가열하여 코팅하게 된다9). 유리관 내부에 코팅된 Phosphor는 host lattice와 소량의 activator로 구성된다. 에너지를 빛의 형태로 방출하는 물질을 Phosphor라고 하며 이러한 전이 메커니즘을 Illuminant라고 한다. Host lattice가 특정 여기원으로부터 발생되는 에너지를 흡수하여 주변의 활성제로 에너지가 전달되면, 여기 상태로 전이된 전자가 바닥 상태로 전이되면서 에너지를 방출하게 된다10). 폐형광등을 구성하고 있는 유리, 알루미늄, 구리, 세라믹, 주석, 플라스틱, 납, 수은 및 희토류로 구성된 형광체 파우더와 같은 물질들은 적정 처리과정 없이 환경으로 배출시 오염물질로 작용하게 된다. 국내에서는 폐형광등의 불법폐기를 방지하기 위하여 폐형광등에 대하여“재활용촉진법시행령 제16조3항”의 의거 그 처리기준을 규정하고 있으며 Fig. 1의 구조로 폐형광등의 회수 및 처리체계가 확립되어 있다. 국내에서 폐형광등이 적정시설을 통해 처리되는 물량은, 환경부에 보고된 한국조명재활용협회 자료를 기준으로 2010년도에는 년간 3,570만개로 재활용율은 32.5%가 달성된 것으로 보고되고 있다11). 그러나 2012년도 이후부터는 처리비에 따른 업계 간 갈등이 발생하면서 전국적인 발생량은 2013년 60.4톤/일, 2014년 148톤/일, 2015년 48톤/일, 2016년 177.5톤/일, 2017년 147.2톤/일, 2018년 89.9톤/일 확인되고 있는데 비하여 폐형광등 재활용 업체의 처리실적은 2013년~2017년까지는 정확한 수량이나 물량이 확인되지 않으며 2018년 처리실적으로 148톤/년 정도만 확인되고 있다12,13).
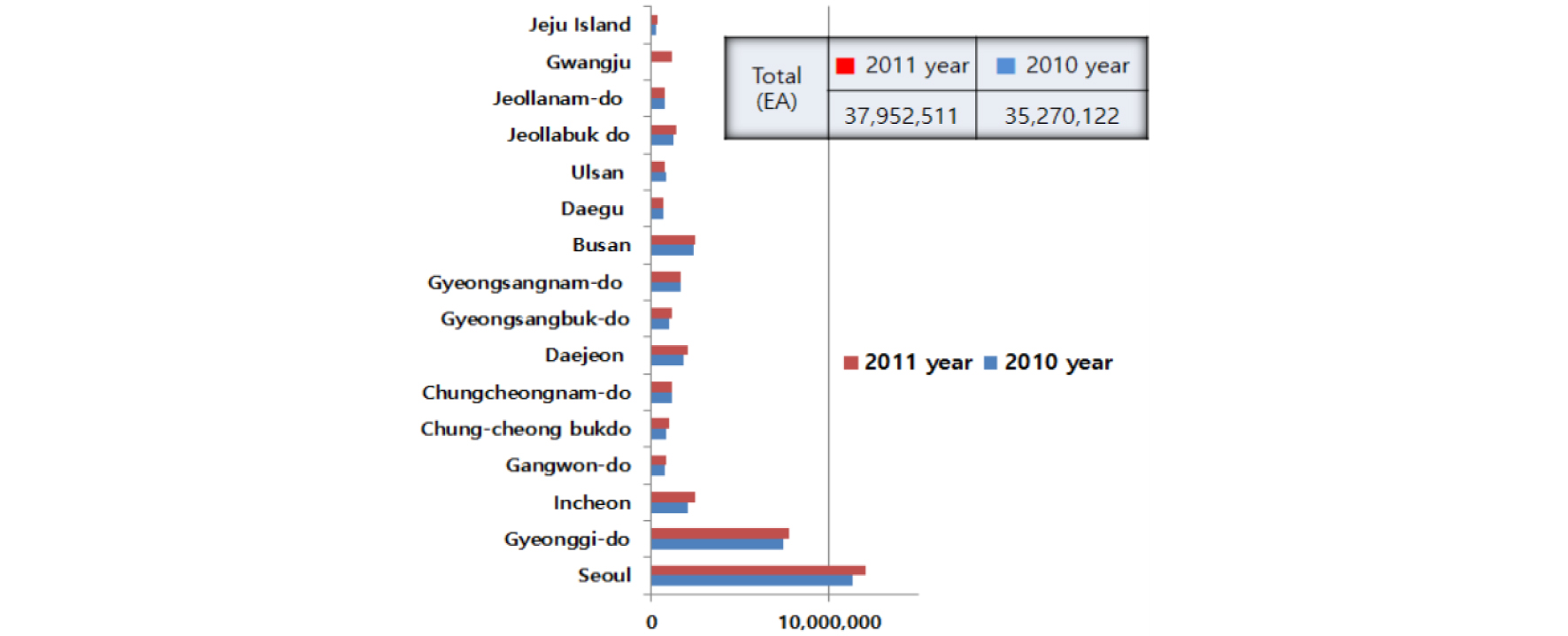
2010~2011년도 전국 지방자치단체별 처리현황으로 Fig. 2에서 폐형광등의 발생량은 2010년 35,270,122개에서 2011년 37,952,511개로 7.6% 정도 증가하였다. 서울시, 경기도, 인천시에서 발생되는 폐형광등을 거주인구 및 가구 수, 건축물 면적 단위로 산출하여 총산출량을 분석해 보면 연간 폐형광등의 배출량은 연간 19,064만개로 추산 되었다14).
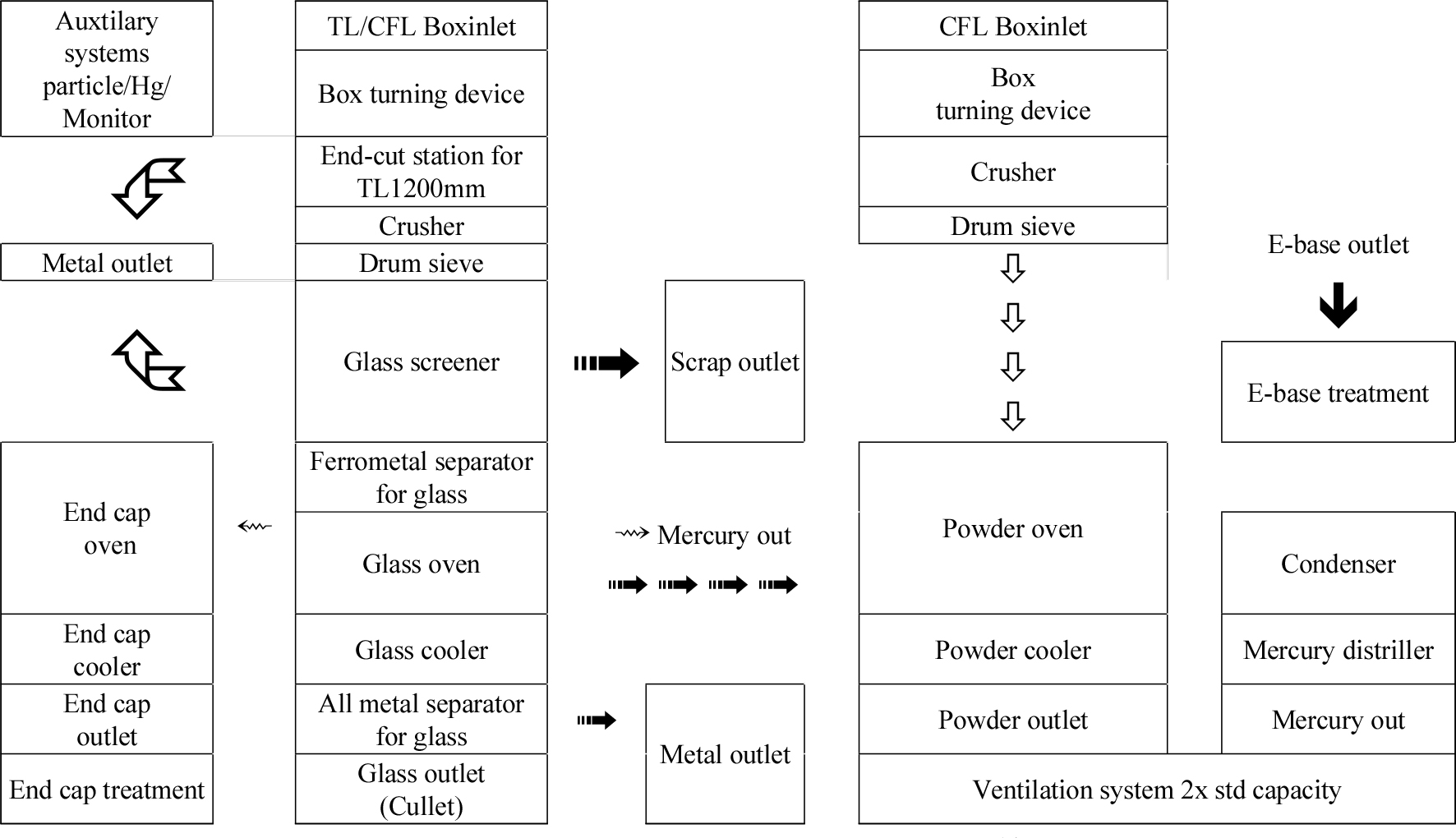
현재 조명시장은 형광등에서 LED 조명과 같은 반도체 조명으로 교체가 이루어지고 있는 과도기에 있다. 불법폐기를 줄이기 위하여 2007년 4월 “재활용가능 자원의 분리수거등에 관한지침”이 개정됨에 따라 사업장 폐형광등 재활용에 대해서는 정책적인 강화 및 인프라 지원 등 활성화를 위한 노력들이 이루어지고 있으나 가정(단독 또는 공동주택)에서 발생하는 폐형광등 분리수거 활성화를 위한 대책 마련은 여전히 미흡한 실정이다. 독일을 비롯한 선진국에서는 폐형광등에서 형광물질(Phosphor)을 별도로 분리하여 재활용하고 있으며 근래에 들어 형광물질의 가격도 급등하는 추세에 있어 국내에서도 폐형광등 재활용시 형광물질을 별도로 수거할 필요가 있다16). 현재 운영되고 있는 폐형광등 처리공정은 Fig. 3과 같으며 처리 후 발생 되는 물질 중 소량의 알루미늄과 약 60~80%에 달하는 유리 Cullet 만이 30~40원/kg의 가격으로 유상 판매되고 있을 뿐 나머지는 재활용사업장에서 지정폐기물 처리비용을 부담하여 처리하고 있다.
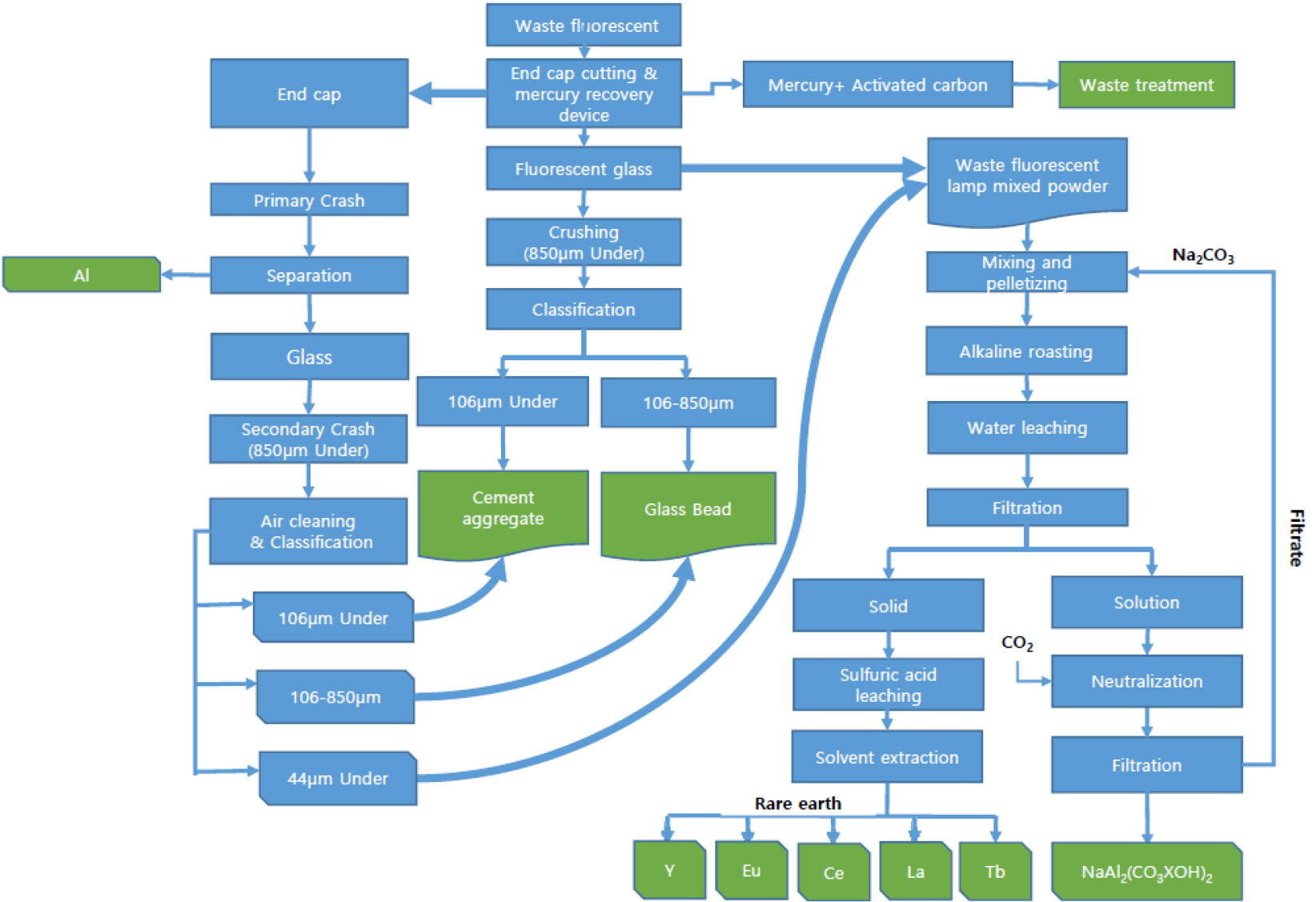
Fig. 3과 같이 기존 폐형광등 재활용설비를 사용하여 유리와 알루미늄 정도의 재활용 자원만을 회수할 경우 경제성이 매우 열악하여 2015년도에 형성된 기준가로 120원/개 미만으로 책정되어있는 EPR 보조금만으로는 폐형광등 재활용시설 공정운영이 정상적으로 지속하기 어려운 현실에 봉착하고 있다. 공정의 개선 방안으로는 처리비가 발생하는 폐형광체 등과 같은 부산물을 최소화하고 고부가가치화하는 것이 최선인 것으로 연구되고 있어13,17), Fig. 4와 같은 공정개선안을 도출하였다. 주요 내용은 엔드캡으로부터 알루미늄을 회수하여 판매하고, 선별 잔사인 유리는 비드용이나 시멘트용 골재로 활용하며, 유리는 Glass Beads 용 원료로 활용하고 폐형광체 분말로부터는 희토류를 추출하는 것을 주요 골자로 하고 있다. 본 연구에서는 폐형광등 유리의 Glass Beads용 원료로서의 사용 가능성 검토 결과, 폐형광체 분말로부터 희토류의 침출, 희토류 침출액으로부터 희토류의 용매추출 가능성 검토 결과에 대하여 논한다.
2. 연구방법
본 연구에 필요한 폐형광등 유리와 폐형광체 분말은 국내 폐형광등 처리 공정 운영사로부터 제공 받았다. 폐형광등 유리의 글래스비드용 원료로의 사용 가능성 판단을 위한 연구에서는 현재 Glass Beads용 원료로 사용 중인 유리 분말과 폐형광등 유리 분말을 106~850㎛의 크기가 되도록 분쇄한 다음 Glass Beads 제조공장에 시험 생산을 의뢰하여, 생산조건에 따른 수율과 입도분포 굴절률 등을 조사하였다. 폐형광체로부터 희토류 침출 연구에서는 탄산나트륨을 사용하여 배소한 폐형광체 분말과 배소하지 않은 폐형광체 분말을 황산용액으로 침출하여 희토류 원소별 침출 거동을 조사하였다. 용매추출연구에서는 소다배소한 폐형광체를 수침출하여 수용성의 알루민산나트륨과 미반응 탄산나트륨을 제거한 시료를 황산, 질산, 염산에 용해시켜 사용하였다. 용매추출제로는 D2EHPA, LIX84, Cyanex272, p507, Ionquest290 등 5가지 추출제를 사용하였으며 희석제로는 자이렌을 사용하였다. 폐형광체 분말 40g과 탄산나트륨 80g을 혼합한 다음 1000℃에서 2시간 동안 배소 후, 물 1리터와 혼합하여 2시간 동안 수 침출 조작을 수행하였다. 2차 여과 후 이때 발생하는 여액에 탄산가스를 불어 넣어 알루미늄과 규소를 침전시키는 실험을 수행하였다. 용해 잔사는 농도 3N 산으로 용해 후 여과하고 여액을 메스플라스크에 옮긴 다음 산의 농도가 3N인 수용액을 추가하여 1리터가 되도록 하여 용매추출용 시료 용액으로 사용하였다. pH 조절제로는 황산수용액과 수산화나트륨 수용액을 사용하였다. 실험결과는 ①에너지분산형엑스선분석기(Scanning Electron Microscope/Energy Dispersive Spectrometer/JSM-6300), ②고분해능 엑스선회절분석기(X-Ray Fluorescence Spectrometer, ZSX-100e), ③유도결합플라즈마 질량분석기(Inductively Coupled Plasma-Optical Emission Spectrometer/Model : 5110 VDV), ④고분해능 엑스선회절분석기(High Resolution X-Ray Diffractometer, D/Max-2500V)등의 장비를 사용하여 분석하였다.
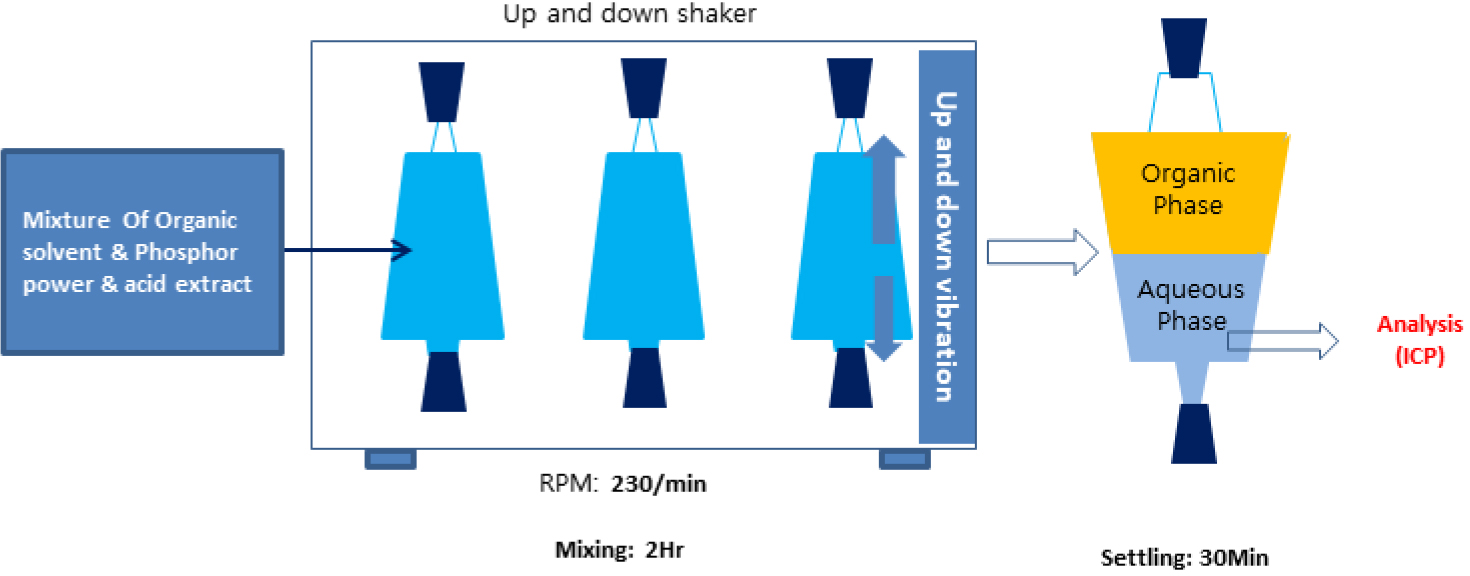
시료용액 10ml와 계산된 농도로 조절된 pH 조절제 수용액 90ml를 혼합하여 100ml의 수상을 제조하였다. 용매추출제 10ml와 희석제 90ml를 혼합하여 유상 100ml를 제조하고 두 용액을 500ml 용량의 분액여두로 옮기고 Fig. 5에 나타낸 상하진동식 진탕기를 사용하여 120분 동안 230rpm으로 진탕한 다음 30분간 정치 후 수상의 시료를 채취하여 잔류하는 희토류의 농도를 측정하였다. 수상에서 유상으로 이동한 비율 추출률은 식 (1)과 같이 계산하였다.
용매추출제의 중요한 척도로서 분배계수(Distribution ratio) 및 분리계수(Separation factor)의 결정은 목적금속의 추출률과 목적금속과 불순물과의 분리성의 척도를 나타내는데 일반적으로 사용되고 있다. 분배비(Distribution ratio:D)는 다음과 같이 정의된다,
| $$D=\frac{CMO}{CMA}$$ | (2) |
CMO는 평형상태의 유기상 중의 금속농도 CMA는 평형상태의 수용액상 중의 금속농도를 나타낸다. 두 금속성분의 분리성의 척도를 나타내는 분리계수(Separation factor)는 다음과 같이 정의된다.
| $$\beta=\frac{D1}{D2}$$ | (2) |
D1 및 D2는 분리하고자 하는 두 금속의 분배비이며 β값이 1000 이상인 경우 1회의 추출조작으로 두 금속이 용이하게 분리 가능하며 β값이 100 정도의 경우 향후 다단 추출에 의해 용이하게 분리가 가능하다. β값이 10 이하인 경우 추출 단수의 증가 및 세정공정을 설계 분리가 가능하다18,19,20).
3. 실험결과 및 고찰
3.1. 폐형광체의 성상
폐형광체의 성상을 관찰하기 위하여 XRF, SEM, XRD 분석 등을 실시하여 그 결과를 Table 3과 Fig. 6 그리고 Fig. 7에 각각 나타내었다.
Table 3.
Chemical composition of waste phosphor powder from fluorescent lamps
| Contents | Y2O3 | Al2O3 | SiO2 | CaO | P2O5 | CeO2 | BaO | MgO | Na2O | Eu2O3 | Tb4O7 | La2O3 |
| Wt.% | 28.9 | 27.0 | 14.6 | 6.83 | 3.62 | 3.46 | 2.53 | 2.60 | 2.51 | 1.95 | 1.76 | 1.43 |
Table 3의 XRF 분석결과에서는 폐형광체의 주요 구성 성분이 Y2O3, Al2O3와 SiO2이며 희토류 중에는 산화이트륨이 29.1%로 가장 많이 함유되어 있다. 그 다음으로 산화세륨이 3.49%, 산화유로퓸 1.98%, 산화터븀 1.77%, 산화란탄 1.47% 순으로 함유되어 있으며 이 농도는 회수 및 정제 시 경제성이 충분함을 보여 준다.
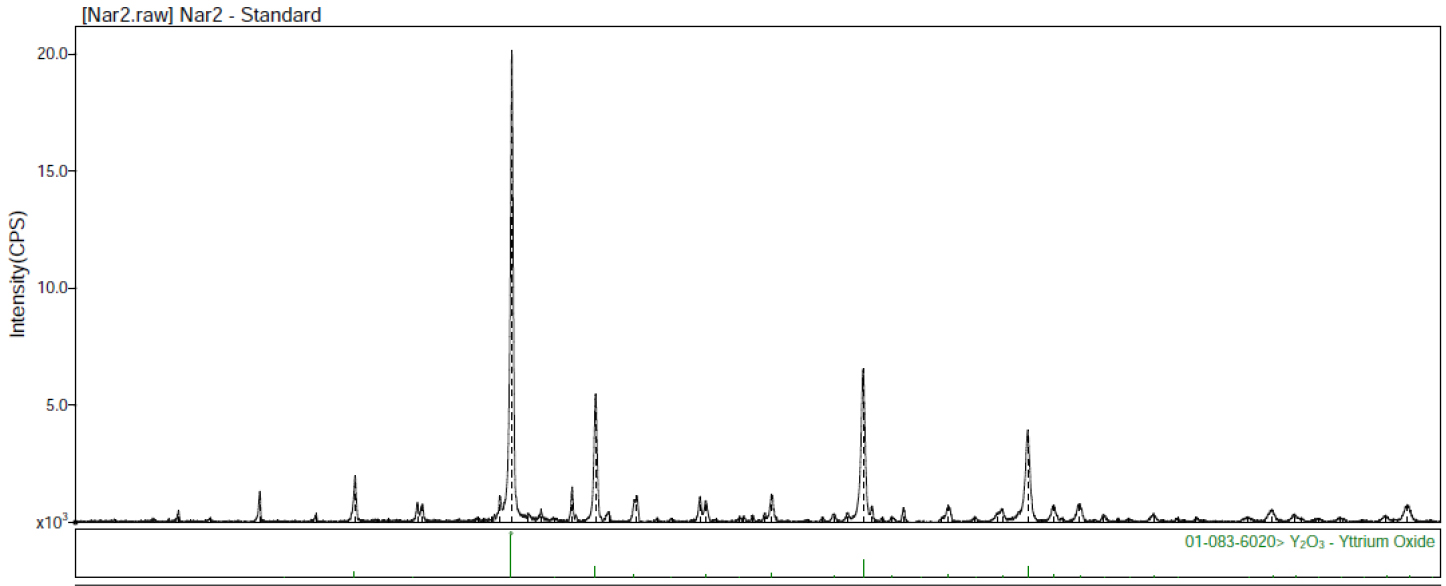
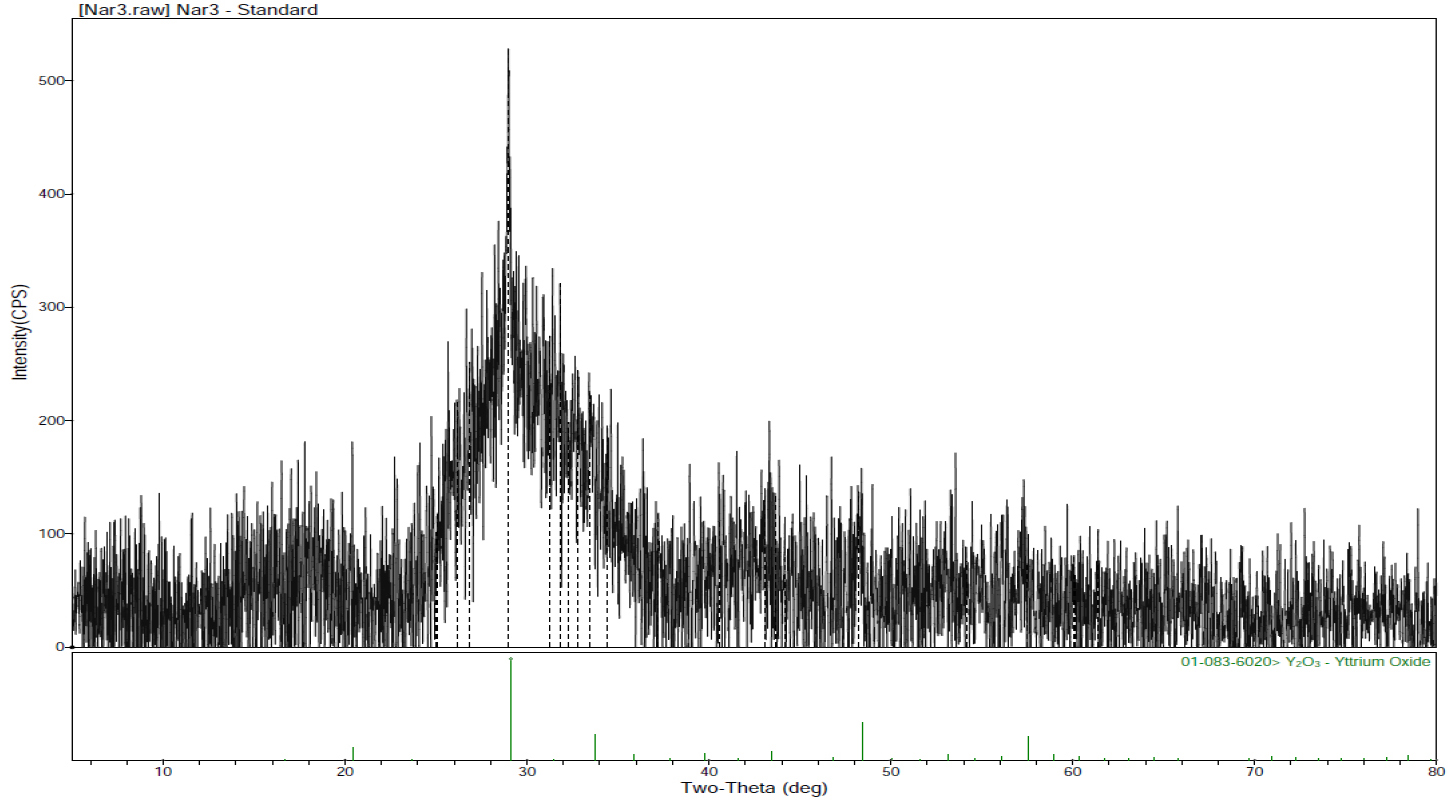
Fig. 6의 SEM 사진에서는 폐형광체가 0.05~0.3㎛ 크기의 1차 입자들로 구성된 5~15㎛ 크기의 응집 입자임을 알 수 있다. Fig. 7의 XRD패턴에서는 폐형광체의 주요 구성물이 Yittrium oxide임을 알 수 있으며, Table 3의 XRF 분석결과에서 SiO2가 13.8% 존재함에도 불구하고 SiO2와 관련된 피크가 전혀 존재하지 않는 것은 그 물질들이 비정질 상태로 존재하기 때문으로 생각된다.
3.2. 폐형광등 유리를 사용한 글래스비드의 제조 실험
수도권에서 배출되는 직관형(FL) 폐형광등을, 재활용 전문업체 운영설비에서 폐형광등의 수은이 제거된 유리를 사용하여, Fig. 8과 같은 공정과정을 거쳐 분석 시료를 제조 연구하였다.
폐형광등 유리의 글래스비드용 원료로의 사용 가능성 판단을 위한 시험 생산에서 공기혼합비율과 분출속도를 변화시키면서 수율의 변화를 측정하고 일반유리를 원료로 사용한 경우와 비교한 결과 폐형광등 유리를 사용하여도 Table 4와 같이 생산수율이 평균 82~88%로 유사한 결과를 확인하였다.
Table 4.
Bead production rate (recycled glass) by Air mixing, Temperature, Blowout speed
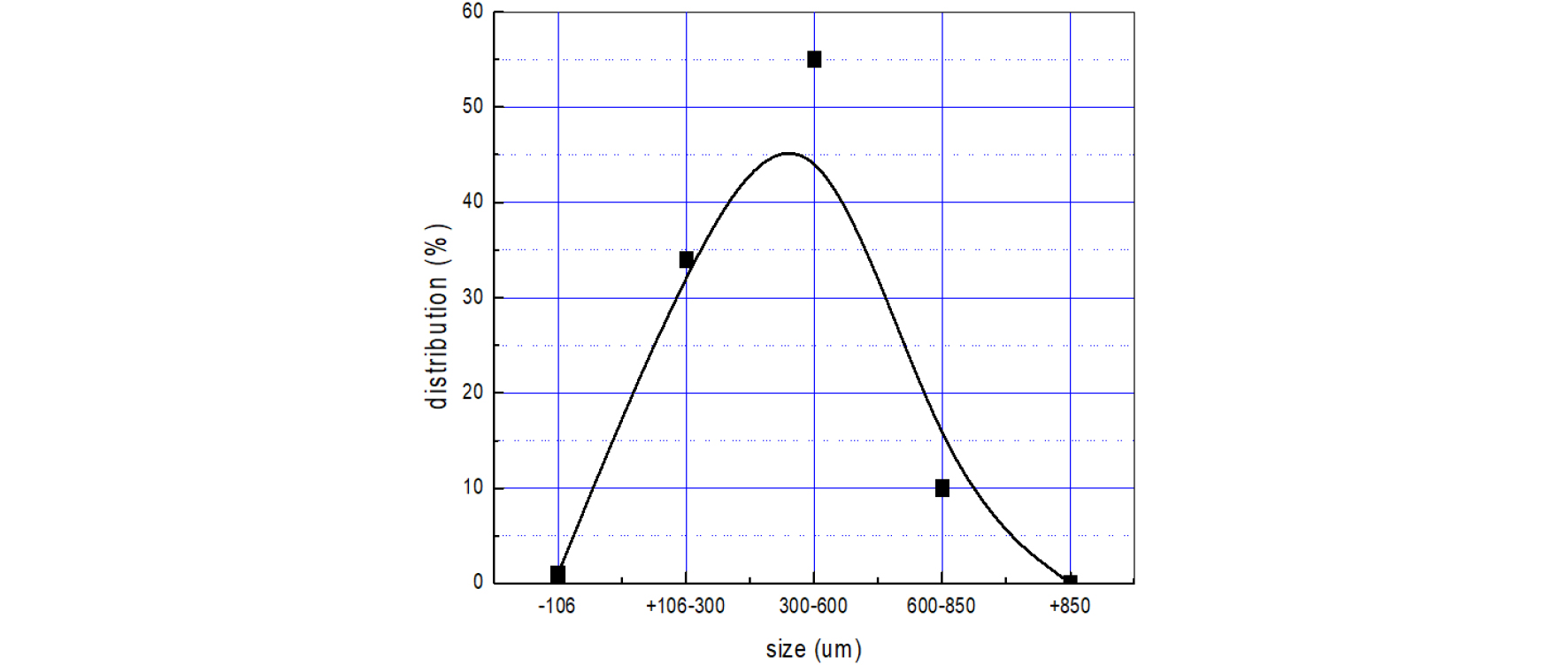
입도 분포는 Fig. 9과 같이 106~850㎛ 범위의 입도분율이 99%에 달하여 KS규격을 만족하였다. Fig. 10의 SEM 사진에서와 같이 구형화도가 거의 완벽하고 깨지거나 변형된 글래스비드는 관찰되지 않았다. 뿐만아니라 굴절률의 경우는 침액을 활용한 측정방식(KS L2521)으로 전문기관 측정 학인 결과 일반 유리의 1.50~1.64(평균 1.57) 보다 우수한 1.64~1.80(평균 1.7) 이상을 나타내었다. 이상의 결과에서 폐형광등 유리를 글래스비드용 원료로 사용할 수 있을 것으로 판단되며, 그 상품성과 제조공정의 경제성을 향상시키기 위한 보다 구체적이고 상세한 연구가 필요하다고 생각된다.
3.3. 폐형광체의 산 침출 특성
폐형광체에 함유되어 있는 5종의 희토류, 즉 Y, Eu, Ce, La, Tb의 산침출 거동을 조사하기 위하여 탄산나트륨을 사용하여 배소한 폐형광제 분말과 배소하지 않은 폐형광체 분말을 황산으로 침출하는 실험을 수행하였다.
Fig. 11은 배소한 폐형광체의 XRD패턴이다. Fig. 7 XRD패턴에 나타낸 배소 전 패턴과 비교하여 볼 때 산화이트륨의 피크만이 약간 남아있으며 그 또한 결정화도가 매우 낮은 비정질에 가까운 상태임을 알 수 있다.
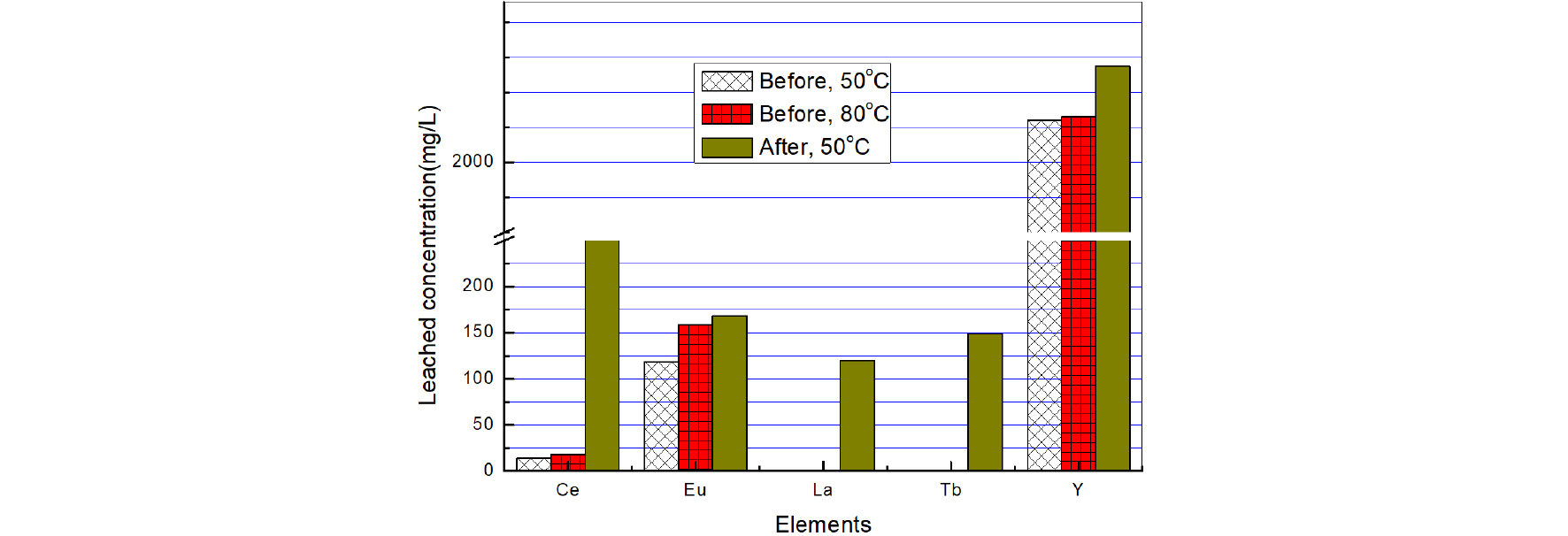
Fig. 12는 배소한 폐형광체의 SEM 사진이며 사진이 중앙 부위에 배소 과정에서 생성하여 성장한 것으로 보이는 결정질 물질이 형상이 뚜렷이 관찰된다. 이물질은 XRF분석결과인 Table 3에서 폐형광체 성분인 Al2O3, Na2O 등과 배소 혼합제로 생성된 알루민산나트륨일 것으로 추정된다. 그 특유의 조해성으로 인해 분쇄와 XRD 분석과정에서 비정질화 하여 Fig. 11의 회절 패턴에 그 회절선은 나타나지 않은 것으로 생각된다. 배소 전후의 산 침출 거동을 나타낸 Fig. 13의 결과에서 소다배소 한 폐형광체로부터 용출된 희토류의 농도가 Y 2275mg/L, Ce 275mg/L, Eu 168mg/L, Tb 149mg/L, La 122mg/L를 나타내었으며, Table 3의 화학조성으로부터 계산하면 5종의 희토류 원소가 모두 거의 100% 침출되었음을 알 수 있다.
배소하기 전 시료를 50℃에서 0.3N 황산수용액으로 3시간 동안 침출한 경우는 이트륨이 약 93%, 유로퓸이 약 70% 그리고 세륨이 약 5% 침출되었으며 터븀과 란탄은 전혀 침출되지 않았다. 동일 조건에서 온도만을 80℃로 변화시킨 경우는 이트륨의 침출률은 거의 변하지 않았으나 유로퓸의 침출률은 약 94%로 증가하였고, 세륨의 침출률도 약 7%로 증가하였다. 이상의 결과에서 5종의 희토류를 모두 회수하고자 할 경우는 소다배소 후 침출하는 것이 유리하지만21), 이후 정제공정에 따라서는 배소하지 않은 상태로 1차 침출 후 침출 잔사만을 소다배소 한 다음 2차 침출을 행하는 방안도 고려할 수 있을 것으로 생각된다. 배소하지 않은 폐형광체 10g과 증류수 900ml가 혼합되어있는 반응용액에 농도가 3N인 황산을 100ml 첨가하여 침출 반응을 3시간 진행 시켰으며, 3시간 동안 침출된 이트륨, 유로퓸, 세륨, 란탄, 터븀의 침출 농도를 측정하였다. 이때 반응온도를 50℃와 80℃로 변화시켜 침출률 변화를 조사하였으며 그 결과를 Fig. 13에 나타내었다. 아울러 소다배소의 영향을 비교하기 위하여 폐형광체 10g과 탄산나트륨 20g을 혼합하고 1000℃에서 2시간 동안 배소한 다음 1리터의 증류수로 수침출하여 알루민산나트륨과 잔류 탄산나트륨 등 가용성 알칼리물질을 여과하여 제거하였으며 용해 잔사를 3N인 황산 100ml와 증류수 900ml와 혼합하여 50℃에서 3시간 동안 침출 반응을 진행하였다.
3.4. 폐형광체로부터 희토류의 용매추출
용매추출연구에서는 소다배소 한 폐형광체를 수침출하여 수용성의 알루민산나트륨과 미반응 탄산나트륨을 제거한 시료를 황산, 질산, 염산에 용해시킨 용액을 용매추출 시험용 시료로 사용하였다. 용매추출제로는 D2EHPA, LIX84, Cyanex272, p507, Ionquest290 등 5가지 추출제를 사용하였으며 희석제로는 자이렌을 사용하였다. 폐형광체 분말 40g과 탄산나트륨 80g을 혼합한 다음 1000℃에서 2시간 동안 배소하고 배소 시료를 물 1리터와 혼합하여 2시간 동안 수침출 조작을 수행하였다. 수침출 조작은 실제 공정에서 산 소비량을 최소화하기 위한 것이며 수침출이 완료된 다음 여과하고, 이때 발생하는 여액에는 탄산나트륨이 잔류하므로 이를 재사용하기 위하여 탄산가스를 불어 넣어 알루미늄과 규소를 침전시키는 실험을 수행하였다.
3.4.1. XRD분석
여과 세척된 수침출 공정의 잔사를 3N 농도의 황산, 질산, 염산 중 한 가지 산으로 용해 후 여과하고 여액을 메스플라스크에 옮긴 다음 산의 농도가 3N인 수용액을 추가하여 1리터가 되도록 하여 용매추출용 시료 용액으로 사용하였다. pH 조절제로는 황산수용액과 수산화나트륨 수용액을 사용하였다.
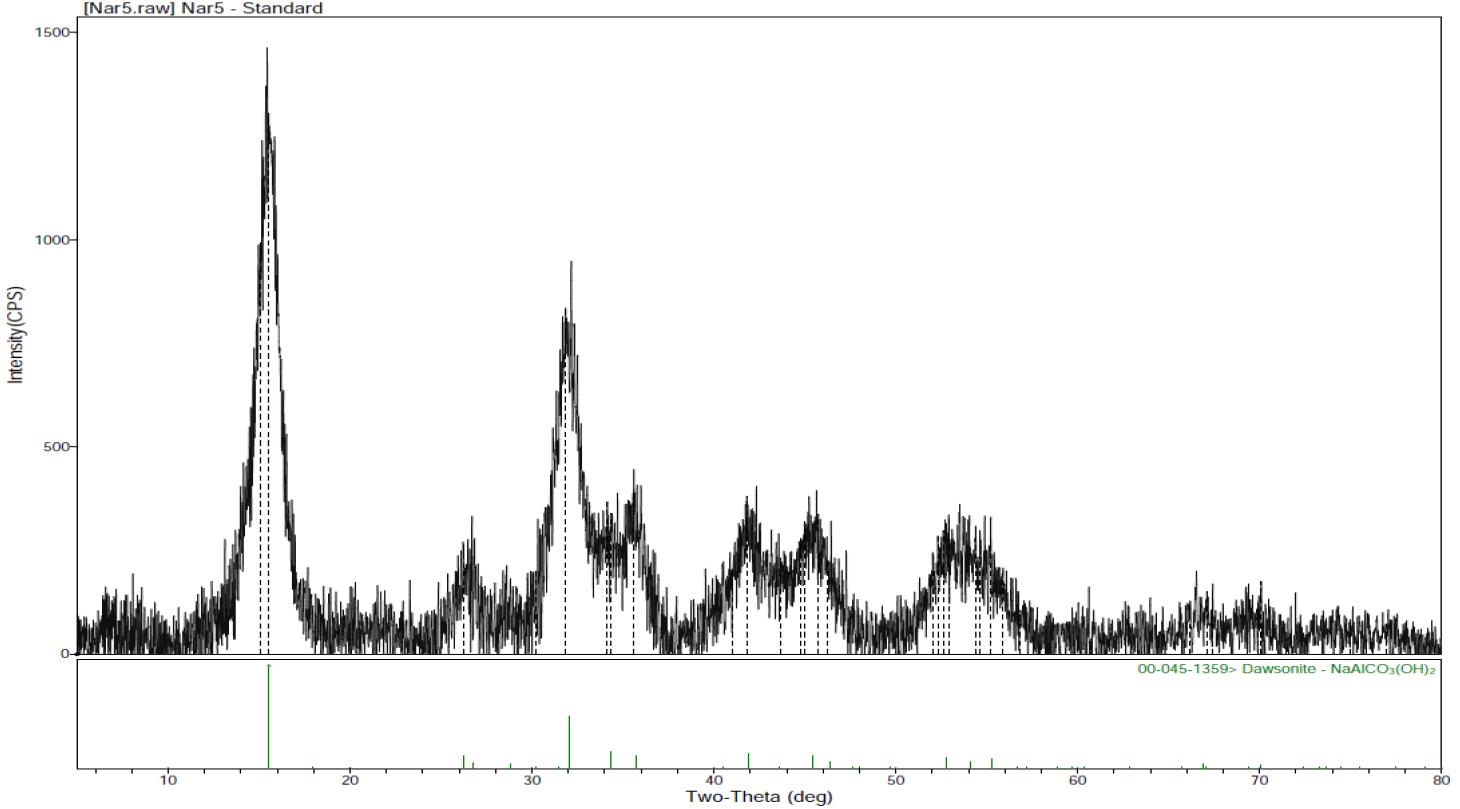
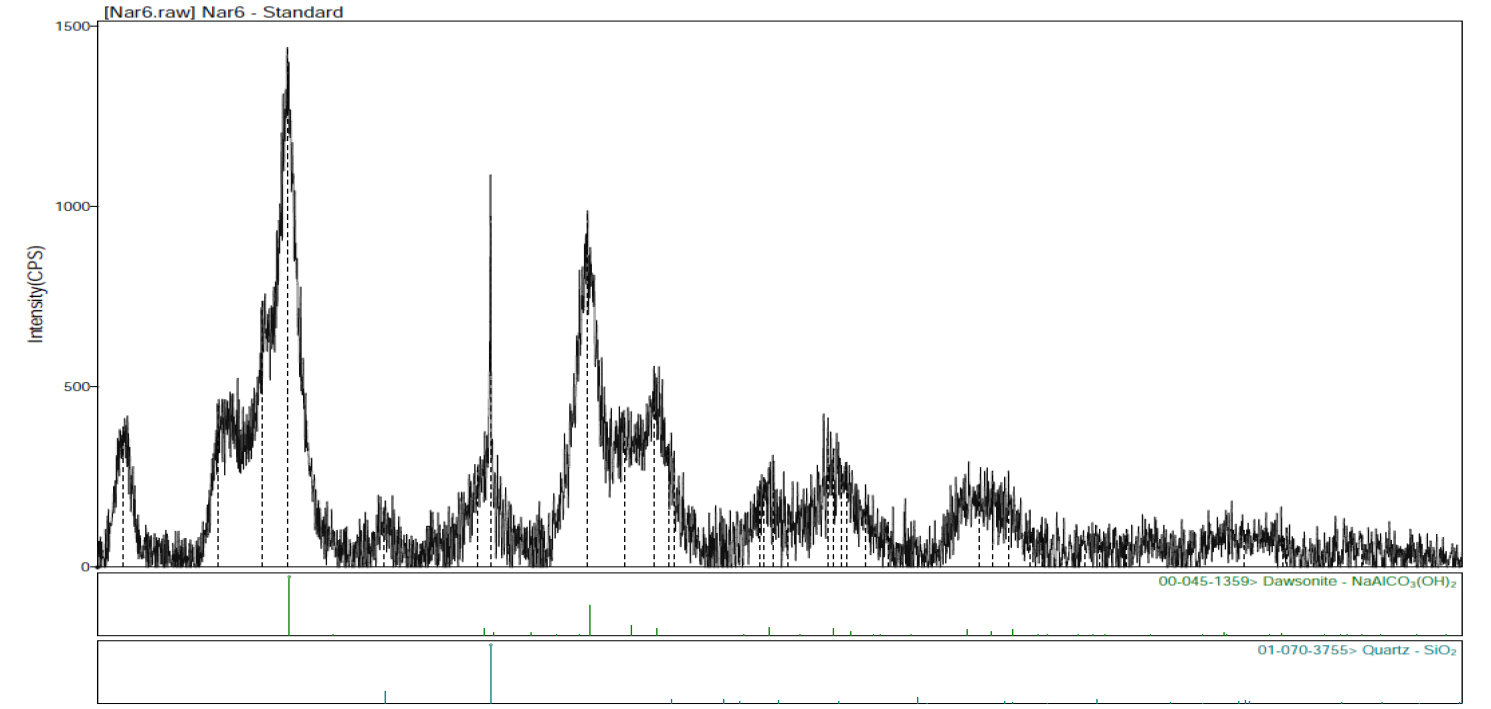
시료용액 10ml와 계산된 농도로 조절된 pH 조절제 수용액 90ml를 혼합하여 100ml의 수상을 제조하였으며, 용매추출제 10ml와 희석제 90ml를 혼합하여 유상 100ml를 제조하고 두 용액을 500ml 용량의 분액여두로 옮기고 상하진동식 진탕기를 사용하여 120분 동안 230rpm으로 진탕한 다음 30분간 정치 후 수상의 시료를 채취하여 잔류하는 희토류의 농도를 측정하였다. Fig. 14는 침출용액에 탄산가스를 불어넣는 과정 중 수용액의 pH가 10까지 떨어졌을 때 생성된 침전을 회수하여 XRD 패턴을 조사한 것이다. Fig. 14에서 NaAl2(CO3)(OH)2의 회절선 강도는 거의 변화가 없으나 SiO2의 회절선이 강도가 매우 강하여졌으며, 5° 부근에서 Sodium alumino silicate로 추정되는 회절선도 관찰되었다. 이 침전의 무게와 화학조성 그리고 배소 원료의 화학조성으로부터 투입된 Al2O3의 약89%와 SiO2의 72%가 pH 7에서 침전함을 알았다. 상기 침전들을 여과하여 제거한 여액에는 탄산수소나트륨이 매우 풍부한 상태가 되며, 이 수용액을 가열하면 잉여 탄산가스가 분해되어 휘발하고 수용액은 탄산나트륨 수용액이 되므로 소다배소용으로 재사용할 수 있을 것으로 판단 된다.
일반적으로 알루민산나트륨 수용액을 산으로 중화하면 pH 10 이하에서 Al(OH)3가 침전하지만 탄산가스를 불어넣은 본 실험에서는 결정성이 불량한 NaAl2(CO3)(OH)2와 SiO2가 침전하였다. 탄산가스를 계속하여 불어 넣어 용액의 pH를 7까지 떨어뜨리고 이때 생성한 침전을 여과하여 건조 후 무게를 측정하고 XRD분석을 하여 그 결과를 Fig. 15에 나타내었다.
3.4.2. 용매추출율 분석
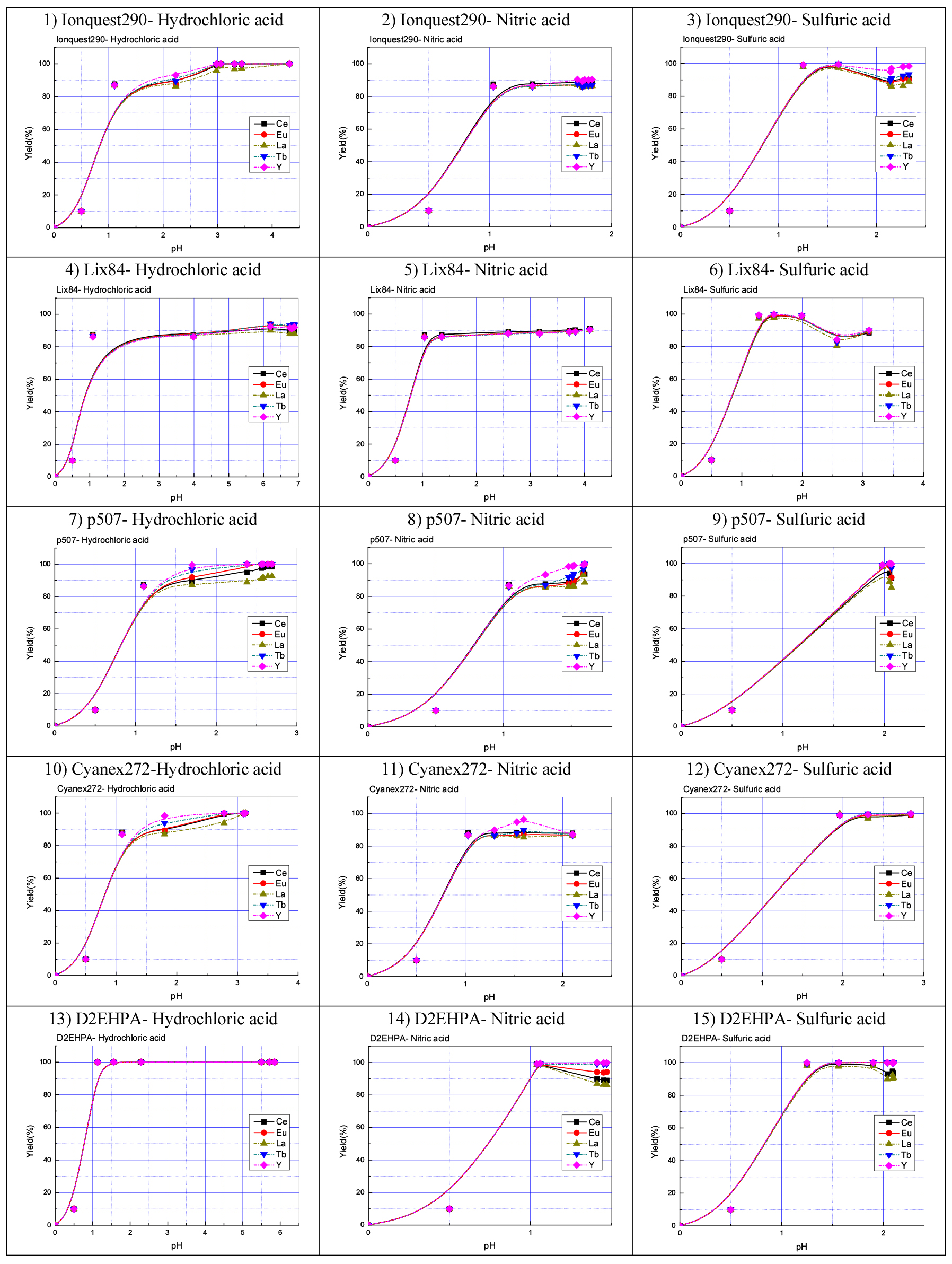
5종의 용매추출제와 3종의 산에 대한 추출율을 나타낸 Fig. 16의 결과에서 시험된 15개의 조건 모두에서 공통적으로 pH 2 이상에서 추출율은 80% 이상을 나타내었으며, pH 0.5에서 20% 이하를 나타내어 5종의 희토류 모두 시험된 조건에서 유기상으로의 이동 즉 추출율은 양호한 것을 알 수 있다.
그 중에서도 1) Ionquest290-hydrochloric acid, 3) Ionquest290-sulfuric acid, 7) p507-hydrochloric acid, 10) cyanex272-hydrochloric acid, 12) cyanex272-sulfuric acid, 13) D2EHPA -hydrochloric acid, 14) D2EHPA-sulfuric acid 조합에서는 추출률이 100%에 가깝다. 그러나 동일 조건에서의 원소별 추출률 차이, 즉 선택성은 대체로 불량하였으며, 가장 양호한 7) p507-hydrochloric acid 조합에서조차 최대 추출률 차이가 16% 정도로 불량하였다. 이 정도의 선택성에서는 10단 이상의 추출공정이 필요하게 되며, 공정의 경제성은 매우 나빠질 것으로 판단된다. 따라서 추후 보다 경제적인 추출조건을 찾기 위한 연구가 필요하다.
4. 결 론
폐형광등 처리 공정의 경제성 확보를 위하여 폐형광등 유리의 비드용 원료로서의 사용 가능성, 폐형광체 분말로부터 희토류의 침출, 희토류 침출액으로부터 희토류의 용매 추출 가능성 등을 검토한 결과는 다음과 같다.
1. 비용을 들여서 폐기물로 처리하고 있는 폐형광체의 주요 구성성분 중 산화이트륨이 28.9%로 가장 많이 함유되어 있고, 그 다음으로 산화세륨이 3.46%, 산화유로퓸 1.95%, 산화터븀 1.76%, 산화란탄 1.43% 순으로 함유되어 있어 회수 및 정제 시 경제성이 충분할 것으로 판단되었다.
2. 폐형광등 재활용공정 후 가공 처리된 Cullet 상태 Glass로 30~40원/kg 정도의 저가로 판매 하고 있는 폐형광등 유리를 사용하여 글래스비드를 시험 생산 한 결과 그 생산수율이 90% 이상으로 입도 분포가 KS 규격을 만족하였으며, 굴절률이 1.64~1.80(평균 1.7)으로 우수하여 폐형광등 유리를 보다 고품위의 글래스비드용 원료로 사용할 수 있을 것으로 판단되었다.
3. 배소하기 전 시료를 50℃에서 0.3N 황산수용액으로 3시간 동안 침출한 경우는 이트륨이 약 93%, 유로퓸이 약 70% 그리고 세륨이 약 5% 침출되었으며 터븀과 란탄은 전혀 침출되지 않았다. 소다배소 한 다음 산침출을 행하면 5종의 희토류 원소가 모두 거의 100% 침출 되었다.
4. 소다배소한 폐형광체를 수침출하면 알루미늄과 규소성분 및 잔류탄산나트륨 등이 용해하며, 이 수용액에 탄산가스를 불어 넣어 pH를 7 정도로 떨어뜨리면 NaAl2(CO3)(OH)2와 SiO2 등이 침전하며 그 량은 투입된 Al2O3의 89%와 SiO2의 72% 정도이며 이들을 제거한 수용액에는 탄산수소나트륨이 풍부하여 소다배소용으로 재사용할 수 있을 것으로 판단 되었다.
5. 자이렌을 희석제로 사용하는 cyanex272-hydrochloric acid, cyanex272-sulfuric acid, D2EHPA- hydrochloric acid, D2EHPA-sulfuric acid, Ionquest290-hydrochloric acid, Ionquest290-sulfuric acid, p507-hydrochloric acid 조합의 용매추출에서 Y, Eu, Ce, La, Tb의 추출률이 100%에 가깝다. 그러나 동일 조건에서의 원소별 추출률차이, 즉 선택성은 16% 이하로 향후 각 원소별로 선택성을 갖는 보다 경제적인 원소별 추출조건을 찾기 위한 연구가 필요하다.