1. 서 론
2. 실험 방법
3. 실험 결과 및 고찰
3.1. 합성루타일의 염화반응
3.2. 일반 루타일과 합성 루타일의 염화반응 속도 비교
3.3. Cl2와 CO가스 분압비의 영향
3.4. 염화반응 속도에 미치는 반응온도의 영향
3.5. 속도론적 해석
4. 결 론
1. 서 론
타이타늄은 지각 구성 원소 중 아홉 번째로 풍부한 원소이며, 구조용 금속으로서는 알루미늄, 철, 마그네슘에 이어서 네 번째로 풍부한 원소로서 많은 광물 중에 존재한다1). 타이타늄과 관련된 공업제품은 안료로 사용되는 TiO2와 금속인 스펀지 타이타늄이 주류를 이루고 있다2). 이러한 안료급의 TiO2나 금속 타이타늄을 제조하기 위해서는 타이타늄 광석으로부터 순수한 TiCl4를 제조하여야 한다.
TiCl4를 제조하기 위한 주요 원료는 천연 루타일(rutile, TiO2 함유량 95~100%)과 일메나이트(ilmenite, FeTiO3, TiO2 함유량 40~65%)로부터 제조되는 합성 루타일, TiO2 슬래그 등이 있다. 천연 루타일의 경우 TiO2 함유량이 95 % 이상으로 높기 때문에 별도의 공정 없이 TiCl4를 제조할 수 있으나, 특정 지역에만 편재되어 매장되어 있으며3), 타이타늄 산업의 발전으로 인해 점차 고갈되고 있는 실정이다. 반면에 일메나이트 광석은 매장량이 풍부하며, 전 세계에 고루 분포하여 수급이 용이하다. 또한 루타일 광석에 비해 가격이 저렴하여 일메나이트 광석을 활용하려는 많은 연구가 진행되고 있다2). 그러나 일메나이트는 루타일과 달리 철 및 다량의 불순물을 함유하여 TiCl4를 제조하기 위한 염화 공정에 직접 투입될 경우 다량의 금속 염화물이 발생하여 배관의 막힘이 발생할 수 있고, 염소가스의 이용률도 낮아진다. 따라서 일메나이트를 TiCl4 제조공정의 원료로 사용하기 위해서는 불순물 중 많은 비율을 차지하는 Fe를 제거하는 것이 선행되어야 한다.
일메나이트에서 고품위의 합성 루타일을 제조하기 위한 다양한 공정들이 존재하지만2), 본 연구에서는 선택염화법으로 일메나이트 중의 Fe를 제거하여 합성 루타일을 제조하였다. 선택염화에 의해 제조된 합성 루타일은 불순물인 Fe가 제거되면서 광석 내 많은 기공이 생성되며, 이러한 기공이 입자의 표면적을 증가시켜 반응효율이 높을 것으로 사료된다. 일반 루타일의 염화반응에 관해서는 많은 속도론적 연구가 보고 되었으나4,5,6,7), 대부분 반응 계면에서의 화학반응을 율속단계로 가정하여 고찰하였다. 그리고 다공성 합성 루타일의 염화반응에 관한 연구는 이루어지지 않았으며, 합성 루타일 내에 존재하는 많은 기공들이 속도론적으로 어떤 영향을 미치는지 규명할 필요가 있다. 따라서 본 연구에서는 일메나이트의 선택염화를 통해 제조한 합성 루타일과 기공이 거의 없는 일반 루타일을 시료로 사용하여 염화반응 속도에 미치는 반응 온도와 시간, Cl2가스와 CO가스 분압비()의 영향에 대해 조사하였다.
2. 실험 방법
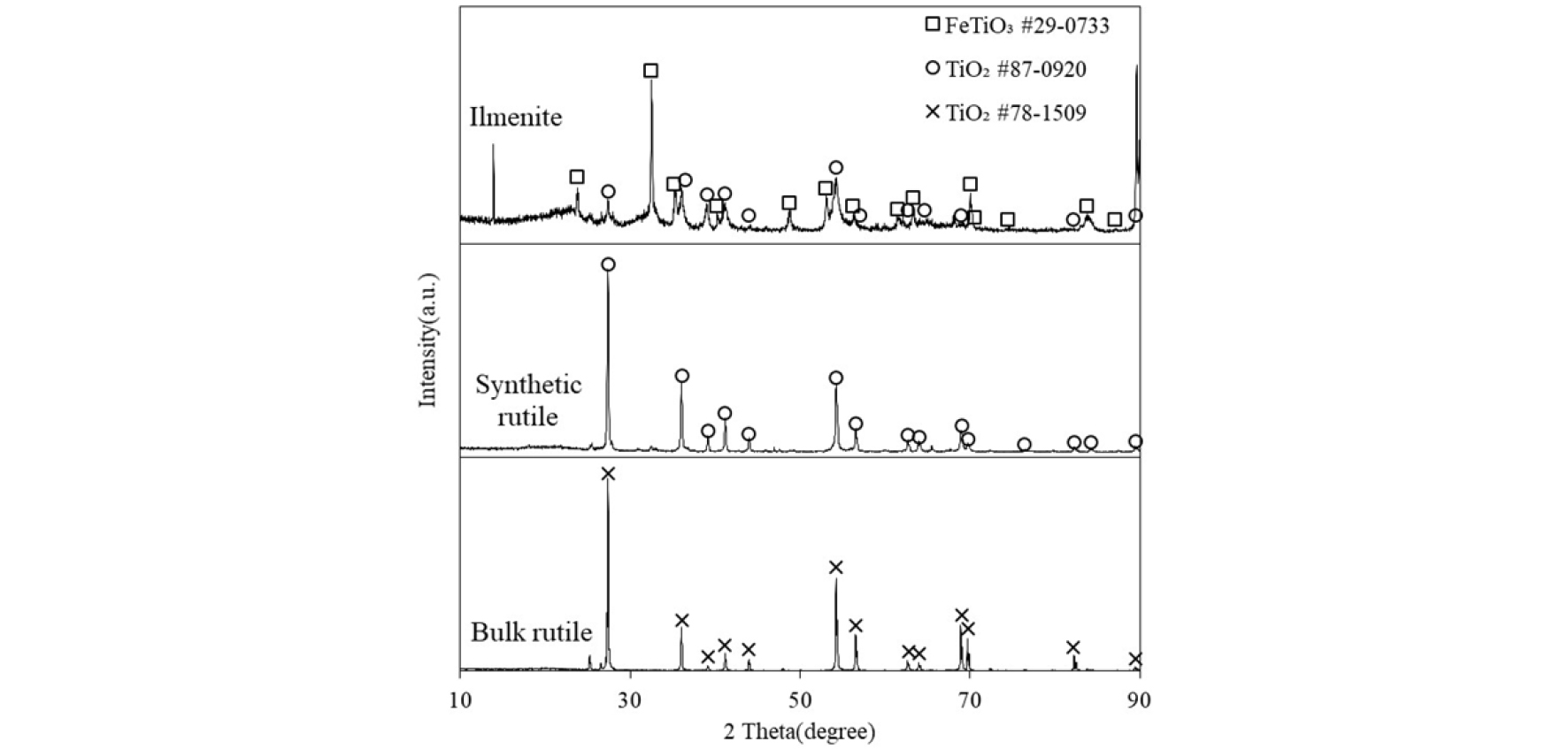
본 실험에 사용한 시료는 선택 염화를 통해 일메나이트 광석 중의 Fe를 제거한 다공성 합성 루타일이며, 비교를 위하여 기공이 없는 일반 루타일(bulk rutile)도 사용하였다. 합성 루타일은 1,173 K의 수평 관상로에서 Cl2+CO 혼합가스를 이용하여 60분간 반응시켜 제조하였으며8,9), Fig. 1에는 본 실험에 사용한 합성 루타일과 일반 루타일, 그리고 합성 루타일의 제조에 사용한 일메나이트의 X-선 회절 분석(XRD: Rigaku, D/Max-2500) 결과를 나타내었다. 일메나이트에서는 FeTiO3와 TiO2상이 혼재되어 나타났으나, 일메나이트 중 Fe를 선택염화시켜 제거한 합성루타일과 일반루타일에서는 TiO2상만 확인되었다. 합성루타일과 일반루타일의 염화반응을 비교하기 위하여 Fig. 2에는 주사전자현미경(SEM: NAMOTEC)에 의한 입자의 표면 형상을 나타내었다. 합성루타일은 표면과 내부에 무수히 많은 기공이 분포한 반면, 일반루타일은 외관상 표면에 기공이 거의 없음을 확인하였다. 또한, 입자의 표면적을 알기 위해 BET(automated gas adsorption analyzer: autosorb iQ) 분석을 진행하였으며 합성루타일의 경우 56,300 cm2/g, 일반 루타일의 경우 8,593 cm2/g로 합성루타일의 표면적이 훨씬 큰 것을 확인하였다. 일반루타일과 합성 루타일의 조성은 X선 형광분석기(XRF, X-ray fluorescence: X-MET 5100)를 이용하여 분석하였으며, Table 1에 결과를 나타내었다. 분석결과를 바탕으로 합성루타일에 존재하는 Ti를 산화물(TiO2)상으로 계산한 결과 86 wt.%였다.
Table 1.
Chemical composition of synthetic rutile and bulk rutile (wt.%)
| Elements | Ti | Fe | Si | Al | Ca | O & others |
| Synthetic rutile | 50.97 | 4.3 | 1.1 | 1.83 | 0.7 | Bal. |
| Bulk rutile | 55.3 | 1.3 | 1.2 | 1.2 | 0.1 | Bal. |
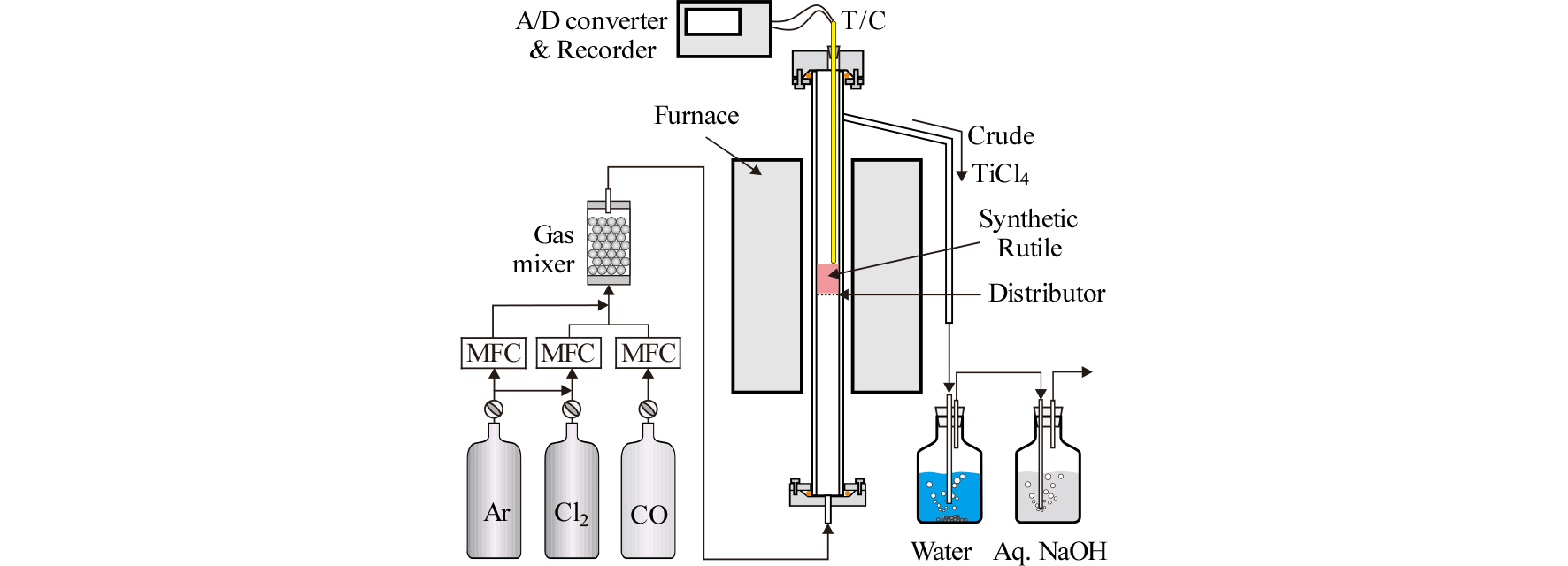
Fig. 3에는 본 실험에 사용한 장치의 모식도와 분산판의 도면을 나타내었다. 수직 관상로 내에 석영제 반응관(21 mm I.D, 25 mm O.D, 1,050 mm length)을 설치하였다. 노 내의 균열대 부분(반응기의 아래 부분에서 195 mm)에 석영 분산판을 설치하여 유동층을 형성할 수 있도록 하였다. 분산판에는 직경 1 mm의 hall이 74개가 설치되어 있다. 가스 유량은 MFC(Mass Flow Controller: MPR-3000S)로 제어하였으며, 반응 가스로는 고순도의 Cl2(99.9 %)와 CO(99.9 %)를 사용하였고, 반응관 내부를 불활성 분위기로 치환하기 위하여 고순도의 Ar가스(99.999 %)를 사용하였다.
승온하는 동안 Ar가스를 600 cm3/min의 유량으로 공급하여 불활성 분위기를 조성하였다. 반응 온도인 1,173~1,323 K에 도달하면 Ar가스의 공급을 중단하고 반응관 상부를 통하여 루타일 시료 10 g을 분산판 위에 장입하였다. 이후 약 10분간 Ar가스를 송입한 후, 미리 설정한 분압별 조건에 따라 Cl2+CO 혼합가스를 송입하였다. Cl2+CO 혼합가스는 균일 혼합이 되도록 알루미나 볼(직경 10 mm)로 채워진 gas mixer를 통과시켰다. 반응시 생성되는 염화물과 미반응 된 Cl2, CO 가스는 NaOH 수용액을 통해 중화시켜 외부로 배출하였다.
반응이 종료되면 Cl2+CO 혼합가스 공급을 중단하고 Ar 가스만 반응관 내부로 송입하여 잔류하는 Cl2가스를 제거하면서 상온까지 냉각시켰다. 상온에 도달하면 미반응 잔사를 회수하여 무게를 측정하였으며, XRF와 BET 분석으로 잔사의 성분 등을 조사하였다.
3. 실험 결과 및 고찰
3.1. 합성루타일의 염화반응
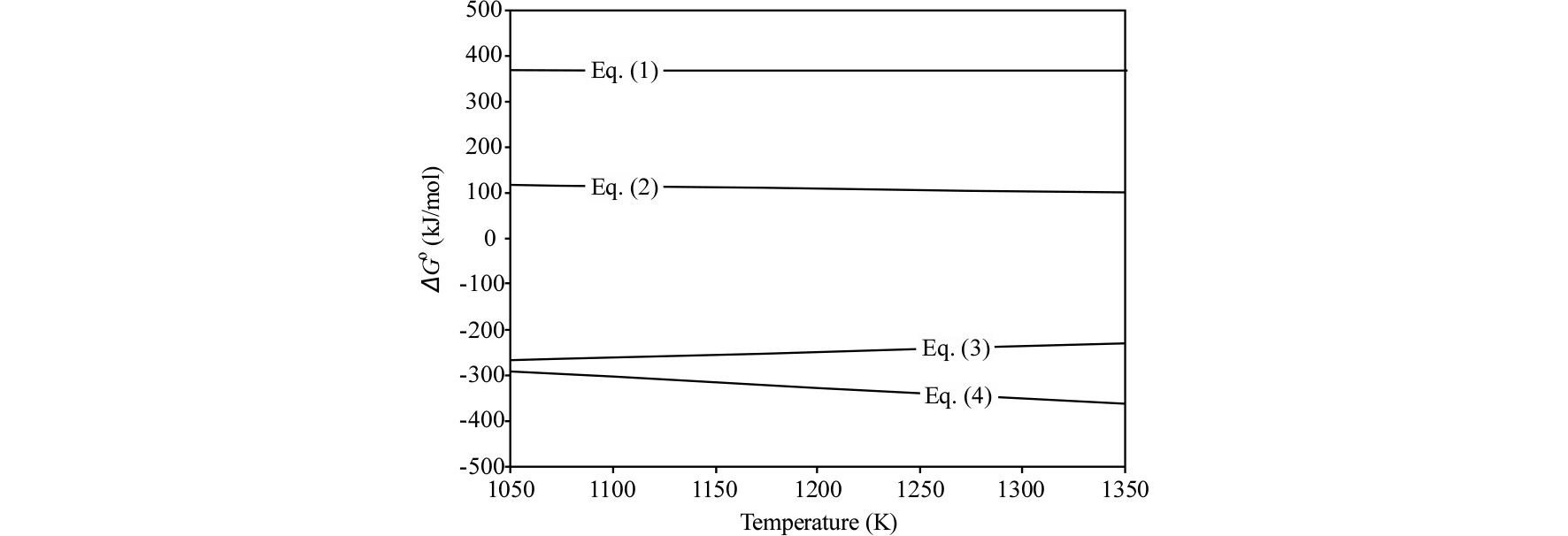
본 연구에서 사용한 합성 루타일은 일메나이트 중의 Fe를 선택염화를 통해 제거한 것으로, Fig. 1에 나타낸 바와 같이 대부분 TiO2로 존재하였다. 따라서 TiO2의 염화반응과 관련된 식들을 다음과 같이 나타낼 수 있다4,5,6).
Fig. 4에는 식 (1)~(4)의 온도에 따른 깁스 자유에너지 변화를 나타내었다. 식 (1)과 (2)의 경우 본 연구의 온도 범위에서 가 양의 값을 가지므로, TiO2를 직접 Cl2가스와 반응시키면 염화반응이 일어나기 곤란한 것을 알 수 있다. 그리고 CO가스에 의한 TiO2의 직접 환원반응도 일어나기 곤란한 것을 알 수 있다. 그러나 식 (3) 및 (4)의 경우 가 음의 값을 가지므로, CO(C)를 첨가하여 생성하는 산소를 제거하면 TiO2의 염화반응이 쉽게 일어날 수 있다는 것을 알 수 있다. 식 (3)과 식 (4)에 의한 TiO2의 염화반응을 모두 고려할 필요가 있으며, 식 (4)에서 생성된 CO가스가 추가로 환원제로 작용하여 식 (3)의 반응이 연쇄적으로 일어날 수 있다. 따라서 본 연구에서는 CO와 Cl2 혼합가스에 의한 TiO2의 염화반응에 대하여 검토하였다.
3.2. 일반 루타일과 합성 루타일의 염화반응 속도 비교
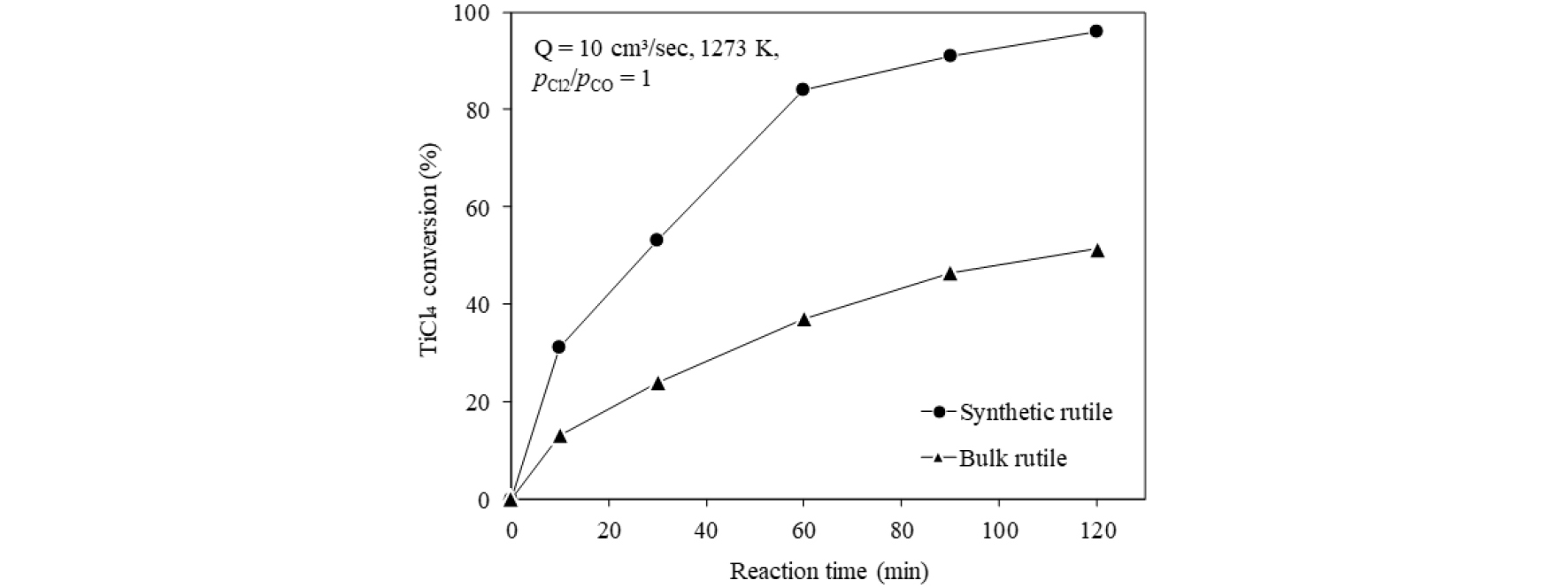
Fig. 5에는 Q=10 cm3/sec, 1,273 K, =1 조건에서 반응시간에 따른 합성 루타일과 일반 루타일의 TiCl4 전환율을 비교하여 나타내었다. 이 때 Q는 단위시간당 반응기 내부로 송입된 CO+CO2 혼합가스의 유량을 나타낸다. TiCl4 전환율()은 다음 식으로 계산하였다.
| $$R_{{\mathrm{TiC}}_4}^{exp.}=\frac{W_{{\mathrm{TiO}}_2}^i-W_{{\mathrm{TiO}}_2}^f}{W_{{\mathrm{TiO}}_2}^i}\times100$$ | (5) |
여기서 는 반응 전 루타일 중의 TiO2 무게이며, 는 반응 후 잔사 중의 TiO2 무게를 나타낸다. 반응시간이 증가할수록 두 종류의 루타일 모두 전환율이 증가하였으나, 합성 루타일의 염화반응 속도가 두 배 가까이 빠르며, 최종 전환율에서도 일반 루타일보다 2배 정도 높은 값을 나타내었다. 이러한 결과는 Fig. 2에 나타낸 바와 같이 합성루타일의 표면과 내부의 기공에 의해 반응가스가 입자 내부로 침투하기가 용이하여, 입자의 표면뿐만 아니라 내부에서도 염화반응이 일어나 일반 루타일보다 반응 속도가 현저하게 빠른 것으로 생각된다.
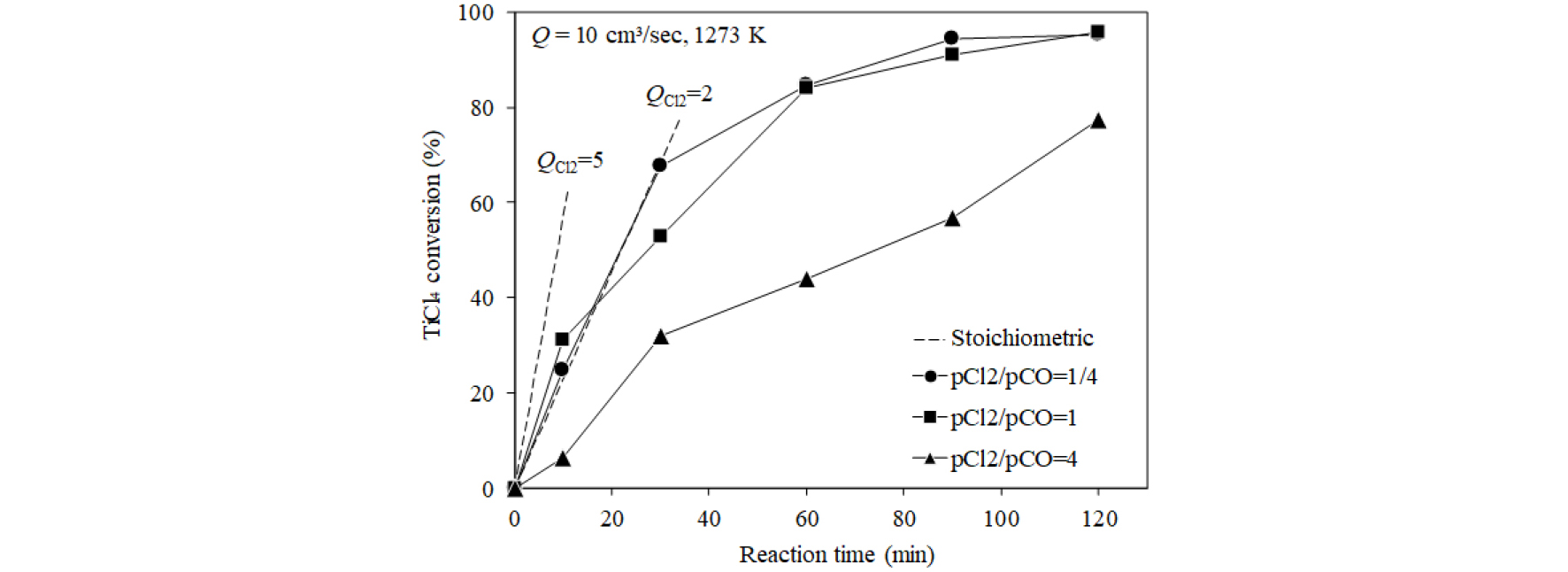
3.3. Cl2와 CO가스 분압비의 영향
Fig. 6에는 합성 루타일의 Cl2/CO 분압비에 따른 TiCl4 전환율의 변화를 나타내었으며, 식 (3)으로부터 에 따른 TiCl4 전환율을 이론적으로 계산한 Cl2 기준의 화학 양론적 전환속도를 점선으로 나타내었다. 화학 양론적 전환속도()는 다음 식으로 계산하였다.
| $$R_{{\mathrm{TiCl}}_4}^{sto.}=\frac{n_{{\mathrm{Cl}}_2}^t}{2\times n_{{\mathrm{TiO}}_2}^i}\times100$$ | (6) |
여기서 는 Cl2의 유량인 (cm3/s)로부터 환산한 단위 시간당 Cl2의 공급량(mol/s)이며, 는 반응전 원시료 중의 TiO2량(mol)을 나타낸다. Cl2/CO 분압비와 관계없이 반응시간이 경과함에 따라 TiCl4 전환율은 증가하였으나, 가 1( cm3/s) 및 1/4( cm3/s)인 조건에서의 TiCl4 전환율은 큰 차이를 보이지 않았다. 그러나 가 1/4인 조건에서는 반응초기인 30분 정도까지는 거의 화학 양론적 전환속도에 가까운 값을 보였으나, 가 1인 조건에서는 이론적 전환속도보다 약간 낮은 값을 나타내었다. 그리고 가 4( cm3/s)인 =0.25 atm의 조건에서는 반응초기에도 화학양론 값에 훨씬 못 미치는 전환속도를 나타내었다. 이러한 결과는 식 (3)에 나타낸 바와 같이 TiO2의 염화반응은 TiO2의 중의 산소를 제거할 CO가스가 존재하여야 하므로 값보다 값에 더 의존하는 것을 나타내는 것으로 생각된다.
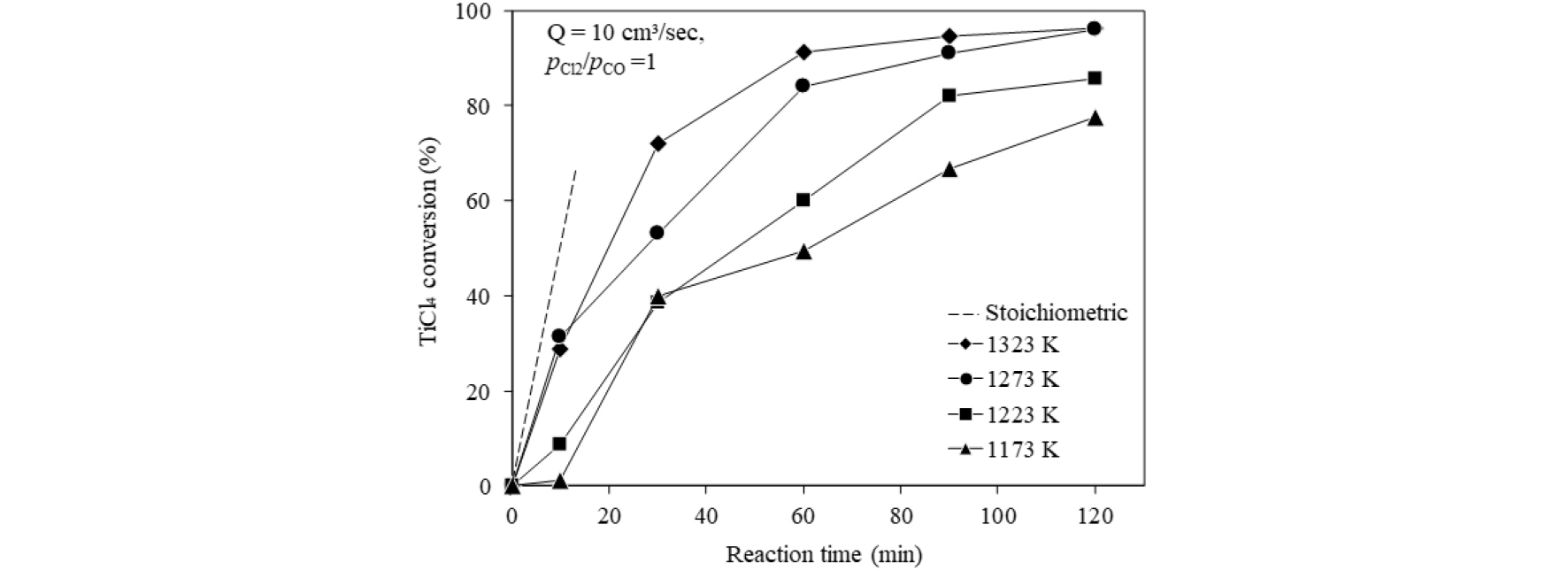
3.4. 염화반응 속도에 미치는 반응온도의 영향
Fig. 7에는 합성 루타일에서 =1, 전체 가스 유량 Q=10 cm3/s의 조건에서 TiCl4 전환율에 미치는 온도의 영향을 나타내었다. 반응온도가 증가할수록 TiCl4 전환율은 증가하는 경향을 보였으며, 1273 K와 1323 K의 반응에서는 초기에 화학 양론적 전환속도에 근접하는 수준을 나타내었으나, 이후에는 반응물이 줄어들면서 전환속도가 서서히 감소하는 경향을 나타내었다. 그러나 1,223 K 이하에서는 화학 양론적 전환속도에 훨씬 못 미치는 값을 나타내었고, 이는 합성루타일의 염화반응 속도가 이론적 가스 소비속도에 미치지 못함을 나타낸다. 온도가 낮을 때 화학반응에 필요한 에너지가 충분히 공급되지 못한 것과 가스의 확산계수가 낮아 입자로의 가스 확산 속도가 충분하지 않은 것이 원인이 될 수 있다. 따라서 실험 결과를 반응계면에서의 화학반응 율속식과 가스 경계층을 통한 물질이동 율속식에 대입하여 나타내고, 합성루타일 입자의 중요한 특성인 기공의 영향을 적용하여 고찰하였다.
3.5. 속도론적 해석
본 연구에서는 Cl2와 CO의 혼합가스에 의한 합성 루타일 입자의 염화반응 거동을 설명하기 위해 TiO2가 기체상인 TiCl4로 바뀌면서 생성물 층을 형성하지 않고 입자의 표면과 입자 내 기공에서 화학반응이 일어난다고 가정하였다. 따라서 기체와 고체의 반응은 반응계면에서의 화학반응 율속과 입자 주위의 가스 경계층을 통한 물질이동 율속으로 생각할 수 있으므로, 각 반응 단계에 대한 속도식은 다음과 같이 나타낼 수 있다10).
① 반응계면에서의 화학반응 율속
| $$1-(1-x)^{1/3}=k_r\cdot t$$ | (7) |
② 가스 경계층을 통한 물질이동 율속
| $$1-(1-x)^{2/3}=k_g\cdot t$$ | (8) |
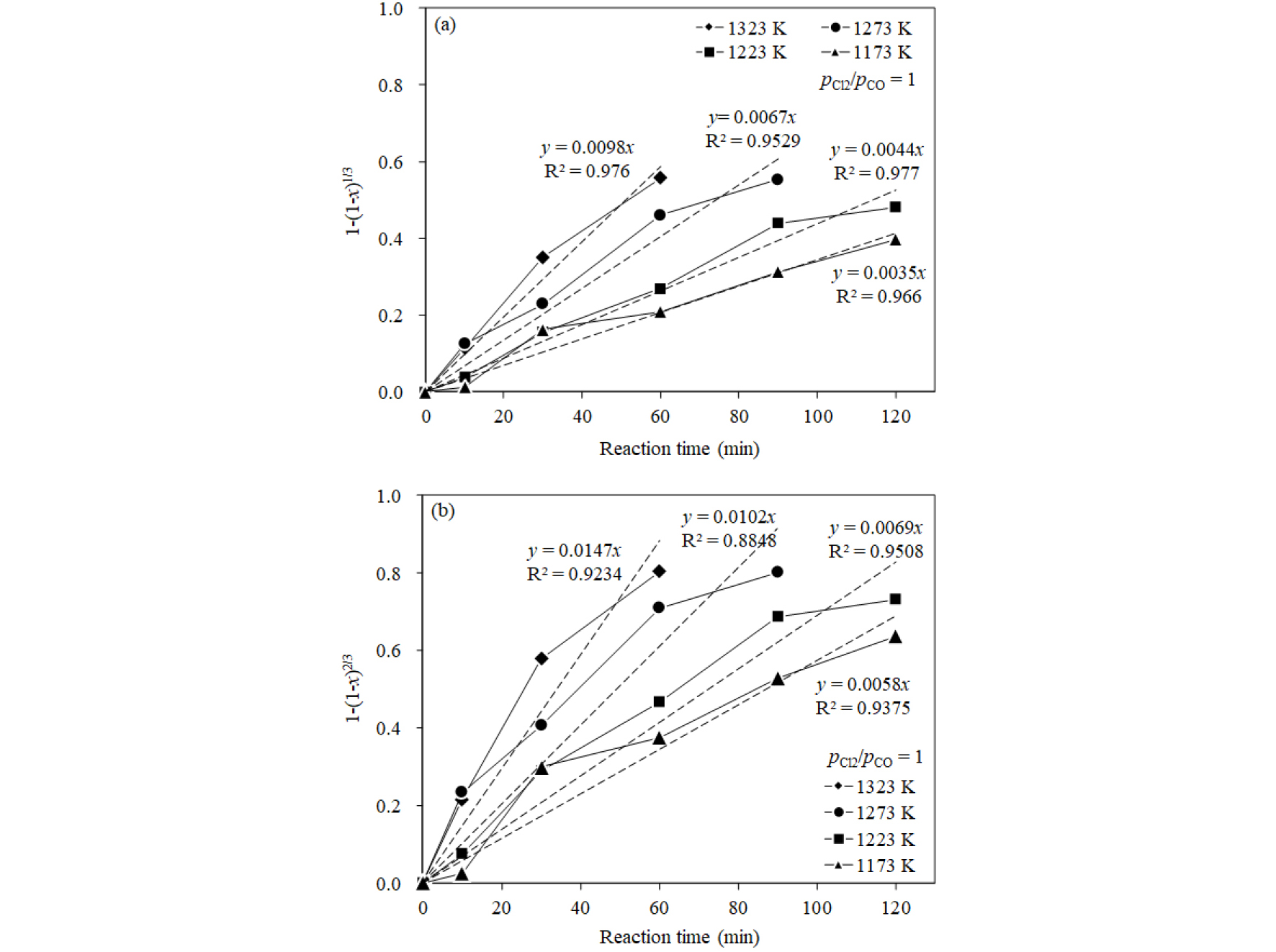
여기서 는 반응율(-), 는 각 반응의 겉보기 속도 상수(s-1), 는 반응 시간(s)을 나타낸다. 따라서 Fig. 7의 온도별 반응율을 식 (7), (8)에 대입하여 직선성이 우수한 것을 율속단계로 결정할 수 있다.
Fig. 8(a), (b)에는 각각 식 (7)과 식 (8)을 대입하여 계산한 결과를 결정계수(R2)와 함께 비교하여 나타내었다. 화학반응 율속으로 가정하여 계산한 결과(Fig. 8(a)) 결정계수 값(R2)은 실험온도 범위에서 0.953~0.977을 나타내었으며, 가스경계층을 통한 물질이동 율속으로 가정하여 계산한 결과(Fig. 8(b))에서는 0.885~0.951을 값을 나타내었다. 따라서 TiO2의 염화반응은 직선성이 보다 높은 계면에서의 화학반응에 의해 율속되는 것으로 생각된다.
한편, 본 연구에서는 기공이 있는 합성 루타일을 사용하였기 때문에 입자계면에서의 화학반응뿐만 아니라 입자 내부에 있는 기공표면에서의 화학반응도 고려하여야 한다. 따라서 기공에 의해 넓어진 표면적을 고려하기 위해 Fig. 8(a)에서 구한 겉보기 속도상수인 을 식 (9)에 대입하여 활성화 에너지를 구할 때 필요한 속도상수 를 계산하였다11).
| $$k_A=\left(\frac2{n+1}k_r\cdot S_p\cdot D_{AB}\right)^{1/2}$$ | (9) |
여기서 은 반응차수, 는 입자의 표면적, 는 상호확산계수를 나타낸다. TiO2의 염화반응은 1차 반응으로 가정하였고 입자의 표면적은 반응 전 합성 루타일의 BET 측정값을 적용하였다. Table 2에는 식 (9)의 계산에 사용한 각각의 값들을 나타내었다.
Table 2.
The values of factors which applied to the equation (9), to calculate
| (cm2/g) | (cm2/s) | ||||
| 1,173 K | 1,223 K | 1,273 K | 1,323 K | ||
| 1 | 56,300 | 1.345 | 1.443 | 1.543 | 1.647 |
식 (9)로부터 계산한 와 식 (10)의 Arrhenius식을 이용하여 활성화 에너지를 구하였다.
| $$k_A=A\cdot\exp\left(-\frac{E_a}{RT}\right)$$ | (10) |
여기서 는 활성화 에너지(J/mol), 은 기체상수(8.314 J/(mol·K)), 는 절대온도(K), 는 빈도인자(-)를 나타낸다. 식 (10)의 양변에 대수를 취하면 다음과 같다.
| $$\ln k_A=\ln A-\frac{E_a}{RT}$$ | (11) |
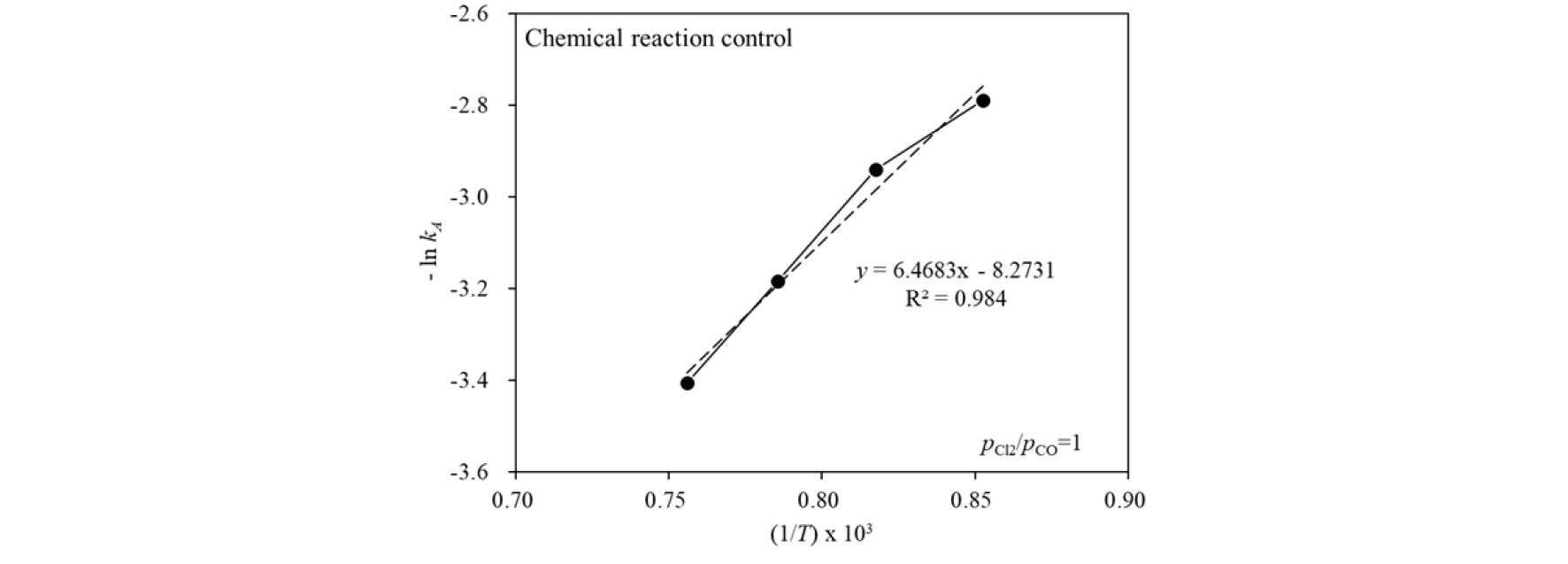
따라서 를 플롯트하고, 그 기울기로부터 활성화 에너지를 구하였다.
Fig. 9에는 Fig. 7 및 Fig. 8(a)의 결과를 식 (7) 및 식 (9)~(11)으로 계산한 결과로부터 의 관계를 나타내었다. 주어진 온도 범위에서 R2값은 0.984로 비교적 양호한 직선성을 나타내었으며, 직선의 기울기는 6,468.3이므로 식 (11)로부터 활성화 에너지를 계산하면 53.77 kJ/mol이다.
Table 3에는 본 연구의 결과를 다양한 타이타늄 원료를 염화시켜 속도론 모델에 적용한 기존 연구들과 비교하여 나타내었다. 염화반응에 사용된 원료로는 다공성의 합성 루타일, Ti 슬래그 등이며, 각 연구에서의 활성화 에너지 값은 상이하였다4,5,6,7). 특히 기공이 없는 일반 루타일의 염화반응의 활성화 에너지는 158~175 kJ/mol로 비교적 높게 나타났다5,6). 한편, 합성 루타일과 같이 기공이 있는 입자의 염화반응에서는 대체로 낮은 활성화 에너지 값을 나타내었다. 또한 타이타니아 슬래그의 경우 초기 입자에는 기공이 없으나, MnO와 FeO가 반응 초기에 빠르게 염화되어 기공이 생성되고 이로 인해 낮은 활성화 에너지 값을 나타내었다. 이는 기공을 통해 반응 가스가 입자 내부로 쉽게 확산되어 내부에서도 화학반응이 일어날 수 있었기 때문인 것으로 생각된다. 그러나 Sohn 등의 연구에서는 합성 루타일이 다공성임에도 156 kJ/mol로 크게 나타났다4). 이는 각 연구에서 적용한 반응속도식의 차이에 의한 것으로 생각되며, Sohn 등은 비등점이 높은 금속 염화물에 의한 기공의 막힘을 나타내는 인자인 λ를 적용하여 모델에서 기공의 역할을 제한하였기 때문인 것으로 생각된다. 그러나 본 연구에서는 금속 염화물에 의한 기공의 막힘을 관찰할 수 없었기 때문에 위의 모델 적용이 어렵다고 판단되었다. 이에 기공에 의한 반응계면 증가와 가스의 확산속도 증가를 고려한 모델 식을 사용하였으므로 더 낮은 활성화 에너지 값을 얻은 것으로 생각된다.
Table 3.
Activation energy from literature by chlorination with CO (at pCl2/pCO=1)
| Author | Material |
Temp. (K) (particle size [㎛]) |
Activation Energy (kJ/mol) | Rate Eq. Expression |
|
Morris and Jensen (1976)5) |
Rutile CO, Cl2 |
1245~1329 (149~177) | 158 | |
| Sohn et al. (1998)6) |
1223~1373 (38~250) | 175 | ||
| Sohn et al. (1998)4) |
Synthetic rutile (porous) CO, Cl2 |
1173~1323 (63~252) | 156 | |
| Moodley (2011)7) |
Titania slag (porous) CO, Cl2 |
1073~1273 (106~300) | 34.8 | |
| This work |
Synthetic rutile (porous) CO, Cl2 |
1173~1273 (180~212) | 53.77 |
4. 결 론
본 연구에서는 CO와 Cl2의 혼합가스를 사용하여 합성루타일의 염화반응 속도를 고찰하였다. 특히, TiCl4의 전환율에 미치는 반응 온도, 반응 시간, Cl2와 CO가스의 분압의 영향을 조사하여 율속단계를 고찰하고 활성화 에너지를 계산하였다. 그 결과를 종합하면 다음과 같다.
(1) 합성 루타일의 기공에 의해 반응가스의 확산이 용이해지고, 입자 내부에서도 TiO2의 염화반응이 일어나므로 일반루타일에 비해 합성루타일의 염화반응 속도가 매우 빨랐다.
(2) 가 1 및 1/4의 조건에서 합성루타일의 염화반응은 반응초기에는 화학양론적 전환율에 가까운 속도를 나타내었으며, 합성루타일의 염화반응 속도는 CO가스 분압에 의존하였다. 그리고 반응온도가 높아질수록 합성루타일의 염화반응 속도가 상승하였으며, 1273 K이상에서는 화학양론적 반응속도에 근사한 값을 나타내었다.
(3) 반응온도에 따른 합성루타일의 염화반응 속도를 기-고 반응 모델에 적용하여 고찰한 결과 반응계면에서의 화학반응 율속으로 나타났다. 그리고 합성 루타일의 기공이 반응 속도에 미치는 영향을 고찰하기 위해 Cl2+CO 혼합가스의 상호확산계수와 입자 전체의 표면적 값을 도입하여 구한 활성화 에너지는 53.77 kJ/mol였다.