1. 서 론
2. 시료 및 실험방법
2.1. 시료
2.2. 초기 침출 용액 제조
2.3. 산화 실험
2.4. 분석 방법
3. 실험결과 및 토론
3.1. 산화 조건에 따른 비소의 산화-침전 효과 분석
3.2. 침전물 분석
4. 결 론
1. 서 론
비소(As)는 주기율표 상 33번에 해당하는 원소로 준금속(metalloid)으로 분류되는 독성이 강한 원소이다. 또한, 비소는 지각에 1.5 ppm 농도로 분포하고 있으며, 53번째로 흔한 원소로써 주로 황화광물의 형태로 발견되며 가장 대표적인 광물은 황비철석(arsenopyrite, FeAsS) 으로 알려져 있다1). 그 외에 orpiment (As2S3), realgar (AsS) 등의 비소 함유 황화광물이 대표적이며, 이들 광물은 대개 구리, 금, 은 등의 유가금속과 함께 발견된다2,3). 따라서 비소는 이들 유가금속의 제련 공정을 통해 이동성(mobility)이 생기며, 또는 자연계에 존재하는 미생물의 활동으로 인해 수계로 용출되어 나오기도 한다3,4,5). 비소가 용출된 경우, 일반적으로 3가 비소가 5가 비소에 비해 약 60배 정도 독성이 강한 것으로 알려져 있는데, 이는 3가 비소가 5가 비소에 비해 생명체 내에 보다 더 잘 흡수되기 때문이다6,7).
자연계에서 비소가 수계로 용출될 때, 3가 비소의 용해도가 상대적으로 더 높기 때문에, 많은 경우 비소는 수계에서 3가로 존재한다8). 이에 대한 용해도를 낮추고 비소를 안정화시키기 위해 비소의 산화 거동에 대한 연구가 진행되어 왔으며, 습식제련법에 의해 비소를 고정하는 공정들이 다수 개발되었다. 대표적인 방법이 용해도가 낮은 비소 침전물을 형성하여 용액에서 비소를 제거하는 방법이며, 생성 가능한 침전물로는 비소 황화물, 비소-칼슘 침전, 비소-철 침전 등이다8). 최근 들어 많이 연구되고 있는 분야는 비소-철 침전인데, 자연계에서도 안정한 상태로 발견되는 광물인 스코로다이트(scorodite, FeAsO4·2H2O) 침전을 제조하여 비소를 제거하는 방법이다. 과거에 스코로다이트는 고온·고압환경에서만 형성이 가능한 것으로 알려져 있어 비소 제거에 적합하지 않은(경제성이 없는) 공정으로 여겨져 왔다. 그러나 1997년 일부 연구자에 의해 상압 조건에서 스코로다이트 생성이 가능하다는 것이 밝혀지면서9) 현재까지 다양한 연구가 진행되어 오고 있다. 특히 최근 발표된 몇몇 특허에서는 비소와 철을 각각 산화시킨 후 고온·상압 조건에서 침전 형성이 가능함을 보여주고 있다10,11). 이 때, 비소의 산화제로 사용되는 물질이 중요한데, 이론적으로는 공기에 의해서도 비소의 산화가 가능하지만 산화 속도가 매우 느리기 때문에 이를 향상시킬 수 있는 물질을 찾는 것이 공정의 핵심이며, 산화제로는 산소, H2O2, 오존, KMnO4 등이 사용될 수 있다5). 특히, 일부 선행 연구에서는 활성탄을 사용하여 용이하고 빠르게 비소를 산화시킬 수 있는 것으로 나타났다4,5,11). 또한, pH 0.3-1.0 구간의 산성 조건에서 스코로다이트가 잘 생성되는 것으로 나타났다12).
본 연구에서는 공기와 활성탄을 병용한 산화 조건하에서 고농도 비소를 함유한 황화 광석 침출 용액 내 비소의 산화 및 침전 거동을 분석하였다. 침출 용액 중 금속의 농도는 저자의 이전 연구인 황화 광석에 대한 미생물 침출13)에 의한 금속 농도 수준에 상응하도록 설정하여, 자연계에서 용출 가능한 비소 및 금속 농도 수준에 대해 비소 제거 연구를 수행하고자 하였다. 침출 용액에는 비소와 함께 철 또한 존재하고 있어 적절한 산화 반응을 통해 스코로다이트를 형성하여 비소를 제거할 수 있을 것으로 기대되었다. 또한, 공기만을 주입한 산화 반응과 강력한 산화제인 과산화수소(H2O2)를 산화제로 사용한 실험을 통하여 공기와 활성탄을 병용한 실험에서의 비소 산화·침전 거동과 비교 연구를 수행하였다. 비소 제거 과정을 상세히 파악하기 위해 산화 및 침전 반응 중 전체 비소 및 철의 농도와 3가 비소 및 5가 비소, 그리고 2가 철 및 3가 철에 대한 상세 분석을 수행하였으며, 최종 생성된 침전물에 대한 분석 또한 수행하였다.
2. 시료 및 실험방법
2.1. 시료
비소 침출 용액을 제조하기 위해 고농도 비소를 함유한 익명의 국내 광산 시료를 사용하였다. 광석은 조크러셔를 사용하여 1차 파쇄한 후 로드밀로 325 mesh 이하(D90 = 42 µm)로 분쇄하여 사용하였다. 분쇄된 시료는 광석 중 황화 광물의 산화를 방지하기 위해 -4°C 이하의 냉동고에 보관하였다.
시료에 대한 광물학적 분석 결과, 주요 황화 광물로 황비철석 26.4% (arsenopyrite, FeAsS), 황철석 16.9% (pyrite, FeS2), 방연석 10.8% (galena, PbS), 섬아연석 6.9% (sphalerite, ZnS) 등이 함유되어 있는 것으로 확인되었으며, 주요 맥석 광물로는 석영 20.9% (quartz, SiO2)이 확인되었다. 광석 중 비소의 농도는 12%로 매우 높은 수준으로 나타났다. 광석에 대한 분석 결과는 저자의 이전 논문에 상술하였다13).
2.2. 초기 침출 용액 제조
본 연구에서 광석 침출의 목적은 미생물 침출에서와 유사한 농도의 비소를 함유한 용액을 제조하는 것이기 때문에 비소 농도가 약 3000 mg/L에 도달할 때까지 침출을 진행하였다. 침출은 광액농도 100 g/L, 온도 50°C, 교반속도 300 rpm, 공기 유량 0.1 L/min, pH 1 조건하에서 수행하였으며, pH 조절에는 황산을 사용하였다. 침출 용액 제조는 비소 농도가 3000 mg/L에 도달한 95시간경에 종료되었다. 침출 용액은 1 L씩 2개 batch로 제조 되었으며, 각 batch의 주요 금속 농도는 Table 1과 같다.
Table 1.
Metal concentration in the initial leaching solution
| Batch No. | Concentration (mg/L) | ||||
| Fe | Zn | As | Pb | Ca | |
| 1 | 7407 | 4993 | 2994 | 2.435 | 604.8 |
| 2 | 7292 | 4712 | 3200 | 2.394 | 440.0 |
2.3. 산화 실험
공기와 활성탄의 병용 시 비소와 철의 산화 및 스코로다이트로의 침전 거동을 파악하기 위하여 다양한 산화 조건하에서 실험을 진행하였다. 공기와 활성탄 병용 실험에서는 활성탄(Sigma Aldrich, DARCO®, 4-12 mesh, granular) 을 침출 용액(300 mL) 에 투입하고 공기를 주입함으로써(공기 유량 0.1 L/min) 산화 반응을 유도하였다. 활성탄은 반응에 투입하기 전 미분을 제거하기 위하여 24시간 동안 증류수로 세척한 후 건조하여 사용하였다. 활성탄은 침출 용액량에 대하여 1, 5, 10 w/v%로 그 양을 달리 투입하여 활성탄 투입량 변화에 대한 산화 반응의 정도 또한 파악하고자 하였다. 비교 실험을 위하여 공기만을 주입한 실험 또한 수행하였으며(공기 유량은 동일), 더불어 강력한 산화제 중 하나로 알려진 과산화수소(30% H2O2)를 산화제로 사용하여 공기와 활성탄 병용 시의 산화 효과와 비교하였다. 산화 반응은 72시간동안 진행하였으며, 반응 완료 후 용액과 침전물을 분리하여 각각 분석하였다.
2.4. 분석 방법
산화 실험 중 용액의 Eh를 측정하여 산화 반응의 속도를 파악하였으며, 용액을 특정 시간 간격으로 채취하여 비소와 철의 농도를 분석하였다. 전체 비소, 3가 비소 및 전체 철의 농도는 ICP-OES (Perkin Elmer, Optima 8300 ICP-OES)로 측정하였으며, 2가 철의 농도는 LED type 수질분석기(Humas, HS-2300Plus)를 사용하여 측정하였다. 5가 비소 및 3가 철은 전체 비소 및 전체 철의 농도에서 각각 3가 비소, 2가 철의 농도를 제하여 계산하였다. 반응에서 획득한 침전물에 대해서는 XRD를 이용하여 결정상 분석을 진행하였다.
3. 실험결과 및 토론
3.1. 산화 조건에 따른 비소의 산화-침전 효과 분석
다양한 산화 조건하에서 비소 함유 침출 용액의 산화-침전 실험을 수행하여 공기와 활성탄을 병용하였을 시 비소의 산화 및 스코로다이트로의 침전 효과를 분석하였다. 본 실험에서는 산화 조건에 따른 침출 용액 내 철 및 비소의 산화 거동을 분석하였으며, Eh 측정치를 통해 각 반응에서의 산화 속도를 분석하였다.
3.1.1. 용액 내 금속 농도 분석
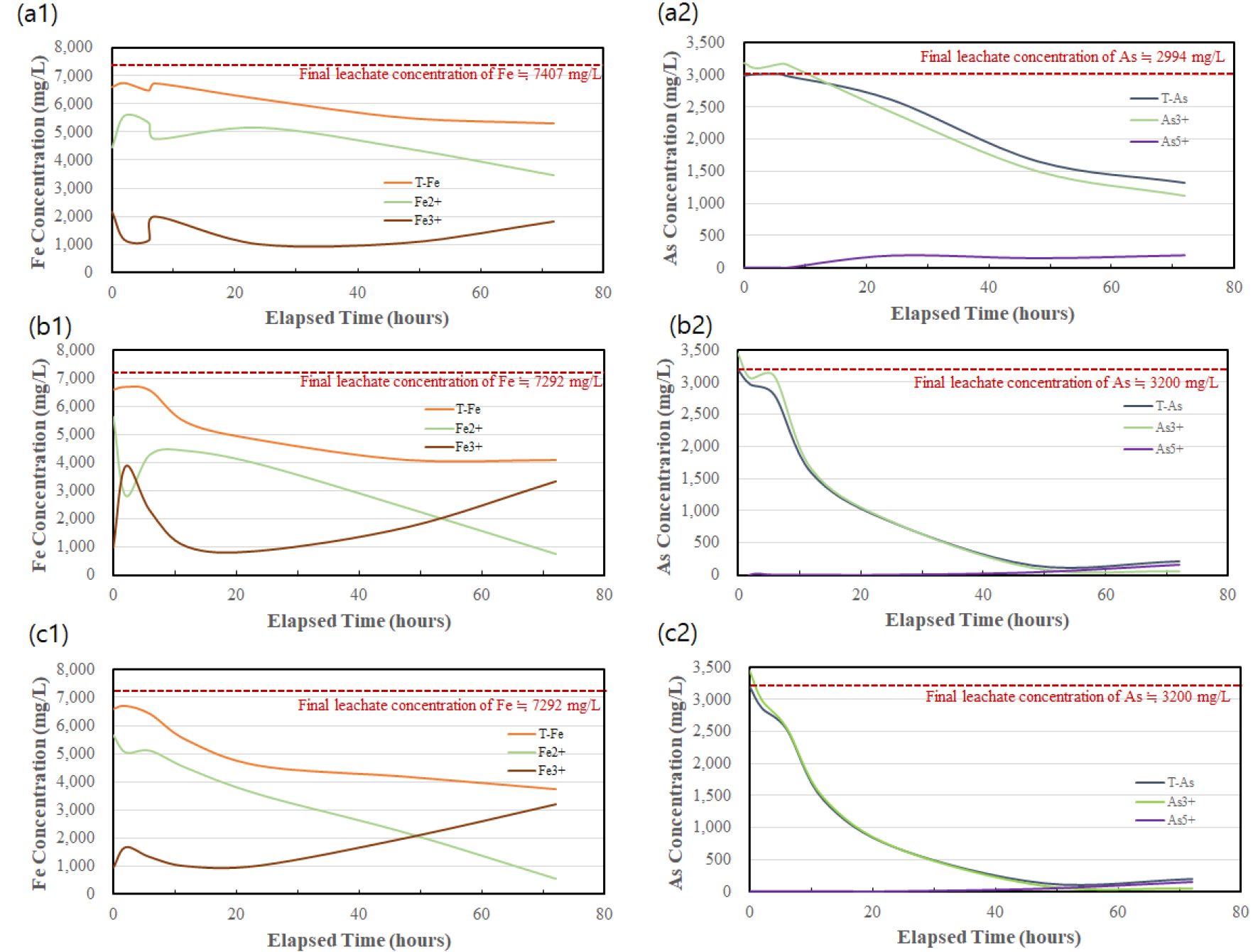
Fig. 1은 산화제로 공기만을 주입하였을 경우 철과 비소의 농도 분포 변화를 나타낸다. 10시간 이내에서 전체 철과 비소의 농도는 변동이 있으나 초기 농도에서 크게 벗어나지 않는 것으로 나타난다. 10시간 경과 이후 반응이 종료되는 72시간까지 전체 철 및 비소 농도는 각각 5870 mg/L, 2007 mg/L까지 점진적으로 감소하는 것으로 나타났다. 제거된 것으로 분석된 철과 비소의 농도는 각각 730 mg/L, 987 mg/L로 계산되었으며, 이는 스코로다이트 중 Fe : As의 이론 질량비인 1 : 1.34와 비교적 일치하는 비율로 계산되었다(실험 질량비 1 : 1.35). 따라서 본 결과로부터 제거된 철과 비소는 스코로다이트로 전환되었음을 파악할 수 있다. 실제 XRD 분석 결과 침전물의 결정상이 스코로다이트인 것으로 확인되었다(3.2.절 참조). 또한, 이로부터 비소 제거율은 33%로 계산되었다.
철과 비소의 상세한 산화 거동은 용액 내 3가 철과 5가 비소 농도 변화를 통해 분석하였다. Fig. 1로부터 초기 7시간동안은 전체 철 및 비소 농도가 대체로 일정하게 유지되고 3가 철 농도는 감소하며 5가 비소는 검출되지 않아 산화 반응이 원활하게 일어나지 않고 있음을 파악할 수 있다. 7시간 이후부터 3가 철 농도는 72시간까지 점진적으로 증가하며, 5가 비소 또한 용액 상에서 검출되기 시작한다. 또한, 7시간에서 24시간 사이 전체 철 및 비소 농도가 감소한 사실로부터 5가 비소와 3가 철이 반응하여 스코로다이트를 생성하였음을 파악할 수 있다. 특히, 5가 비소 농도는 120-165 mg/L로 계속해서 낮게 유지되는데, 이는 3가 철과 반응하여 스코로다이트를 생성한 후 용액 중에 잔류한 양에 해당한다고 할 수 있다. 위의 결과로부터 공기만을 산화제로 하여 반응을 진행한 경우, 산화 반응의 속도가 매우 느려 72시간 이내에 비소 제거율이 매우 낮게 나타남을 파악할 수 있다.
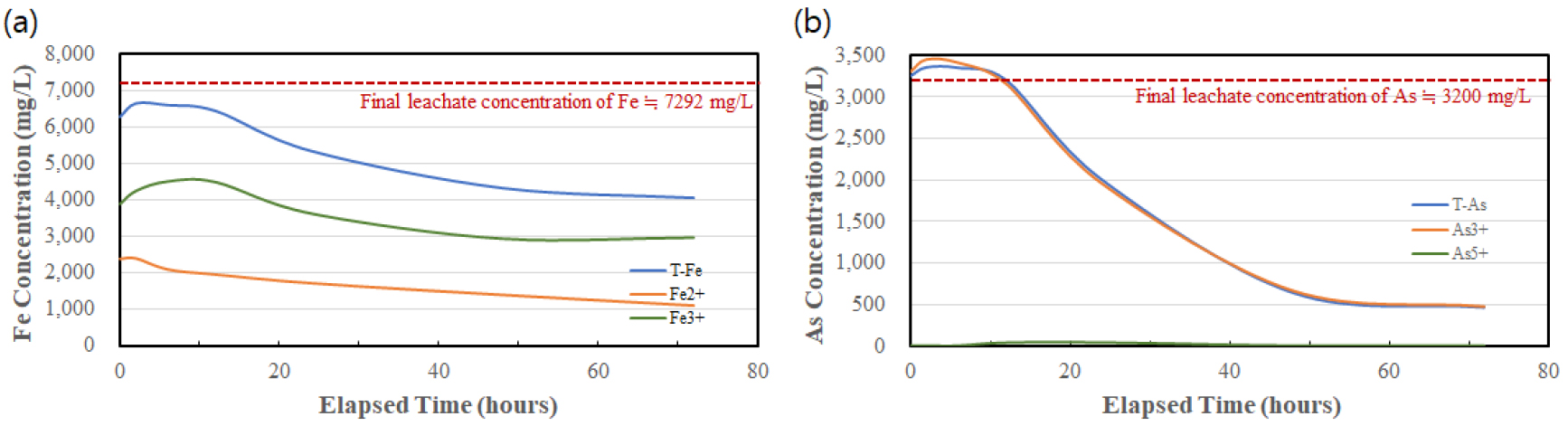
Fig. 2는 산화제로 공기와 활성탄을 병용한 산화 반응의 결과를 보여준다. 투입된 활성탄의 양은 침출 용액에 대하여 1, 5, 10 w/v%로 달리 하였다. 활성탄을 투입한 경우 투입된 활성탄의 양에 따라 산화 반응의 정도는 차이가 있으나, 모든 경우에서 반응이 시간에 따라 3단계에 걸쳐 일어나는 것으로 파악되었다(1단계: 0-10시간, 2단계: 10-48시간, 3단계: 48-72시간).
1단계(0-10 시간 구간) 에서 전체 철의 농도는 초반에는 대체로 일정하게 유지되었다가 후반부터 감소하기 시작한다. 감소 폭은 활성탄 투입량이 증가함에 따라 커지는 것으로 나타난다. 또한, 3가 철 농도의 최대점이 나타나는데, 1 w/v%의 경우 7시간, 5 w/v% 및 10 w/v%의 경우에는 2시간에서 3가 철 농도가 최대로 분석된다. 10 w/v%에서의 3가 철 최대 농도가 5 w/v%에서보다 낮게 나타나는데(5 w/v%: 3870 mg/L, 10 w/v%: 1680 mg/L) 이는 샘플링 시점으로 인한 차이이며, 10 w/v%의 경우 많은 활성탄의 양으로 인해 2시간 이전에 최대치에 도달한 후 감소하는 시점에서 측정된 것으로 볼 수 있다. 또한, 1단계에서는 전체 비소 농도가 감소하는 것으로 분석되며, 1 w/v%에서는 초반 일정한 농도를 유지하다가 감소하는 반면, 5 w/v% 및 10 w/v%에서는 초반부터 급격히 감소한다. 이 때, 비소 농도의 감소 폭이 철의 농도 감소 폭보다 크게 나타나는데, 이는 비소의 활성탄 표면에의 흡착에 기인한 것이라고 할 수 있다. 선행 연구에 따르면, 활성탄을 이용한 비소 산화 시 반응 초기에는 비소의 활성탄 표면 흡착으로 비소 농도가 감소하고 이후 활성탄 표면에 산소가 흡착되어 산화 반응을 촉진시키면서 5가 비소가 용액 중으로 탈착되어 나오는 것으로 알려져 있다4).
2단계인 10-48시간 구간에서는 전체 철 및 비소 농도는 점차적으로 감소하여 평형에 이르는 것으로 나타난다. 특히, 5 w/v%와 10 w/v% 실험의 경우 전체 비소 농도가 120-150 mg/L 수준까지 감소하여 대부분의 비소가 스코로다이트로 침전되는 것으로 분석된다. 1 w/v%에서는 전체 비소 농도가 1653 mg/L까지 감소하여 공기만 주입한 경우에 비해서는 향상된 비소 제거 거동을 나타낸다. 2단계에서 특이할만한 점은 3가 철의 거동인데, 2단계 초기 최소점에 도달하였다가 후반부로 가면서 점진적으로 증가하는 양상을 나타낸다. 최소점을 나타내는 시간 또한 활성탄 투입량에 따라 달라지는데, 1 w/v%, 5 w/v%, 10 w/v% 투입 시 각각 24시간, 24시간, 12시간 등이다. 이로부터 해당 시점까지 5가 비소와의 스코로다이트 침전 형성 반응이 가장 활발하게 일어났음을 파악할 수 있다. 점진적으로 3가 철의 농도가 증가하는 이유는 3가 철에 비해 농도가 낮은 5가 비소 중 많은 양이 제거되면서 침전 반응의 속도가 정체되어 3가 철 농도가 상대적으로 증가하는 것으로 해석할 수 있다.
마지막 3단계(48-72 시간 구간) 는 산화 및 침전 반응이 완료되는 단계로, 전체 철과 비소의 농도가 평형에 이르러 대체로 일정하게 유지된다. 5 w/v%와 10 w/v%에서는 비소가 각각 93%, 94% 제거되어 최종 용액 중 비소 농도가 210 mg/L, 194 mg/L에 이른다. 1 w/v%에서는 충분한 산화 조건이 형성되지 않아 최종적으로 56%의 비소가 제거된 것으로 나타났다(최종 전체 비소 농도 1318 mg/L). 제거된 철은 Fe : As 의 비로부터 대체로 스코로다이트 형성에 기여한 것으로 파악된다(1 w/v% 1 : 1.28, 5 w/v% 1 : 1.19, 10 w/v% 1 : 1.05). 또한, 활성탄 투입량이 증가함에 따라 최종 Fe : As 비가 증가하는 것으로부터 활성탄 표면에 금속의 흡착(특히 Fe의 흡착) 이 증가했음을 알 수 있다.
Fig. 3은 산화제로 H2O2를 사용한 결과를 나타낸다. 30% H2O2 1 mL를 침출 용액에 가하여 초기 Eh 값이 660 mV가 되도록 하였다. 해당 Eh 값은 공기만을 주입한 실험에서의 최종 Eh인 677 mV에 근소한 값이다. 실험 결과, Eh가 높게 형성되었기 때문에 초기부터 3가 철의 농도가 현저히 높게 나타났다. 전체 철 및 비소의 농도는 초기 10시간까지 대체로 일정하게 유지되었으며, 10시간 이후 두 금속의 농도는 점진적으로 감소하여 48시간 지점에서 각각 4320 mg/L, 647 mg/L까지 감소하였다. 72시간까지 전체 철 및 비소의 농도는 각각 4050 mg/L, 470 mg/L까지 감소하며 평형에 이르는 것으로 나타났다. 이로부터 비소 제거율은 85%로 계산되었다.
H2O2를 이용한 실험에서 특이할만한 점은 비소 농도가 48시간부터 평형에 도달하고 난 후 5가 비소가 용액상에서 검출되지 않았다는 점이다. 3가 비소가 용액상에 현저히 남아있고(470 mg/L) 최종 Eh값이 725 mV로 상당히 높음에도 불구하고 5가 비소로의 산화가 더 진행되지 않았다. 식 (1),(2)에 나타난 비소와 철의 H2O2에 의한 산화 반응식으로부터 3가 비소와 2가 철이 5가 비소 및 3가 철로 산화되기 위해서는 각각 H2O2 1, 0.5 당량이 필요한 것을 알 수 있다. 그러나 본 연구에 사용된 침출 용액 내 비소와 철의 농도는 몰 농도로 환산 시 각각 약 0.04 M, 0.12 M이며, 투입된 H2O2의 농도는 0.04 M로 계산된다. 즉, 비소와 철이 충분히 산화되어 스코로다이트로 제거되기 위해서는 약 1.5배 정도의 H2O2가 더 필요한 것으로 계산되며(스코로다이트의 Fe : As 몰 비율이 1 : 1이므로), 따라서 충분한 산화 반응을 진행시키기 위한 산화제 부족으로 완전한 산화가 일어나지 않은 것으로 분석되었다. 이는 유사한 Eh 수준에도 불구하고 활성탄 실험과 상당히 비교되는 부분으로, 비소의 산화 및 제거에 활성탄 표면이 부가적인 반응을 제공하였음을 나타낸다.
3.1.2. 조건별 산화 속도 분석
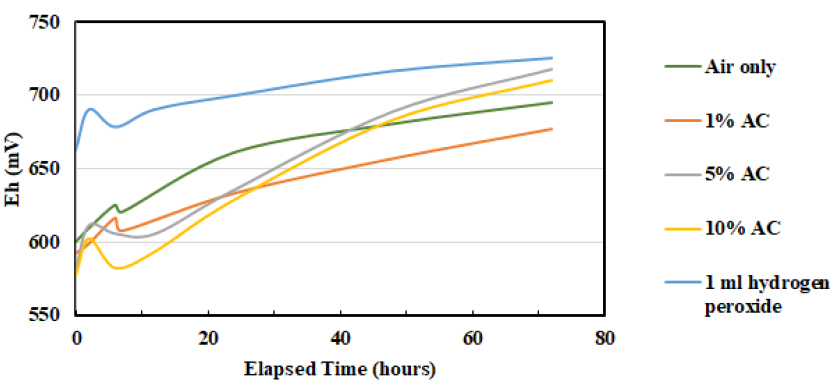
산화 반응의 속도 분석을 위해 각 반응의 시간에 따른 Eh 값을 Fig. 4에 나타내고 Table 2에 특정 시간 구간에 대해 시간에 따른 Eh 변화율을 실험 조건 별로 계산하여 나타내었다. 분석 결과에 따르면, 산화 반응의 속도를 나타내는 Eh 변화율은 활성탄을 5 w/v% 이상 투입하였을 때 가장 높게 측정되었다. 5 w/v%와 10 w/v%의 활성탄을 투입하였을 때, 시간 구간에 따라 변화율이 다소 상이하게 나타나는 부분이 있으나 후반부로 가면서 대체로 비슷한 속도로 반응이 진행됨을 파악할 수 있다.
Table 2.
Rate of Eh change at 3 different time intervals under different test conditions
공기만 주입한 경우와 1 w/v% 활성탄을 투입한 경우 0-72 hr, 6-72 hr 구간에서는 공기만 주입한 경우가 더 빠른 것으로 나타났으나, 후반부인 24-72 hr 구간에서는 1 w/v% 활성탄을 투입한 경우에 산화 속도가 다소 빨라지는 것으로 나타났다. 이는 Fig. 1 및 Fig. 2(a1), (a2)를 비교하였을 때, Fig. 2(a1), (a2)에서 전체 철 및 비소 농도가 후반부에 더 감소하는 것으로부터 산화 반응이 활발히 일어났음을 또한 확인할 수 있다.
H2O2를 투입한 경우, 반응 초기부터 전체 구간에서 절대적인 Eh 값은 높게 유지되지만 Eh 변화율은 가장 낮게 측정되었다. 이는 초기에 이미 높은 Eh가 형성된 후 해당 용액 내에서 금속 이온들이 유지할 수 있는 Eh 값의 한계에 다다랐기 때문인 것으로 판단된다. 또한, 산화 반응 속도도 빠르지 않아서 10시간 이후 점진적으로 3가 철과 5가 비소 간의 반응이 일어난 것으로 확인된다.
위의 결과로부터 산화 반응에서 활성탄의 존재는 산화 반응의 속도를 촉진시키는 효과가 있음이 확인되었다. 특히, 3.1.1절에서도 언급되었듯이 활성탄 표면에서 제공된 반응을 통해 비소의 산화가 촉진된 것으로 보인다. 선행 연구에 따르면, 활성탄이 수화되었을 때, 활성탄 표면에 카르복시기(carboxyl), 하이드록시기(hydroxyl), 페놀기(phenol), 퀴논(quinone), 에스터(ester) 그룹 등의 작용기가 생성되는 것으로 알려져 있다. 해당 작용기들의 활성탄 표면에서의 생성 반응은 식 (3),(2),(5) 와 같이 나타낼 수 있다4).
활성탄 표면에 생성된 위 작용기들은 주입된 공기 중 산소와 반응하여 금속 이온의 산화 반응을 촉진시키는 H2O2, OH 라디칼 등을 생성한다14). 따라서 이와 같은 활성탄 표면에서의 지속적인 산화제 생성으로 인해 공기를 단독으로 주입하거나 H2O2를 투입한 경우에 비해 활성탄 존재 시 금속의 산화 반응이 더욱 촉진되었다고 할 수 있다. 위와 같은 활성탄 표면의 작용기로 인한 반응과 더불어 활성탄 표면의 금속 이온 흡착 또한 높은 비소 제거율에 기여했다고 할 수 있는데, 활성탄 실험과 H2O2를 투입한 실험에서 Eh는 비슷한 수준으로 나타나지만 전체 비소 농도가 큰 차이를 보이는 것으로부터 이를 파악할 수 있다(10 w/v% AC: 194 mg/L As, H2O2: 470 mg/L As).
3.2. 침전물 분석
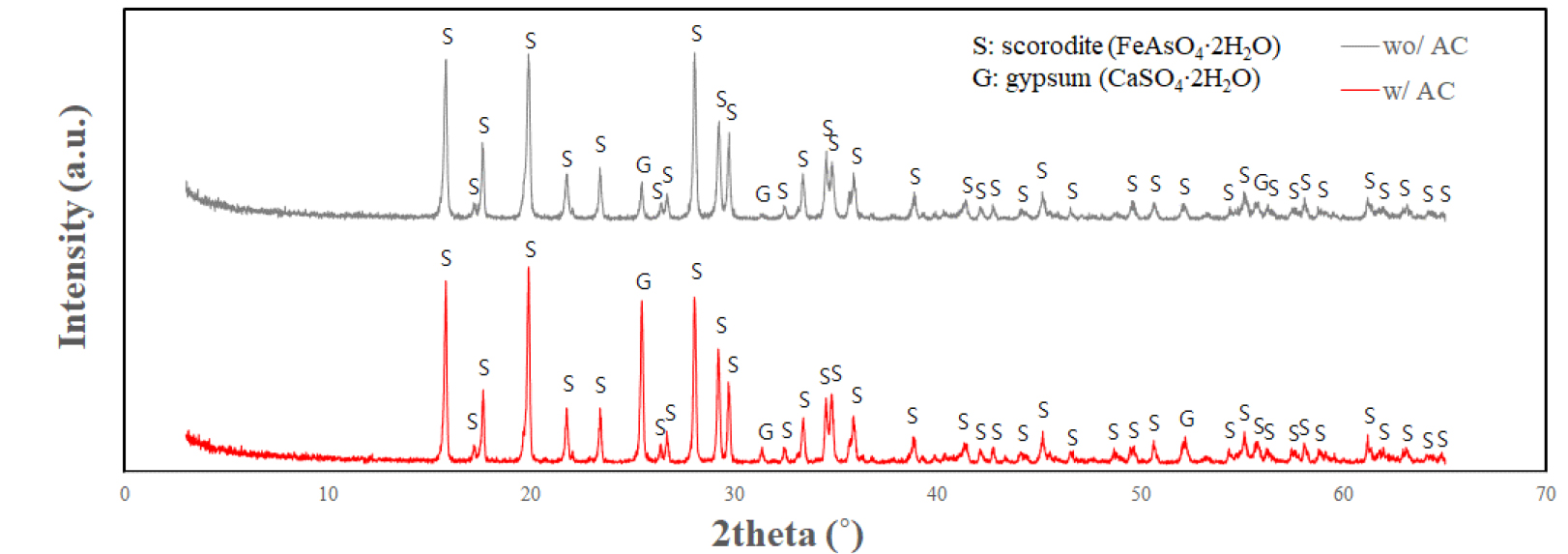
산화 반응을 통해 생성된 침전물에 대해 XRD를 이용하여 결정상을 분석하였다. 활성탄을 투입한 경우와 그렇지 않은 경우를 비교하기 위하여 공기 단독 주입 실험과 1 w/v% 활성탄 투입 실험으로부터 획득한 침전물에 대해 분석을 수행하였다.
분석 결과 Fig. 5와 같이 활성탄 투입 여부에 관계없이 산화 반응을 통해 스코로다이트가 생성되었음을 확인하였다. 스코로다이트 생성 반응의 경우 일단 용액 중에 3가 철과 5가 비소가 존재하면 25-85°C 구간에서 온도가 높아질수록 Ksp 값이 감소하기 때문에 높은 온도에서 스코로다이트가 잘 생성되는 것으로 알려져 있다15,16). 따라서 활성탄 존재 여부와 관계없이 모든 실험에서 철과 비소의 산화가 확인되었기 때문에 스코로다이트가 잘 생성되었다고 할 수 있다. 또한 스코로다이트 생성과 더불어 침출 용액 중 400-600 mg/L의 Ca가 황산 이온의 존재로 인해 이수석고(gypsum, CaSO4·2H2O)로 일부 공침되는 것을 확인하였다.
4. 결 론
본 연구에서는 고농도 비소 함유 황화 광석 침출 용액에 대하여 공기와 활성탄을 병용하여 비소를 산화 및 침전 제거하는 연구를 수행하였다. 황비철석과 황철석을 주요 광물로 함유하는 국내 황화 광석을 pH 1, 50°C 조건의 황산 용액에서 95시간동안 침출하여 고농도 비소 용액을 제조하였으며, 침출 용액 내 금속 이온 농도 분석 결과 Fe가 약 7 g/L, As가 약 3 g/L 함유된 것으로 측정되었다. 이는 해당 광석의 미생물 침출 시 획득한 금속 농도에 상응하는 수준으로, 자연계에서 용출 가능한 비소 및 금속 농도 수준에 대해 비소 제거 연구를 수행하였다. 공기 및 활성탄 병용 시 비소의 산화 및 제거 효과를 파악하기 위해 해당 침출 용액에 대하여 5가지 산화 조건(공기 주입, 공기와 1, 5, 10 w/v% 활성탄 투입, H2O2 투입) 하에서 초기 pH 1, 90°C에서 72시간동안 반응시키며 금속 성분의 산화 및 침전 거동을 비교·분석하였다. 실험 결과, 공기와 활성탄을 함께 투입한 경우 활성탄 표면에 생성된 작용기로 인해 산화 반응의 속도와 비소 제거율이 향상되는 것으로 분석되었다. 또한, 활성탄의 투입량이 1, 5, 10 w/v%로 증가할 때 비소 제거율은 56, 93, 94% 등으로 향상되었으며, 5 w/v% 이상의 활성탄 투입 시에는 산화 및 침전 거동이 유사한 것으로 나타나 5 w/v%의 활성탄 투입으로도 충분한 반응이 가능한 것으로 파악되었다. 반면에 공기만을 주입하였을 경우 느린 산화 반응 속도로 인해 72시간 후 반응 종료 시 비소 제거율은 33%로 매우 낮은 수준을 나타내었으며, H2O2가 강력한 산화제임에도 불구하고 산화제의 빠른 소모로 용액 중 비소가 완전히 제거되지 않았다. 침전 생성물에 대한 XRD 분석 결과 용액 중 3가 철과 5가 비소로의 산화가 일어나면 스코로다이트(FeAsO4·2H2O)로의 침전이 용이하게 생성되는 것으로 나타났다.